热水处理对冷藏新余蜜橘活性氧代谢的调节*
2014-12-16陈楚英陈明周梦娇韩舒睿陈金印
陈楚英,陈明,周梦娇,韩舒睿,陈金印
(江西农业大学,江西省果蔬保鲜与无损检测重点实验室,江西南昌,330045)
新余蜜橘是新余市科技工作者1977年从本地早中选育出的优良特色宽皮柑橘品种,属于高糖、低酸、VC含量丰富的果品[1]。但由于新余蜜橘采后代谢旺盛,果皮薄、松脆,易碰伤造成烂果现象,在贮运过程中易遭受微生物侵染,严重限制了新余蜜橘相关产业的健康发展。
热处理作为一种控制果蔬采后腐烂的物理保鲜方法,具有安全无毒、无化学残留、操作简单、成本低等优点,成为近年来果蔬保鲜研究的热点。大量的研究报道指出,贮前短时热处理可以降低果蔬对低温的敏感性,提高果蔬抗寒、抗病能力以及贮藏效果[2-6]。Sala等[7]研究报道热水(53 ℃、3 min)和热空气(37℃、3 d)处理均可以提高“Fortune”和“Clementine”柑橘果实 CAT、SOD、APX、GR 的活性,降低果实的自由基含量,减少果实冷害的发生。Lafuente[8]等研究了热空气处理(37℃、3 d)可以使“Fortune”柑橘果实AsA和多酚抗氧化物质的含量分别提高为原来的1.7倍和2.1倍,且抗氧化物质在2℃冷藏中能够保持较高的含量,提高了果实的抗氧化能力,减少了果实冷害的发生几率。可见,保持植物体内较高的抗氧化酶活性和抗氧化物质含量,可减少自由基和活性氧的积累,延缓果实的衰老。目前活性氧代谢在果实成熟衰老中的研究大多集中在植物果实采前[9-11],而活性氧代谢变化在果实采后贮藏方面的研究较少;近年来,国内外众多科研人员对热处理果实贮藏保鲜进行了多项试验性研究,但是主要还是集中在应用研究上,其作用机理的研究进展缓慢[2,4,12-15]。本文作者研究了新余蜜橘果实在冷藏下活性氧与抗氧化酶活性和抗氧化物质含量的变化,对热处理后新余蜜橘果实的活性氧代谢作初步探讨,以探索采后热处理在新余蜜橘果实贮藏保鲜中应用的可能性。
1 材料与方法
1.1 实验材料
供试新余蜜橘(Citrus reticulata Blanco)果实于2012年10月24日采自于江西省新余市。采后立即装箱当天运回实验室,预贮2 d。挑选大小一致、色泽均匀、无病虫害和机械损伤的健康果实分成2组,一组为对照组(CK);另一组为热水处理组(HWD)。热水处理53℃、3 min,自然晾干后,用PE保鲜袋(d=0.03 mm)包装,于(5±0.5)℃(RH 80% ~95%)条件下贮藏。
1.2 实验方法
1.2.1 过氧化氢(H2O2)含量的测定
参考邹琦方法[16]。称取5.0果皮,加入8.0 mL预冷的丙酮,在通风橱中冰浴条件下研磨成浆,离心(4℃、10 000 r/min,20 min),收集上清液。取1.0 mL上清液,加入0.1 mL 5%硫酸钛溶液和0.2 mL浓氨水,混匀反应 5 min后,4℃、10 000 r/min离心 15 min,取沉淀再用-20℃预冷丙酮反复洗涤3~5次,直至出去色素,最后将沉淀溶于3.0 mL 2mol/L H2SO4溶液中,以丙酮做空白参比,于415 nm测定吸光度值,重复3次。按同样的方法制作H2O2标准曲线,H2O2含量以μmol/g表示。
1.2.2 丙二醛(MDA)含量的测定
采用硫代巴比妥酸(TBA)法[17]。称取1.0 g果皮,加入10 mL 0.05 mol/L、pH 7.8磷酸缓冲液冰浴条件下研磨成浆后,离心(4℃、10 000 r/min,15 min),上清液为样品提取液。取上清液2 mL,加入2 mL 0.5%硫代巴比妥酸溶液,混匀后于沸水浴中反应30 min,迅速冷却后在离心(4℃、6 000 r/min,10 min)。以0.5%硫代巴比妥酸溶液为空白对照,测定上清液在532、600和450 nm波长下的吸光值。

1.2.3 超氧化物歧化酶(SOD)酶活性测定
参考Sala方法测定[18],SOD活性以每克新余蜜橘果皮抑制氮蓝四唑(NBT)光化还原的50%为一个酶活性单位(U)表示。SOD活性单位以U/g表示。重复测定3次。
1.2.4 过氧化氢酶(CAT)活性测定
参考Bassal方法测定[2]。从加入酶液 15 s开始记录每30 s反应体系在240 nm的吸光度值,连续3 min。以每分钟吸光度变化值减少0.01为1个CAT活性单位(U)。CAT酶活性表示为U/g。
1.2.5 抗坏血酸(AsA)含量测定
采用2,6-二氯酚靛酚法测定,结果以mg/100 g表示。
1.2.6 还原型谷胱甘肽(GSH)含量测定
参考 Brehe和Burch方法[19]。称取3.0 g果皮,加入5 mL经4℃预冷、含50 g/L TCA溶液(含5 mmol/L EDTA-Na2)在冰浴条件下研磨匀浆,离心(4℃、10 000 r/min,20 min),上清液为样品提取液。取1.0 mL上清液,加入1.0 mL 0.1mol/L、pH 7.7磷酸缓冲液和 0.5 mL 4 mmol/L DTNB溶液(用 0.1 mol/L、pH 6.8磷酸缓冲液配制),于25℃保温反应10 min,测定412 nm吸光值。参比空白加 0.5 mL 0.1 mol/L、pH 6.8磷酸缓冲液代替 DTNB溶液,GSH含量表示为μg/g。重复测定3次。
1.2.7 过氧化物酶(POD)活性测定
参考曹建康方法[20],并稍加修改。取1支试管,加入3.0 mL 25 mmol/L愈创木酚和0.2 mL酶提取液,再加入0.2 mL 0.5mol/L H2O2溶液迅速混合启动反应,同时开始计时。以蒸馏水为参比,在反应15 s时开始记录反应体系每30 s在470 nm的吸光度值,连续测定3 min。以每克样品每分钟吸光度变化值增加1时为1个POD活性单位(U)。酶活性表示为U/g。重复测定3次。
1.2.8 抗坏血酸过氧化物酶(APX)活性测定
参考Asada方法[21],并稍加修改。称取2.0 g样品,加入5 mL经4℃预冷的50 mmol/L、pH 7.0磷酸缓冲液(含0.1 mmol/L EDTA、1 mmol/L抗坏血酸和1%PVP),冰浴研磨匀浆4℃、10 000 r/min离心30 min,收集上清液即为酶提取液。取1支试管依次加入2.6 mL反应缓冲液(含0.1 mmol/L EDTA和0.5 mmol/L抗坏血酸)和0.2 mL酶提取液,最后加入0.3 mL的2 mmol/L H2O2溶液启动反应,连续记录测定室温下OD290的变化,以蒸馏水为参比对照。以每克样品每分钟吸光度变化值减少0.01为1个APX活性单位(U),酶活性以U/g表示。
1.3 数据处理方法
所有实验数据为3次重复的平均值和标准差,采用DPS v8.01数据处理系统进行差异性分析,采用SimaPlot 12.3软件作图。
2 结果与分析
2.1 热处理对新余蜜橘过氧化氢含量的影响
植物体内积累的H2O2可以直接或间接导致细胞膜脂质过氧化,加速衰老进程,其含量在一定程度上可反映果实在逆境下细胞膜脂过氧化程度。如图1所示,热处理和对照的新余蜜橘果实H2O2含量在冷藏的最初20 d内急剧增加,在随后80 d内有下降趋势,在贮藏100 d又出现一定程度回升,变化趋势大致相同。在贮藏前期,热处理的果实H2O2含量显著高于对照处理(P<0.05),这表明热处理提高了新余蜜橘采后果皮中H2O2含量。

图1 热水处理对新余蜜橘果实H2O2含量的影响Fig.1 Effect of heat water dipping on H2O2content of Xinyu tangerine
2.2 热处理对新余蜜橘丙二醛(MDA)含量的影响
MDA是植物衰老过程中膜脂过氧化作用的主要产物之一,其含量的积累会使膜脂过氧化加强,在一定程度上可反映果实在逆境下细胞膜脂过氧化程度。如图2所示,热处理和对照的果实MDA含量在贮藏20 d前差异不显著,随着贮藏时间的延长,对照处理的MDA含量明显上升,而热处理果实的MDA的增加量始终低于对照。在整个冷藏期间,热处理与对照的差异达显著水平(P<0.05),说明HWD处理可以抑制新余蜜橘果实MDA含量的上升,从而延缓果实后熟衰老的进程。

图2 热水处理对新余蜜橘果实MDA含量的影响Fig.2 Effect of heat water dipping on MDA content of Xinyu tangerine
2.3 热处理对新余蜜橘超氧化物歧化酶(SOD)活性的影响
由图3可知,在贮藏前期,各处理中SOD活性逐渐升高,至贮藏中期时达到最大值,随后活性迅速降低。热处理和对照果实的SOD活性在贮藏40 d同时达到活性高峰,峰值分别为39.48 U/g和29.72 U/g,两者极显著(P<0.01);在贮藏中后期(≥50 d),热水处理的SOD活性仍保持较高水平,显著高于对照组(P<0.05),这说明热处理能提高果实的SOD活性并抑制其在贮藏后期的下降。

图3 热水处理对新余蜜橘果实SOD活性的影响Fig.3 Effect of heat water dipping on SOD activity of Xinyu tangerine
2.4 热处理对新余蜜橘过氧化氢酶(CAT)活性的影响
新余蜜橘贮藏过程中CAT活性的变化见图4,各处理新余蜜橘的CAT活性变化趋势大致相同,均是先上升,达到活性高峰后开始下降。热处理和对照果实的CAT活性分别在贮藏60 d和80 d时达到活性高峰,峰值分别为124.3 U/g和89.2 U/g;在贮藏中后期,热处理的新余蜜橘果实CAT活性极高于对照组,差异极显著(P<0.01),说明热处理可以在一定程度上提高新余蜜橘对逆境胁迫的抵抗能力,延缓衰老过程,延长贮藏时间。

图4 热水处理对新余蜜橘果实CAT活性的影响Fig.4 Effect of heat water dipping on CAT activity of Xinyu tangerine
2.5 热处理对新余蜜橘抗坏血酸(AsA)含量的影响
抗坏血酸(AsA)是一种重要的抗氧化剂,可以适当清除果蔬正常代谢所产生的自由基,保护细胞组织免受膜质氧化而延缓果实衰老的进程,同时AsA含量的高低直接反映新余蜜橘果实品质的优劣。由图5可知,在整个冷藏期间,新余蜜橘果实AsA含量总体都呈先上升后逐渐下降的变化趋势,热处理和对照的AsA含量在贮藏20 d达到最大值,热处理AsA含量的峰值极显著高于对照组(P<0.01);在贮藏结束时,对照组由峰值的27.72 mg/100 g降至17.98 mg/100 g,HWD处理由峰值的30.74 mg/100 g降至19.85 mg/100 g,这说明热处理能适当提高新余蜜橘的AsA含量,有利于延缓AsA含量的下降。
2.6 热处理对新余蜜橘还原性谷胱甘肽(GSH)含量的影响
还原型谷胱甘肽(GSH)是植物非酶清除体系中一种重要的抗氧化剂,可以适当清除果蔬正常代谢所产生的自由基,GSH含量直接反映新余蜜橘抵御活性氧伤害的能力。热处理对新余蜜橘果实GSH含量的影响见图6,其变化趋势与AsA相似,在贮藏的前20 d有一个上升过程,达到一定值后开始下降。在整个冷藏周期里,热处理的新余蜜橘GSH含量高于对照组,说明热处理可以适当提高新余蜜橘GSH含量的上升并同时抑制其下降速度,使新余蜜橘在贮藏中后期保持较高的GSH含量。
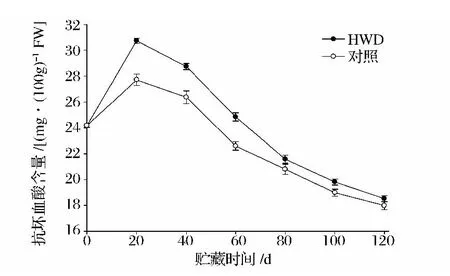
图5 热水处理对新余蜜橘果实AsA含量的影响Fig.5 Effect of heat water dipping on AsA content of Xinyu Tangerine

图6 热水处理对新余蜜橘果实GSH含量的影响Fig.6 Effect of heat water dipping on GSH content of Xinyu Tangerine
2.7 热处理对新余蜜橘过氧化物酶(POD)活性的影响
过氧化物酶(POD)是植物体内抵御活性氧伤害的重要酶类,对减少活性氧积累、抵御膜脂过氧化作用和维护膜结构的完整性有着重要作用,如图7所示,对照果实的POD活性在整个贮藏过程中呈双峰的变化趋势,2个峰值分别出现在贮藏20 d和80 d,且第一个峰值高于第二个;而热处理的新余蜜橘果实POD活性呈单峰变化趋势,在贮藏100 d达到活性后开始下降。在贮藏中后期,热处理的新余蜜橘POD活性高于对照,两者差异极显著(P<0.01),说明热处理可以有效延缓新余蜜橘果实POD活性高峰的出现并抑制其下降速度。
2.8 热处理对新余蜜橘抗坏血酸过氧化物酶(APX)活性的影响
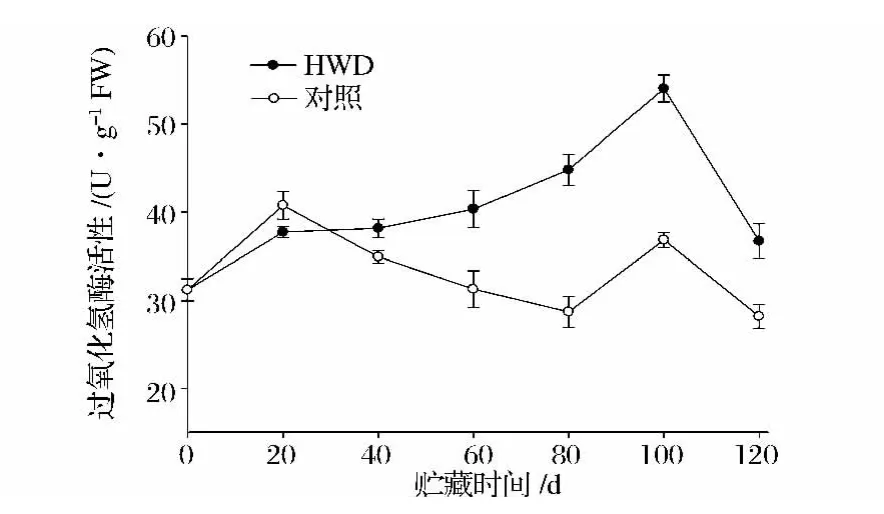
图7 热水处理对新余蜜橘果实POD活性的影响Fig.7 Effect of heat water dipping on POD activity of Xinyu Tangerine
抗坏血酸过氧化物酶(APX)是抗坏血酸-谷胱甘肽(AsA-GSH)循环的关键控制酶,能催化AsA与H2O2发生氧化还原反应,达到清除H2O2的目的。APX活性在新余蜜橘果实采后冷藏过程中的变化见图8,随着果实的成熟衰老,其活性呈先升高后下降的变化趋势。热处理和对照在贮藏100 d时候达到APX活性高峰,峰值分别为305.4 U/g和265.3 U/g,在整个冷藏周期里,热处理的果实APX活性活性高于对照,这说明热处理能提高果实的APX活性并抑制其在贮藏后期的下降。
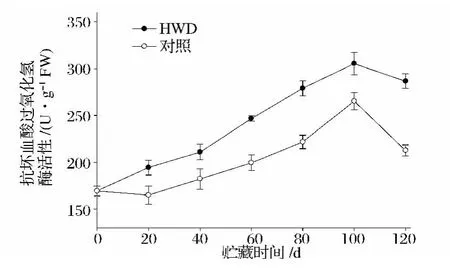
图8 热水处理对新余蜜橘果实APX活性的影响Fig.8 Effect of heat water dipping on APX activity of Xinyu Tangerine
3 讨论
果实采后的衰老与组织内活性氧代谢的失调和细胞膜质的过氧化作用密切相关。一般认为,果实衰老是由于贮藏时间的延长,果实机体内清除活性氧自由基能力下降,使活性氧自由基水平升高,活性氧促使细胞发生膜脂过氧化而引发细胞膜功能的丧失和细胞膜组织结构的解体导致果实伤害。
近年来,研究发现H2O2是植物体内一个新的信号转导分子,因而H2O2与植物抗病性的关系成为新的研究热点。目前,人们对活性氧与抗病防卫反应信息传递的关系存在以下两种解释:一种观点认为细胞代谢产生的H2O2直接作为二级信使参与植物抗病防卫反应;另一种观点认为细胞产生的H2O2通过激活膜脂过氧化反应,产生某些不饱和脂肪酸的过氧化物作为信号分子,诱发植物的各种防卫反应。许多研究还表明,在诱导处理的前期,果实的活性氧水平迅速升高[22-23],本试验研究结果与上述结果相似,经热处理后的新余蜜橘果皮中H2O2含量在贮藏前期明显高于对照;同时热处理降低了新余蜜橘果实在冷藏过程中MDA含量的积累,使细胞膜渗透率上升的速度降低,降低膜脂过氧化的程度,这很可能与热处理提高新余蜜橘的抗病性有关。
SOD、CAT、POD和APX是植物体内酶促活性氧清除系统的主要酶类,可有效地清除活性氧自由基,保持体内活性氧平衡,其活性的高低可以作为判断果实耐贮性指标和衰老的标志[24]。SOD是主要的活性氧清除酶,主要催化O2-的歧化反应,使其转变成为无毒的O2和毒性较低的H2O2;POD也是细胞内清除活性氧的保护酶之一,同时还可催化形成抑菌的醌类物质,提高果实的抗病性;CAT、APX主要通过不同的途径将H2O2分解为H2O和O2。AsA、GSH都是植物体内活性氧非酶清除体系,这2种抗氧化物质的损失将导致植物抵抗活性氧伤害能力的降低[25],保持AsA-GSH代谢循环的稳定对维持细胞正常的生理代谢尤为重要[26]。因此,保持植物体内较高的活性氧清除酶活性和非酶抗氧化物质含量,可减少活性氧的积累,从而有效地防止超氧阴离子自由基和MDA的积累,延缓果实衰老。
本试验通过热处理影响新余蜜橘体内H2O2代谢酶的活性,与对照相比,热处理能够有效增强果实的活性氧清除酶类SOD、CAT、POD和APX活性,这与Sala和寇莉萍等人利用37℃热空气处理3 d和45℃热水浸泡8 min作用在‘Fortune’柑橘和葡萄果实上的研究结果一致[7,27]。试验结果表明,热处理能够影响新余蜜橘体内 AsA-GSH循环,提高果实AsA和GSH含量并延缓AsA和GSH含量在贮藏后期降解速率,这与前人利用壳聚糖处理柑橘果实诱导抗病性的研究上也有类似的结果[23,28]。
综上所述,热处理可以延缓或降低新余蜜橘果实MDA的积累;提高果实AsA和GSH含量并延缓AsA和GSH含量在贮藏后期下降速度;增强果实的活性氧清除酶类SOD、CAT和APX的活性,从而降低过多的活性氧引起的膜功能和结构的破坏,使之能更好地维持细胞内膜系统的区域化作用和膜结构的完整,延缓果实的衰老进程。此外,SOD、CAT、POD和 APX酶活性的不同变化可能也暗示了贮藏期间新余蜜橘果实内部不同自由基的存在和转化状态,这有待于进一步研究。
4 结论
通过53℃、3 min热水处理对新余蜜橘采后活性氧代谢调节的研究表明:热处理能够显著降低新余蜜橘果实MDA含量的增加,通过增强果实抗病信号分子H2O2的积累水平,提高果实的抗氧化酶SOD、POD和CAT活性和抗氧化物质AsA和GSH含量来调控采后新余蜜橘果皮中活性氧代谢的平衡,使果实体内活性氧保持在一个较低的水平,降低活性氧对其自身的危害,延缓果实的衰老进程。
[1] 徐章彬,胡林英,饶兵英.从新余蜜橘产业看江西果业发展方向[J].现代园艺,2007(3):2-3.
[2] Bassal Magdi,El-Hamahmy Mohamed.Hot water dip and preconditioning treatments to reduce chilling injury and maintain postharvest quality of navel and valencia oranges during cold quarantine[J].Postharvest Biology and Technology,2011,60(3):186-191.
[3] Ghasemnezhad Mahmood,Marsh Ken,Shilton Rebecca,etc.Effect of hot water treatments on chilling injury and heat damage in‘satsuma’mandarins:Antioxidant enzymes and vacuolar atpase,and pyrophosphatase [J].Postharvest Biology and Technology,2008,48(3):364-371.
[4] Porat Ron,Daus Avinoam,Weiss Batia,etc.Reduction of postharvest decay in organic citrus fruit by a short hot water brushing treatment[J].Postharvest Biology and Technology,2000,18(2):151-157.
[5] Rodov V,Ben-Yehoshua S,Albagli R,et al.Reducing chilling injury and decay of stored citrus fruit by hot water dips[J].Postharvest Biology and Technology,1995,5(1/2):119-127.
[6] Plaza Pilar,Usall Josep,Torres Rosario,et al.Control of green and blue mould by curing on oranges during ambient and cold storage[J].Postharvest Biology and Technology,2003,28(1):195-198.
[7] Sala Jose M,Lafuente María T.Catalase enzyme activity is related to tolerance of mandarin fruits to chilling[J].Postharvest Biology and Technology,2000,20(1):81-89.
[8] Lafuente María T,Ballester Ana R,Calejero Joaquín,et al.Effect of high-temperature-conditioning treatments on quality,flavonoid composition and vitamin c of cold stored‘fortune’mandarins[J].Food Chemistry,2011,128(4):1 080-1 086.
[9] Gill Sarvajeet Singh,Tuteja Narendra.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemis-try,2010,48(12):909-930.
[10] Cheng Guiping,Duan Xuewu,Shi John,et al.Effects of reactive oxygen species on cellular wall disassembly of banana fruit during ripening [J].Food Chemistry,2008,109(2):319-324.
[11] Kan Juan,Wang Hong-mei,Jin Chang-hai,et al.Changes of reactive oxygen species and related enzymes in mitochondria respiratory metabolism during the ripening of peach fruit[J].Agricultural Sciences in China,2010,9(1):138-146.
[12] Hong Seok-In,Lee Hyun-Hee,Kim Dongman.Effects of hot water treatment on the storage stability of satsuma mandarin as a postharvest decay control[J].Postharvest Biology and Technology,2007,43(2):271-279.
[13] 刘风娟,邵兴锋,屠康,等.采后热处理对枇杷果实冷藏期间品质的影响[J].果树学报,2009,26(5):649-653.
[14] 田维娜,曾凯芳.热处理对果蔬采后贮藏特性的影响[J].食品工业科技,2007,28(12):190-193.
[15] Birla S L,Wang S,Tang J,et al.Quality of oranges as influenced by potential radio frequency heat treatments against mediterranean fruit flies[J].Postharvest Biology and Technology,2005,38(1):66-79.
[16] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[17] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[18] Sala José M,Lafuente María T.Antioxidant enzymes activities and rindstaining in‘navelina’oranges as affected by storage relative humidity and ethylene conditioning[J].Postharvest Biology and Technology,2004,31(3):277-285.
[19] Brehe Jacqueline E,Burch Helen B.Enzymatic assay for glutathione[J].Analytical Biochemistry,1976,74(1):189-197.
[20] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].中国轻工业出版社,2007.
[21] Asada Kozi.Assay of ascorbate-specific peroxidase[J].Methods in Enzymology,1984,105:427-429.
[22] Sanchez-Casas P,D F Klessig.A salicylic acid binding activity and a salicylic acid inhibitable catalase activity are present in a variety of plant species[J].Plant Physiology,1994,106(4):1 675-1 679.
[23] 邓雨艳,明建,张绍其,等.壳聚糖诱导脐橙果实抗病性、水杨酸及活性氧代谢变化[J].中国农业科学,2010,43(4):812-820.
[24] 田世平,徐勇,姜爱丽.冬雪蜜桃在气调冷藏期间品质及相关酶活性的变化[J].中国农业科学,2001,34(12):656-661.
[25] Noctor G H.Foyer C.Ascorbate and glutathione:Keeping active oxygen under control[J].Annu Rev Plant Physiol Plant Mol Biol,1998,49(1):249-279.
[26] Foyer C H,Descourvieres P,Kunert K J.Protection against oxygen radicals:An important defense mechanism studied in transgenic plants[J].Plant Cell Environment,1994,17(2):507-523.
[27] 寇莉萍,刘兴华,黄彦博,等.热水处理对轻度加工葡萄粒保护酶活性和膜脂过氧化的影响[J].中国食品学报,2006,6(4):111-115.
[28] Zeng Kaifang,Deng Yuyan,Ming Jian,et al.Induction of disease resistance and ros metabolism in navel oranges by chitosan[J].Scientia Horticulturae,2010,126(2):223-228.
