聚缬氨酸修饰电极伏安法测定曲酸*
2014-12-16马心英陈美凤李方珍
马心英,陈美凤,李方珍
(菏泽学院化学化工系,山东菏泽,274015)
曲酸(kojic acid,麴酸)是大多数曲霉属和青霉属真菌产生的一种常见的弱酸性代谢产物,化学名称为 5-羟基-2-羟甲基-γ-吡喃酮[1-2],存在于酱油、豆瓣酱、酒类等酿造产物中,有抗菌和多酚氧化酶抑制作用,近年来由于曲酸在食品、化妆品及药物中的广泛应用,其安全性成为人们关注的焦点。2005年,日本突然指出曲酸具有致癌性,并宣布禁止将曲酸作为食品添加剂使用[3]。尽管少量的曲酸不会对人体构成威胁[4],但研究表明连续过度使用曲酸会致癌[5-7],因此建立简单快速的曲酸测定方法非常有必要。目前,对曲酸的分析方法不多,已经报道的主要有分光光度法[8-9]、高效液相色谱法[3]、毛细管电泳法[10]。这几种方法的操作步骤复杂,检测时间长,检测费用高,对仪器要求高。采用电化学法检测曲酸[11-13]具有操作简单快速,选择性好,灵敏度高等优点,目前国内用电化学方法检测曲酸报道较少[14-15],特别是化学修饰电极法。电极表面经过修饰后,具有某些新功能,有利于提高电极的灵敏度和选择性、改善电极的稳定性和重现性[16-19]。氨基酸由于其分子结构含有羧基和氨基,作为化学修饰电极材料具有很多独特的性质,我们曾经用聚缬氨酸修饰电极成功测定去甲肾上腺素[20]。
本实验用聚缬氨酸修饰电极测定曲酸,研究了曲酸在修饰电极上的电化学行为,并用于食品中曲酸含量的测定。本修饰电极制备简单,选择性好,响应快,稳定性好,有较高的灵敏度,有较好的应用前景。
1 材料与方法
1.1 仪器和试剂
CHI660C电化学工作站,上海辰华仪器公司;PHS-3B型酸度计,上海精密科学仪器有限公司;KQ-100型超声波清洗器,昆山市超声波仪器厂;电化学实验用三电极系统,聚缬氨酸修饰电极为工作电极,铂丝电极为对电极,Ag/AgCl电极为参比电极。
曲酸标准品(中国药品生物制品检定所),用水配制成8.00×10-4mol/L溶液,避光保存;
缬氨酸(天津市光复精细化工研究所),配制成2.50×10-3mol/L溶液;
Na2HPO4-C6H8O7·H2O,配制成 PBS缓冲溶液;HAc-NaAc配制成ABS缓冲溶液。所用试剂均为分析纯,实验用水均为二次石英重蒸水。
1.2 聚缬氨酸修饰电极的制备
将玻碳电极(Φ=3.8 mm)在湿润的金相砂纸(粒度为2000)上磨光,然后在湿润的 Al2O3(0.05 μm)上抛光成镜面,依次用 HNO3(1∶1,V/V)、无水乙醇、二次石英亚沸蒸馏水超声清洗(1 min/次)。在5.00×10-4mol/L缬氨酸pH 8.0 PBS中,以玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极,在-1.4~2.6 V电位范围内,以140 mV/s扫描速率循环扫描9周,取出用二次蒸馏水淋洗电极表面,即制得聚缬氨酸修饰电极。
1.3 实验方法
在pH5.4 ABS中,加入一定量曲酸,以聚缬氨酸修饰电极为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极,在0.5~1.4 V电位范围内,以120 mV/s扫描速率进行循环扫描,记录峰电位和峰电流。每次扫描结束后,将电极置于空白底液中循环扫描至峰消失,用二次蒸馏水冲洗,滤纸吸干后,即可进行下一次测定。
2 结果与讨论
2.1 聚缬氨酸修饰电极电化学聚合条件
电化学聚合条件影响修饰电极的性能,测定不同的底物,聚缬氨酸修饰电极的聚合条件不同。对于曲酸的测定,讨论了制备聚缬氨酸修饰电极的聚合底液的pH、聚合高低电位、聚合周数及扫描速率。实验结果表明,在5.00×10-4mol/L缬氨酸pH8.0 PBS中,在-1.4~2.6 V电位范围内,以140 mV/s扫描速率循环扫描9周,所制备的修饰电极对曲酸的测定具有最大的电流响应,对曲酸的电化学氧化催化效果最好。图1为缬氨酸在最佳聚合条件聚合过程的循环伏安图。由图可见,在扫描2周之后,随扫描周数的增加,氧化峰电位正移,还原峰电位负移,而峰电流增加,但增加幅度减小,最后氧化峰和还原峰都达到了稳定。聚合完成后,可观察到玻碳电极表面有深蓝色膜存在,图2为聚缬氨酸修饰膜扫描电子显微镜图,表明缬氨酸在电极表面形成了多分子层修饰膜。
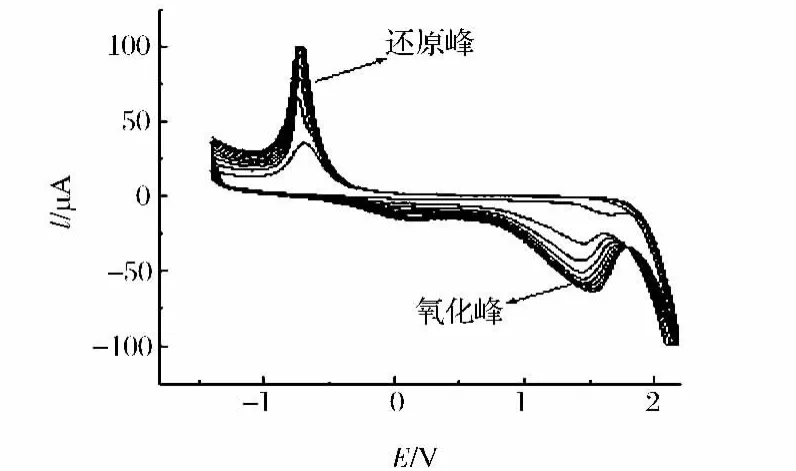
图1 缬氨酸在玻碳电极表面聚合过程的循环伏安曲线Fig.1 Cyclic voltammograms for electropolymerization of valine on a GCE surface
2.2 曲酸在聚缬氨酸修饰电极上的电化学特性
图3为曲酸分别在玻碳电极(1)、聚缬氨酸修饰电极(2)上的循环伏安曲线,由图3可见:曲酸在裸玻碳电极上的氧化峰电流为:ipa1=4.45 μA,而在聚缬氨酸修饰电极上氧化峰电流为:ipa2=9.45 μA,与裸玻碳电极相比,曲酸在聚缬氨酸修饰电极上的氧化峰电流明显增大1倍多,说明聚缬氨酸修饰膜对曲酸电化学氧化具有良好的催化作用,有利于曲酸在电极上的电化学氧化。从循环伏安曲线上未观察到还原峰,说明曲酸在修饰电极上的电极反应不可逆。

图2 聚缬氨酸修饰膜的扫描电子显微镜图Fig.2 SEM image of the surface of the poly(valine)modified electrode
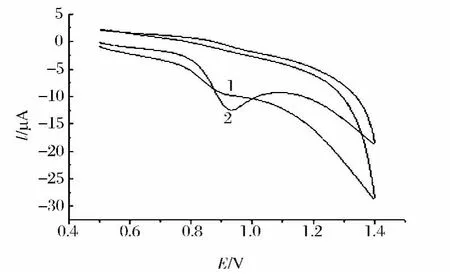
图3 曲酸在玻碳电极(1)和聚缬氨酸修饰电极(2)上的循环伏安曲线Fig.3 Cyclic voltammograms of kojic acid(1.00×10-4mol/L)at(1)the bare electrode and(2)the a poly(valine)modified electrode in pH 5.0 HAc-NaAc
2.3 测定曲酸的最佳条件
2.3.1 测定底液pH的影响
研究了曲酸在 H2SO4、HNO3、NH3·H2O-NH4Cl、KH2PO-Na2HPO4,HAc-NaAc等介质中的伏安行为,结果表明,在HAc-NaAc缓冲介质中曲酸在修饰电极上的氧化峰电流最大,因此选择HAc-NaAc缓冲溶液作为测定底液。由于氧化过程涉及到质子的参与,因此测定底液pH对电极反应的影响较大。固定其他实验条件不变,只改变测定底液的pH进行实验,结果表明pH在3.8~5.4的范围内随底液pH的升高,曲酸在修饰电极上氧化峰电流逐渐增大,当pH等于5.4时,曲酸氧化峰电流达到最大值,随后降低(图4),故本实验选pH为5.4的ABS为测定底液。实验结果还表明,曲酸氧化峰电位随着pH值的升高发生负移,在pH3.8~5.8之间,其线性回归方程为Epa=1.27-0.066pH,相关系数 r=0.992 5,斜率为0.066,接近0.059,说明曲酸在氧化过程中涉及质子的参与,且质子转移数等于电子转移数,其可能的电极反应式为[19]:
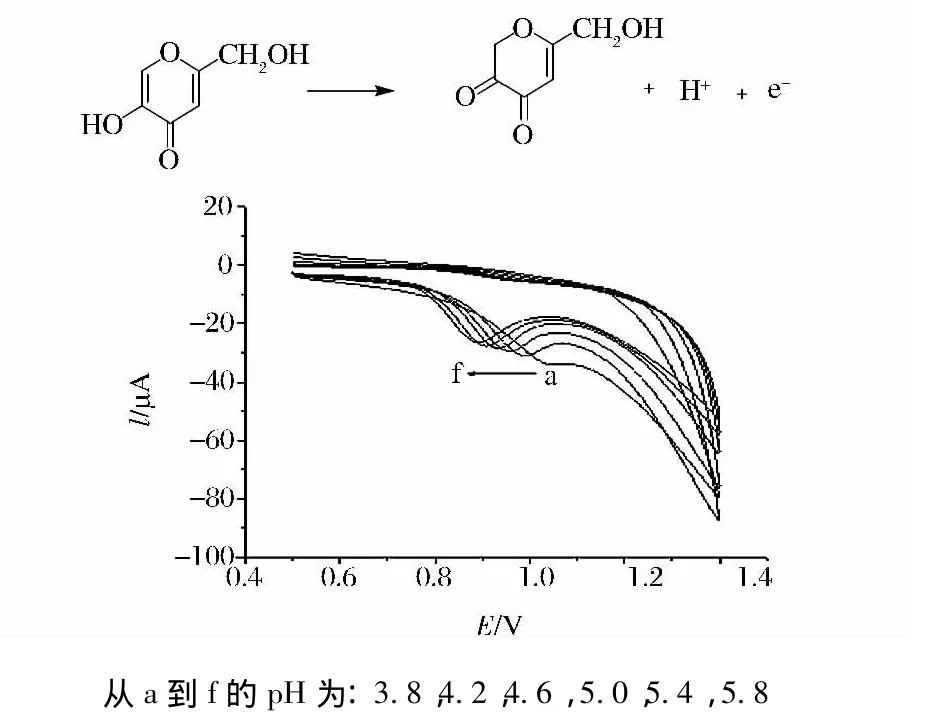
图4 2.00×10-4mol/L曲酸在聚缬氨酸修饰电极上的随pH变化的CV曲线Fig.4 Cyclic voltammograms of 2.00×10-4mol/L kojic acid at a poly(valine)modified electrode in HAc-NaAc of various pH
2.4.2 测定电位的影响
测定电位范围对曲酸在修饰电极上的氧化峰电流大小有一定影响。固定测定低电位为0.5 V及其他条件不变,只改变高电位进行实验,结果表明,当高电位为1.4 V时,曲酸在修饰电极上的响应电流最大;固定测定高电位为1.4 V及其他条件不变,当低电位为0.5 V时,曲酸在修饰电极上的响应电流最大,故本实验选择的测定电位范围为0.5~1.4 V。
2.4.3 扫描速度的影响
改变扫描速度进行实验,结果表明,氧化峰电流与扫描速度的大小呈线性关系(图5),其线性回归方程为:ipa=9.66×10-8v+6.34×10-6,相关系数为:r=0.999 1;说明曲酸在修饰电极上的电极过程为吸附过程。随扫描速度的增加,峰电流增加(图5)在扫描速度为120 mV/s时,峰形最好,故本实验选用扫描速度为120 mV/s。
2.5 工作曲线和重现性
由于曲酸易于与一些金属离子配位,而且EDTA和Na2SO3溶液的加入对曲酸的电化学响应影响很小,因此在测定底液中加入0.3 mol/L EDTA作为金属离子的掩蔽剂,加入质量分数为1%的Na2SO3作为抗氧化剂,以防止Fe3+的干扰,并且实验采用加入EDTA和Na2SO3后的体系做工作曲线。在最佳实验条件下,用循环伏安法对不同浓度的曲酸标准溶液进行测定(循环伏安曲线如图6)。实验结果表明,曲酸标准溶液在浓度范围7.00×10-6~6.50×10-4mol/L内与氧化峰电流有良好的线性关系,其线性回归方程为ipa=3.89×10-6+0.048c,相关系数为 r=0.998 3,检出限为8.50×10-7mol/L。
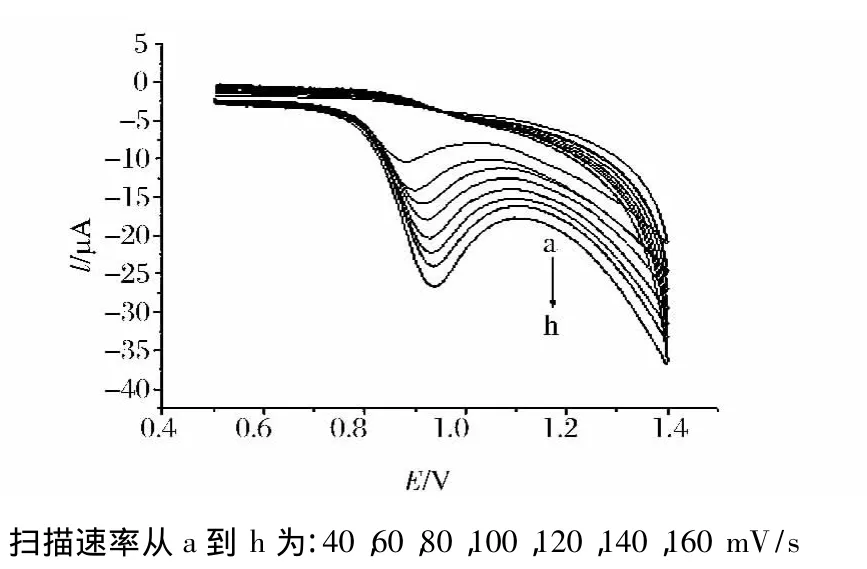
图5 不同扫速下2.00×10-4mol/L的曲酸在聚缬氨酸修饰电极上的循环伏安图Fig.5 Cyclic voltammograms of 2.00×10-4mol/L kojic acid at a poly(valine)modified electrode
用聚缬氨酸修饰电极对2.00×10-5mol/L曲酸标准溶液进行测定5次,测得结果的RSD为1.4%,表明该电极对曲酸的测定有较好的重现性。

图6 不同浓度的曲酸在聚缬氨酸修饰电极上的循环伏安曲线Fig.6 Cyclic voltammograms of kojic acid at various concentrations at a poly(valine)modified electrode in pH 5.4 HAc-NaAc.Scan rate:120 mV/s
2.6 干扰实验
在上述实验条件下,以1.20×10-5mol/L的曲酸作干扰离子实验。实验结果表明,在允许相对误差在±5%范围内,100倍于曲酸量的K+、Ca2+、Mg2+、、柠檬酸根、蔗糖,10倍的抗坏血酸不干扰测定。
2.7 样品及回收率的测定
称取黄豆酱10.20 g,粉碎至糊状,加水30.00 mL稀释,搅匀,用真空抽滤泵进行抽滤得抽滤液,所得残渣洗涤2次,收集滤液转移至100 mL容量瓶,加入5 mL 0.3 mol/L EDTA溶液,掩蔽金属离子,加入5 mL质量分数为1.00%Na2SO3溶液,防止Fe3+干扰,用二次蒸馏水定容。取一定量配制好的黄豆酱稀释液,加入一定量pH5.4ABS缓冲溶液于电解池中,对其进行测定,并进行回收率实验,所得结果为电解池中曲酸浓度,见表1。计算得该黄豆酱中所含曲酸的质量分数为0.11%。
取25.00黄酒样品分别于100.00 mL容量瓶中,分别加入2.00 mL 0.03 mol/L EDTA溶液,2.00 mL 1.00%Na2SO3溶液,再用pH 5.4ABS缓冲溶液稀释至刻度,取一定量在最佳实验条件下测定并进行回收率实验,所得结果为电解池中曲酸浓度。计算得该黄酒中所含曲酸的含量为37.63 mg/kg,结果见表1。

表1 样品中曲酸的测定结果Table 1 Determination results of kojic acid in samples(n=6)
3 实验结论
利用电化学方法制备了聚缬氨酸修饰电极,聚合条件影响修饰电极的催化效果。在pH=5.4醋酸盐缓冲溶液中,聚缬氨酸修饰电极对曲酸电化学氧化具有良好催化作用,利用该修饰电极可准确地测定曲酸的含量。其线性范围为7.00×10-6~6.50×10-4mol/L,相关系数为r=0.998 3,检出限为8.50×10-7mol/L,回收率为96.0% ~99.0%之间,可用于黄豆酱及黄酒中曲酸含量的测定。
[1] 陶文沂,孙微,徐正宏,等.曲酸在食品中的应用[J].中国食品添加剂,2000,2:26-31.
[2] 李学如,王艳,孟涛.食品中曲酸安全性评价研究进展[J]. 食品与发酵工业,2005,31(12):79-83.
[3] 黄娟,刘艳,丁涛,等.高效液相色谱一串联质谱法测定食品中曲酸[J]. 色谱,2012,30(6):578-583.
[4] Burdock G A,Soni M G,Carabin I G.Evaluation of health aspects of kojic acid in food [J].Regulatory Toxicology and Pharmacology,2001,33(1):80-101.
[5] Chusiri Y,Wongpoomchai R,Kakehashi A,et al.Nongenotoxic mode of action and possible threshold for hepatocarcinogenicity of Kojic acid in F344 rats [J].Food and Chemical Toxicology,2011,49(2):471-476.
[6] Fujimoto N,Watanabe H,Nakatani T,et al.Induction of thyroid tumours in(C57BL/6N x C3H/N)F1 mice by oral administration of kojic acid[J].Food and Chemical Toxicology,1998,36(8):697-703.
[7] Wei C I,Huang T S,Fernando S Y,et al.Chung Mutagenicity studies of kojic acid[J].Toxicology Letters,1991,59(1-3):213-220.
[8] Piantavini M S,Stremel D P,Trindade A C L B et al.Validation of a spectrophotometric method in the visible region for the quantification of kojic acid in raw materials and products[J].Latin American Journal of Pharmacy,2010,29(8):1 468-1 472.
[9] Januario Correr C,Cordeiro G,Gasparetto J,et al.Determinacdeãcido kójico em produtos farmacêuticos por espectroscopia UV-vis e processo de calibracão multivariada[J].Acta Farm.Bonaerense,2005,24(3):416-420.
[10] Lin Y H,Yang Y H,Wu S M.Experimental design and capillary electrophoresis for simultaneous analysis of arbutin,kojic acid and hydroquinone in cosmetics[J].Journal of Pharmaceutical and Biomedical Analysis,2007,44(1):279-282.
[11] Liu J,Zhou D,Liu X,et al.Determination of kojic acid based on the interface enhancement effects of carbon nanotube/alizarin red S modified electrode [J].Colloids and Surfaces B,2009,70(1):20-24.
[12] Wang Y,Zhang D,Wu J.Electrocatalytic oxidation of kojic acid at a reduced graphene sheet modified glassy carbon electrode[J].Journal of Electroanalytical Chemistry,2012,664(1):111-116.
[13] Yang Z,Yin Z,Chen F.A novel kojic acid amperometric sensor based on hollow CuO/Fe2O3hybrid microspheres immobilized in chitosan matrix [J].Electrochimica Acta 2011,56(3):1 089-1 093.
[14] 周君,狄俊伟.曲酸的电化学行为及其应用[J].南通职业大学学报,2005,19(4):8-9.
[15] 周君,狄俊伟,屠一锋.基于硅溶胶一凝胶化学修饰电极直接测定酱油中的曲酸[J].食品科技,2007(6):214-215.
[16] 贾莉,雷秋芬,张修华,等.邻氨基硫酚自组装膜修饰电极测定多巴胺[J].应用化学,2005,22(2):172-175.
[17] 孙登明,马伟,吴云.聚L-异白氨酸修饰电极的制备及对多巴胺的测定[J].应用化学,2006,23(11):1 214-1 217.
[18] 韩晓霞,高作宁.DA和AA在CPB现场修饰碳糊电极上的电化学行为及电分析方法[J].应用化学,2007,24(7):770-773.
[19] 陈高礼,马伟,孙登明.银掺杂聚L-天冬氨酸修饰电极的制备及对肾上腺素的测定[J].应用化学,2010,27(3):353-357.
[20] 马心英,林宪杰.聚缬氨酸修饰电极在抗坏血酸共存下选择性测定去甲肾上腺素[J].应用化学,2009,26(3):287-291.
