影响米粉干转基因成分荧光PCR检测的若干因素分析
2014-12-16江树勋邵碧英缪婷玉陈文炳
江树勋,张 冰,邵碧英,缪婷玉,彭 娟,陈文炳,*
(1.福建出入境检验检疫局检验检疫技术中心,福建省检验检疫技术研究重点实验室,福建福州 350001;2.福建农林大学,福建福州 350003;3.厦门塔斯曼生物工程公司,福建厦门 361023)
转基因技术的产生使动植物、微生物等生物体性状改良成为可能[1],包括生长性能、抗病、抗逆性、营养品质[2]等。在中国,稻米产量占粮食总产量的40%,是过半中国人的主粮[3],从1988年首个可育的转基因水稻植株培育成功[4],基因工程技术在我国水稻品种改良上得到了广泛的研究。目前已经培育成功的转基因水稻植株所携带的目的基因主要包括抗虫、抗病、抗逆、抗除草剂和改善营养品质等类型[5]。鉴于转基因产品安全性还未定性,世界各国仍将转基因食品安全列为重点问题[6]。许多国家相继制定了转基因生物的管理法规,要求对转基因产品进行标识[7]。挪威[8]是首个实行转基因产品含量标识的国家,标识低限为2%:欧盟的标识低限[9]为1%。我国[10]于2001年5月23日颁布了《农业转基因生物安全管理条例》,2002年3月20日开始贯彻实行《农业转基因生物标识管理办法》。
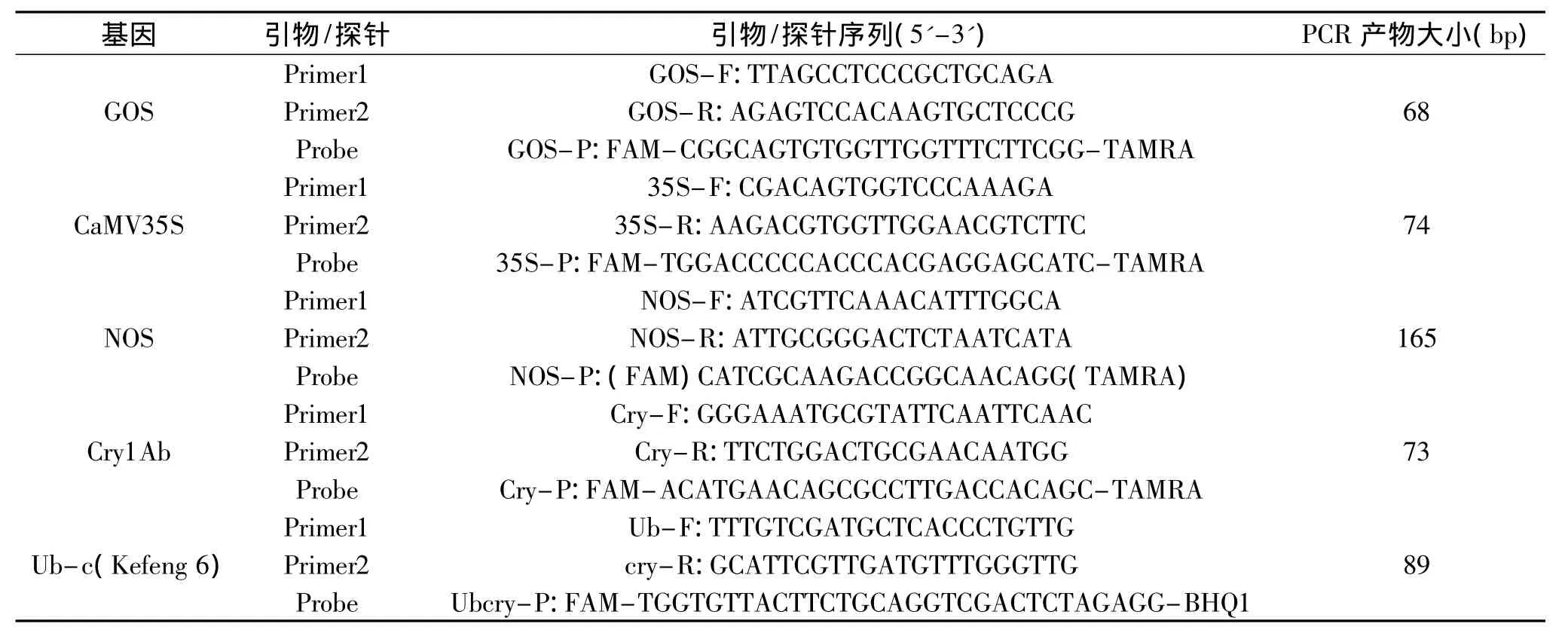
表1 荧光定量PCR引物/探针序列Table 1 The primer/probe sequence of fluorescence PCR

表2 引物、探针用量不同的3个PCR反应体系Table 2 Three PCR reaction systems of different dosage of primers and probe
目前转基因检测的对象已经从一般农产品扩展到深加工产品,如食用油脂、米制品、酱油、饲料等[11],我国出口的米制品一直是欧盟等国家或地区检测的重点[12],对我国出口米制品影响很大。欧盟在2008年4月15日起对中国大米及其制品要求实施检测并出具统一的卫生证书才能出口[13]。但在转基因成分检测中,通常情况下提取DNA时仅要求把原料研磨成粉,一般不对颗粒细度提具体要求,这种情况下的主要颗粒细度为50~100目,同时存在大量小于50目和小量大于100目的颗粒,对温育时间要求一般是1h(如大豆)或以上(如大米等),由于这些条件往往无法稳定满足对深加工产品转基因成分检测的准确性。为此,本文针对影响深加工米制品转基因成分检测的实时荧光PCR[14-16]结果准确性的各种因素进行研究,建立了规范的技术操作程序,为保障我国进出口米制品安全提供了科学检测依据。
1 材料与方法
1.1 材料与仪器
非转基因大米与米制品米粉干(线状)为企业送检留样,科丰6号转基因大米样品(含CaMV35S、Nos、Cry1Ab、Ub-c外源基因成分)由福建省农业科学院提供。CTAB十六烷基三甲基溴化铵;TE缓冲液、蛋白酶K与RNA分解酶等购自上海生工生物工程有限公司;Premix Ex Taq(2×)(Probe qPCR)试剂盒购自大连宝生物科技公司。大米内源基因(GOS)与外源基因[17](CaMV35S、NOS、Cry1Ab、Ub-c)扩增用的引物与探针由大连宝生物科技公司合成(表1)。
高速冷冻离心机 日立公司;台式离心机 德国Eppendorf公司;核酸蛋白分析仪 德国Amersham公司;PCR超净工作台 美国Labconco公司;ABI7500实时荧光PCR仪 美国Applied Biosystems公司。
1.2 实验方法
1.2.1 模拟转基因米粉干样品配制及DNA提取 按照四分法对每个非转基因米粉干样品分样,称取200g烘干研磨成细粉,分别制成<50目、50~100目、>100目3个细度范围的样品。相同方式制备科丰6号转基因大米样品,两者按照相同细度和相应的质量分数,分别配制转基因大米含量为1%、0.1%、0.01%、0.001%4个转基因含量梯度的模拟转基因米粉干样品,比如同等粒度的99.99g非转基因米粉干粉末与0.01g转基因大米粉末充分混匀,制成质量分数为0.01%(m/m)的模拟转基因米粉干。
采用 CTAB 法[18]提取 DNA。
1.2.2 荧光PCR反应体系与条件 设荧光PCR单管反应体积为20μL,引物与探针用量如表2。
实时荧光 PCR反应主程序为:95℃,10min;95℃,35s,60℃,60s,45 个循环。每个反应重复2 次。设置阴性对照、空白对照和阳性对照。阈值设定原则[19]根据仪器噪声情况进行调整。
1.2.3 荧光PCR检测 对不同含量和细度的108个样本分别提取2份DNA,每个DNA做2个荧光PCR反应,即每个样本做4个PCR重复,共检测5个基因:大米内源基因(GOS)与外源基因 CaMV35S、NOS、Cry1Ab、Ub-c(Kefeng 6),总共进行 2160 管PCR反应,每次(96孔板)实验都设置阳性对照、非转基因大米阴性对照与双蒸水(ddH2O)空白对照[20]。
1.3 数据统计分析
采用Microsoft Office Excel 2003进行数据分析,对不同处理条件下样品DNA质量浓度与内源和外源基因的实时荧光PCR检测结果(Ct值)的差异显著性进行方差分析,并估算边际均值图。
1.4 检出率实验
因检验检疫领域通常认为荧光PCR转基因成分的检测限[21]为0.01%(转基因含量0.01%样品,检出率达到95%以上),本实验拟在探究以上实验得到的最优样品前处理方法的基础上,探究了进一步提高荧光PCR转基因成分的检出率,即选用转基因含量为0.001%的米粉干样品,实验其检出阳性样品的百分率。
2 结果与分析
2.1 样品颗粒细度及温育时间对DNA提取效果影响
实验设置了<50目、50~10目、>100目3个研磨颗粒细度和1、4、8h 3种CTAB温育时间,表3为含量为0.01%的样品提取的DNA浓度情况。
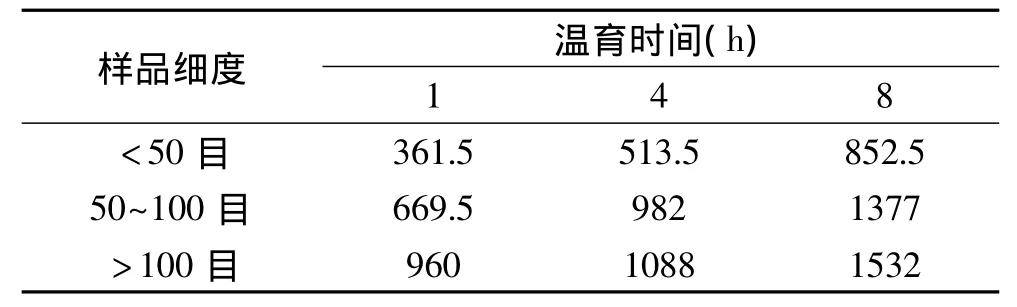
表3 米粉干样品提取的DNA浓度(ng/μL)Table 3 The DNA concentration of rice noodle samples(ng/μL)
表3是米粉干样品提取的9种处理组合下2个重复提取的DNA浓度平均数据,各个样品的DNA质量经核酸蛋白分析仪测试,结果可知,DNA的OD260/OD280值都在1.7~2.0范围内,符合 PCR 检测要求[22]。但是在相同的颗粒细度下,提取到的DNA浓度随着温育时间的增长而增高,温育时间达到8h条件下效果最好;在温育时间相同情况下,DNA浓度随样品颗粒细度的增加而增高,颗粒大小为>100目的样品提取到的DNA浓度最高。方差分析结果表明,样品颗粒细度与CTAB缓冲液温育时间对样品DNA提取浓度的影响均达到极显著水准(F行=73.00,F列=65.53,F0.01=18.00,p <0.01)。
2.2 荧光PCR反应体系优化结果分析
2.2.1 引物、探针用量对检测结果准确性的影响实验样品DNA为0.01%转基因大米含量的米粉干样品在研磨细度50~100目,CTAB缓冲液温育时间达到8h条件下提取的DNA,测定3种引物、探针用量体系下内源基因和外源基因实时荧光PCR的Ct值,每个基因做4个重复。结果如表4。
表4结果显示,PCR反应体系2测得的Ct值均比体系1和体系3的Ct值小,效果最好。
2.2.2 DNA模板浓度对检测结果准确性的影响 采用2.2.1中的DNA原液及2倍和6倍稀释液进行体系2实验,测定了3个DNA浓度梯度样品的内源基因 GOS和外源基因 CaMV35S、NOS、Cry1Ab荧光PCR的Ct值。结果如表5。
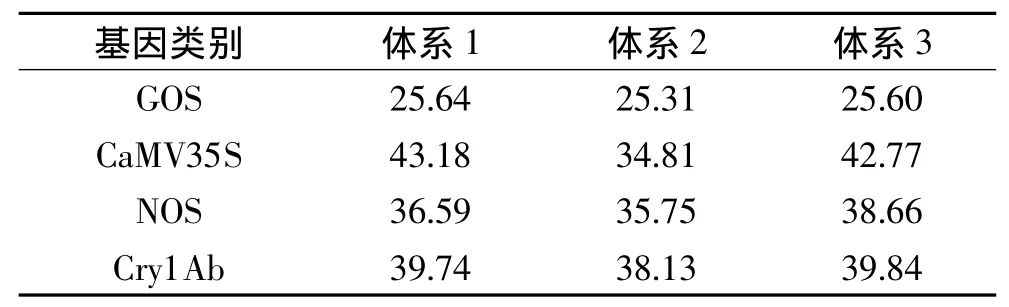
表4 不同引物、探针用量下4个基因荧光PCR检测结果(Ct值)Table 4 Fluorescence PCR detection results(Ct value)of 4 genes under different dosage of the primers and probe
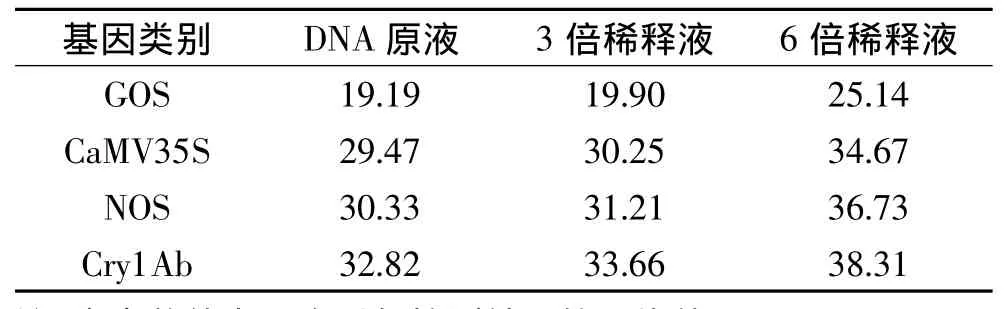
表5 不同DNA浓度下4种基因荧光PCR检测结果(Ct值)Table 5 Fluorescence PCR detection results(Ct value)of four genes under different concentration of DNA
从表5可以看出,DNA用量对检测结果的Ct值影响明显。DNA用原液时PCR检测结果的Ct值最小,效果最理想。即DNA浓度较高时,Ct值相对较小,有利于提高荧光PCR检测结果准确性。
2.3 不同含量梯度样品对检出结果的影响
对不同转基因含量的米粉干样品进行荧光PCR检测,结果Ct值整理后利用SPSS数据分析软件进行方差分析F检验,分析目数和温育时间两种因素间及两种因素的交互作用对实验结果影响的显著性。同时利用Microsoft Office Excel 2003软件对Ct值进行边际均值估算,分析最优处理组合。
由表6对4种转基因含量大米样品F检验结果表明,目数因素对0.001%含量的 CaMV35S、1%和0.1%含量的GOS影响不显著,0.001%含量的NOS影响较显著,其它均有极显著影响;时间因素对1%含量的CaMV35S、0.01%含量的NOS和0.001%含量的Cry1Ab的影响较显著,其它均有极显著影响;两因素间交互作用对1%、0.1%含量的GOS无显著影响,仅对0.01%、0.001%含量情况下的GOS有极显著影响,对1%和0.1%的CaMV35S、NOS、Cry1Ab以及0.1%的Ub-c有极显著影响。
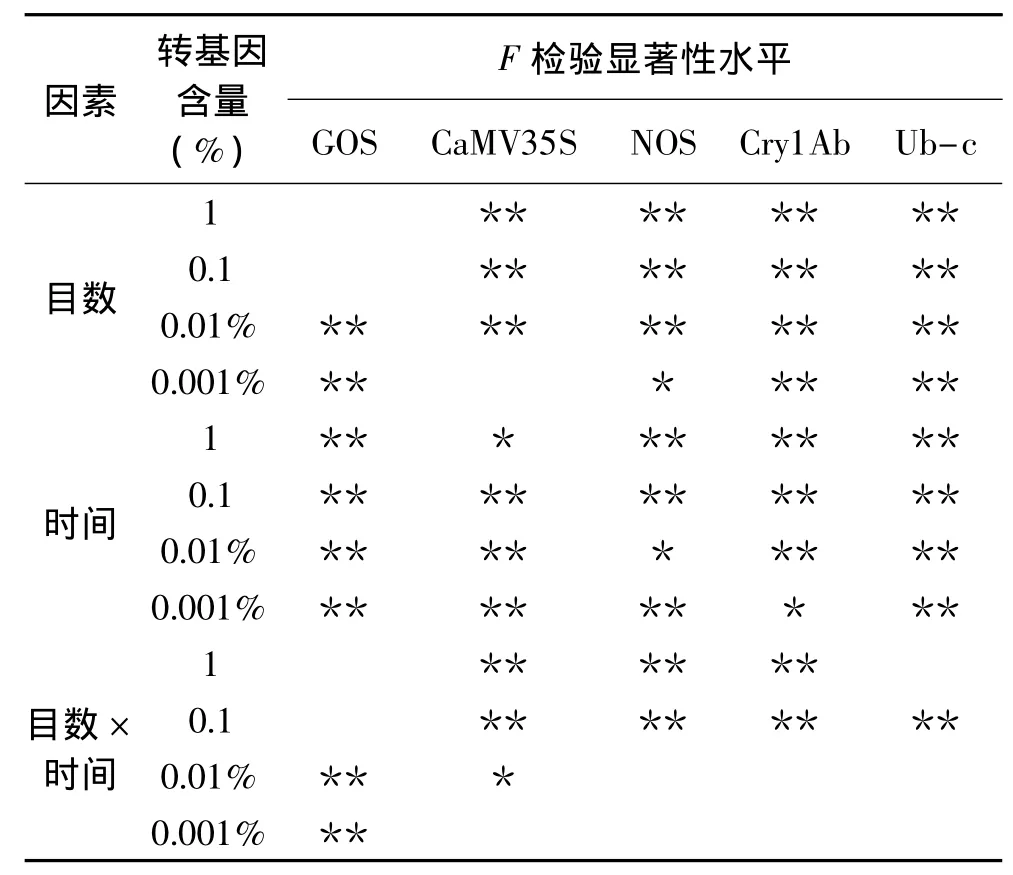
表6 米粉干样品F检验Table 6 F test of dry rice noodle samples
以0.01%转基因含量米粉干样品为例,其4个外源基因检测结果的估算边际均值图如图1~图4所示:
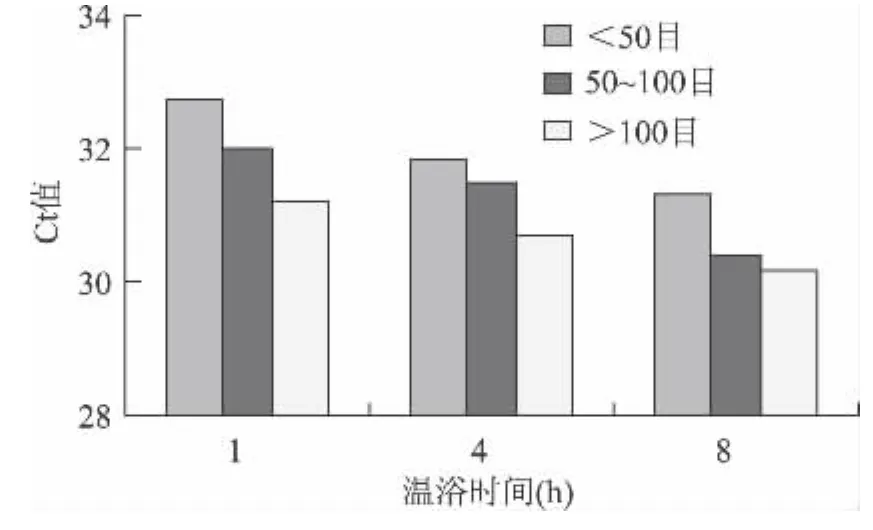
图1 0.01%转基因含量米粉干CaMV35S估算边际均值Fig.1 Estimating marginal average figure of CaMV35S of 0.01%GM rice noodles
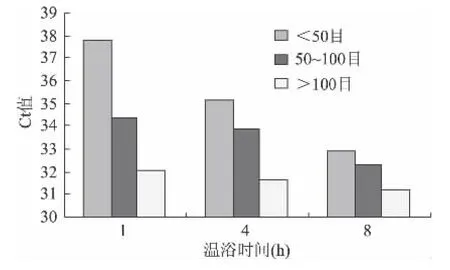
图2 0.01%转基因含量米粉干NOS估算边际均值Fig.2 Estimating marginal average figure of NOS of 0.01%GM rice noodles
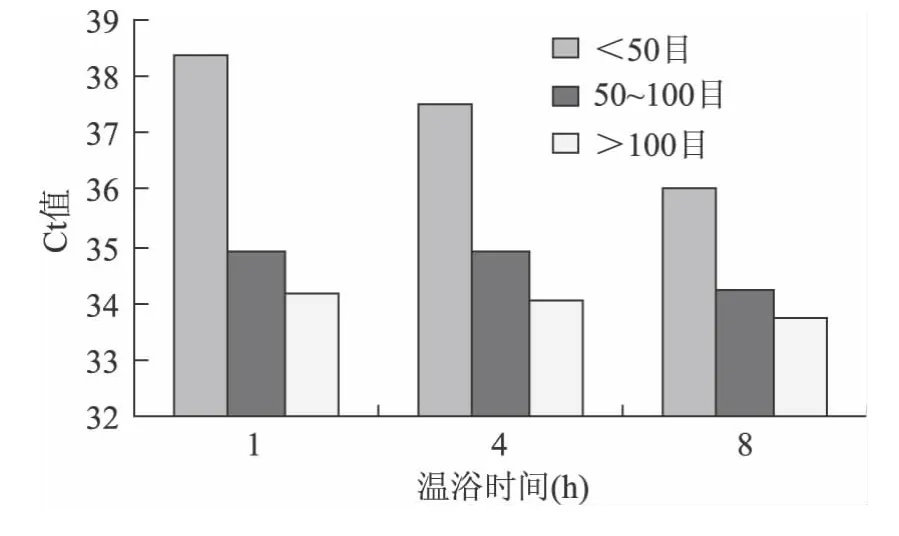
图3 0.01%转基因含量米粉干Cry1Ab估算边际均值Fig.3 Estimating marginal average figure of Cry1Ab of 0.01%GM rice noodles
可见,对于4个外源基因Ct值最小时对应的样品前处理条件都是样品颗粒细度>100目和温育时间8h,其他不同转基因含量米粉干样品Ct值的估算边际均值图与此结论基本一致(图略),由此可确定米粉干样品前处理的最佳组合是样品颗粒细度>100目和温育时间8h。
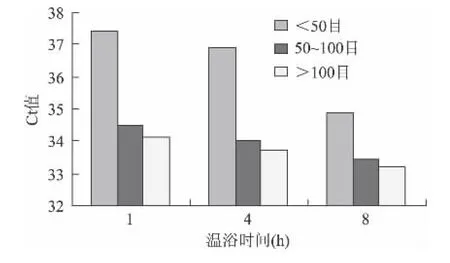
图4 0.01%转基因含量米粉干Ub-c估算边际均值Fig.4 Estimating marginal average figure of Ub-c of 0.01%GM rice noodles
2.4 检出率实验
以转基因含量为0.001%的米粉干样品进行检出率实验,测定外源基因CaMV35S、NOS、Cry1Ab的Ct值,结果如表7所示:

表7 转基因含量0.001%的米粉干样品检出结果Table 7 Detection results of rice noodle samples with 0.001%content of genetically modified rice
表7表明,恰当的前处理措施可以使得检出限(以检出率大于95%为指标)降低到转基因含量0.001%,且PCR检测的Ct值平均数(n=48)都在阳性结果判断值(36)以下(表8)。

表8 经最优前处理后的米粉干模拟样品转基因成分Ct平均值Table 8 Average Ct values of transgenic components in simulated rice noodle samples after the optimum pre-treatment
3 结论
本文以模拟转基因深加工米粉干为研究材料,探讨了荧光PCR反应体系、样品颗粒大小和DNA提取中样品在CTAB缓冲液中的温育时间对样品DNA提取效果和荧光PCR检测转基因成分结果准确性的影响。
方差分析F检验结果表明,样品颗粒细度与CTAB缓冲液浸泡温育时间对DNA浓度产生的影响均达到极显著水准,颗粒细度>100目、CTAB缓冲液温育时间达到8h的样品提取的DNA浓度最高;不同处理条件下的大米内源基因GOS与4个外源基因的Ct值存在显著或极显著影响,不管哪个基因,从估算边际均值图可以看出样品细度与CTAB温育时间的最佳组合是样品颗粒细度>100目与CTAB缓冲液温育时间8h。在此基础上进行的检出率实验说明,前处理对检出率有显著影响,恰当的前处理措施可以使得检出限(以检出率大于95%为指标)降低到转基因含量0.001%,是荧光PCR通常认为的检出限0.01%的10倍,且PCR检测的Ct值平均数(n=48)都在阳性结果判断值(36)以下[参考转基因检测标准SN/T 2584-2010]。说明恰当的样品前处理措施加上优化的荧光PCR反应体系条件可使不同转基因含量样品检出效果更为理想,并能在一定程度上降低检测限,这将对检测相关产品的深加工转基因食品的检测具有重要参考意义,实践证明应用该条件在对本实验室检测米粉干等深加工产品的转基因成分中起到较好的效果。
[1]蒋家焕,郭奕明,杨映根,等.转基因水稻的研究和应用[J].植物学报,2003,20(6):736-744.
[2]姚方印,朱常香,李广贤,等.Bt水稻的抗虫性鉴定及转基因的遗传分析[J].中国农业科学,2002 ,35(2):142-145.
[3]姬华,乐国伟,王洪新,等.转基因食品的营养学评价研究进展[J].食品研究与开发,2009,36(7):73-74.
[4]Hernandez M,Esteve T,PlaM.Real-time polymerase Chain reaction based assays for quantitative detection of badey,rice,snnflower,and wheat[J].Journal of Agricultural and Food Chemistry,2005,53(18):7003-7009.
[5]Lemt S,England LS,Vincet M,et al.Real-time polymerase chain reaction qualification of the transgenes for roundup ready corn and ready soybean in soil samples[J].Journal of Agricultural and Food Chemistry,2005,53(5):1337-1342.
[6]王国英.转基因植物的安全性评价[J].农业生物技术学报,2001(9):205-207.
[7]Nickson TE.Editor's choice aeries onthe next generation of biotech crops:planning environmentalrisk assessmentfor genetically modified crops:problem formulation forstress,toleranterops[J].Plant Physiology,2008,147:494-502.
[8]Kaeppler HF.Food safety assessment of genetically modified crops[J].AgronomyJournal,2000,92:793-797.
[9]Joanne E,Barton MD.Genetically modified crops and the environment[J].AgronomyJournal,2000,92:797-803.
[10]吴志毅,张明哲,陈曦.大米和米制品Bt63转基因检测PCR方法的灵敏度研究[J].浙江农业学报,2009,21(6):549-554.
[11]邓鸿铃,郭新东,吴玉銮.利用 PCR方法检测转BT基因水[J].现代食品科技,2008,23(4):71-74.
[12]谭慧,王洋,潘峰,等.植物源性转基因食品PCR检测技术研究[J].中国卫生检验检疫杂志,2004,14(4):407-409.
[13]李文涛,王俊东,杨利峰,等.实时荧光定量PCR技术及其应用[J].生物技术通讯,2006,17(1):112-114.
[14]陈文炳,王志明,李寿崧,等.分子标记在动植物检验检疫与GMO产品检测中的应用[J].福建农林大学学报,2004,33(4):494-500.
[15]陈颖,徐宝梁,苏宁,等.实时荧光定量PCR技术在转基因玉米检测中的应用研究[J].作物学报,2004,30(6):602-607.
[16]吴孝横,路勇.利用实时荧光PCR方法检测转Bt基因大米[J].现代食品科技,2009,25(2):211-216.
[17]农业部953号公告-6-2007,转基因植物及其产品成分检测抗虫转Bt基因水稻定性PCR方法[S].
[18]Made D,Degner C,Grohmann L.Detection of genetically modified rice:a construct-speciffic real-time PCR method based on DNA sequence from transgenic Bt rice[J].Eur Food Res Techol.,2006,224:217-278.
[19]蒋春燕,王泰健,王琴,等.实时荧光定量PCR技术[J].动物医学进展,2005,26(12):97-101.
[20]Sambrook J,Fritsch EF,Mainiatis T.分子克隆实验指南[M].金东雁,黎孟枫译 .北京:科学出版社,1989,690-692.
[21]冯仁蜂.分析灵敏度(检测限)[J].上海医学检验杂志,2002,17(3),133-136.
[22]李金明.实时荧光PCR技术[M].北京:人民军医出版社,2007,120-123.
