球形Bi2 WO6光催化剂的合成与性能
2014-12-15胡朝浩周怀营
陈 冉,胡朝浩,赵 雯,韦 帅,崔 健,钟 燕,周怀营
(桂林电子科技大学 材料科学与工程学院,桂林 541004)
目前,环境污染与防治是全球性的重要课题,去除水中有害的化学物质更成为环境保护行业的一项重要任务[1]。当前,以TiO2为代表的光催化材料尽管表现出优良的光催化性能,但可见光响应范围较窄,多以紫外光辐射为主,并且生产成本高,能耗大,使其实际应用受到大幅度的限制[2-4]。因此,开发能有效利用可见光的新型光催化材料已成为当今的研究热点[5-15]。
Bi2WO6是典型的n型直接半导体材料,带隙宽度约为2.70 eV。它的能带结构与BiVO4的相似,其中价带顶主要由Bi 6s和O 2p轨道杂化组成,而导带底则主要由W 5d轨道与少量Bi 6s轨道构成。由于Bi 6s轨道和O 2p轨道杂化,使催化剂的价带电位升高,带隙宽度减小,因此Bi2WO6对可见光区有吸收[8,16-20]。另外,Bi2WO6三明治结构的层间空间能够为光催化反应提供活化点,夹层能接受光生电子,从而有效地抑制光生电子与空穴的复合,使光催化效率得到大幅度的提高。因此,Bi2WO6是一种很有发展前景的可见光催化材料[8,21]。1999年,KUDO等[22]首次报道了Bi2WO6在可见光照射下能从硝酸银水溶液中成功光解水产生O2。随后,TANG等[8]采用固相反应法合成Bi2WO6,通过UV-Vis漫反射光谱测得带隙为2.69 eV,并在可见光下能有效地降解CHCl3和CH3CHO等有害物质。HE等[23]用温和水热合成法制备了Bi2WO6光催化剂,其晶粒大小为50~150 nm,60 min后罗丹明B(10 mg/L)降解率达到94%,在分解过程中加入 H2O2或者通入空气,可进一步提高降解率。
目前,Bi2WO6通常采用高温固相反应制备,制备的样品粉末通常粒径较大、比表面积较小、结晶较差并有大量的晶体缺陷,严重影响该光催化剂的光催化活性。针对这些问题,本文作者采用水热法合成了比表面积较大的纳米片自组装而成的Bi2WO6球形颗粒,通过不同合成条件(主要是水热温度与反应时间)的类比实验寻找最佳的合成工艺,并通过在紫外及可见光(λ>420 nm)照射下,光催化降解罗丹明B溶液来研究球形Bi2WO6光催化剂的光催化性能。
1 实验
1.1 催化剂的制备
称取0.005 mol Na2WO4·2H2O(国药集团化学试剂有限公司,分析纯)加入30 mL的去离子水中,待溶解为无色透明溶液后,取0.01 mol Bi(NO3)3·5H2O(国药集团化学试剂有限公司,分析纯)加入 1.25 mL 16 mol/L的浓硝酸(廉江市爱廉化学试剂有限公司,分析纯)中,并逐渐加入28.75 mL去离子水,将其溶解为无色透明溶液。Bi(NO3)3·5H2O溶液磁力搅拌5 min后,将Na2WO4·2H2O逐滴加入Bi(NO3)3·5H2O中,将上述混合溶液磁力搅拌30 min使反应完全,把所得的前驱体溶液转移至聚四氟乙烯内衬的不锈钢反应釜中,使反应釜的填充度为60%,然后将反应釜放入恒温干燥箱中反应。反应完成后,自然冷却至室温,将得到的淡黄色沉淀物过滤,分别用去离子水和无水乙醇清洗数次,再放入恒温干燥箱中60℃干燥12 h后,得到Bi2WO6光催化剂样品,并置于玻璃干燥器中备用。
在制备 Bi2WO6纳米粉体的实验中,通过改变合成条件设计了两组类比实验,以确定样品的最佳制备工艺:1) 在保持其他合成条件不变的情况下,改变水热温度,分别为140、160和180℃,制备不同的样品,并通过 XRD、SEM 分析表征,选择最佳合成温度;2) 在保持其他合成条件不变的情况下,改变反应时间,分别为4、7和12 h,并通过XRD、SEM分析表征,选择出最佳反应时间。
1.2 催化剂的表征
催化剂的晶相结构采用德国 Bruker公司生产的D8-2-Advance型X射线衍射仪(XRD)分析。采用Cu靶 Kα线(λKα=0.154 1 nm),扫描范围为10º~80º,扫描速度为5 (º)/min,管电压为40 kV,管电流为100 mA。采用日本电子珠式会社生产的JSM-5610LV型扫描电子显微镜(SEM)观察催化剂的形貌特征。样品的紫外-可见吸收光谱以及紫外-可见漫反射光谱在岛津UV-2550型紫外-可见分光光度计上测定,波长扫描范围是200~700 nm,使用BaSO4粉末为参比。
1.3 光催化降解实验
本研究选用罗丹明 B(国药集团化学试剂有限公司,分析纯)溶液为目标降解物。具体实验过程如下:取100 mL 5 mg/L的罗丹明B置于250 mL石英烧杯中,加入0.20 g Bi2WO6光催化剂。在光照前将石英烧杯置于磁力搅拌器中,在无光条件下搅拌30 min,保证光催化剂和染料分子混合均匀并达到吸附-脱附平衡。将达到吸附-脱附平衡的混合溶液置于300 W的氙灯(灯源与反应容器间放置λ>420 nm 的滤波片以保证到达溶液的为可见光)或者紫外灯的正下方进行光催化降解反应。灯的底部至液面距离为10 cm,在实验过程中不断磁力搅拌,每隔20 min取7 mL上清液置于离心管中,离心分离除去催化剂粉末,取上层清液在紫外-可见分光光度计上测定其吸光度(λmax=553.5 nm)。由于罗丹明B溶液在低浓度范围内的吸光度A与浓度c之间有很好的线性关系,符合朗伯-比耳定律,所以可以根据吸光度计算出罗丹明 B溶液的浓度。因此,罗丹明B随时间变化的降解率可以按下式进行计算:
式中:W、c0和c分别为染料降解率、染料溶液初始浓度和光催化反应一段时间后的溶液浓度。
2 结果与讨论
2.1 Bi2WO6的物相分析
2.1.1 水热温度对Bi2WO6晶相结构的影响
图1所示为采用水热法在140、160和180℃下所制备样品的XRD谱。从图1可知,在反应温度为140℃时,能观察到Bi2WO6的特征峰,但是特征峰数目仍较少,并且在58.76°、68.98°、76.16°和78.40°处特征峰不明显。这是因为在较低水热温度下Bi2WO6还处在成核阶段,晶体生长不充分,结晶不理想。当水热温度升至 160℃时,Bi2WO6的所有特征峰均出现,并完全对应于正交相的Bi2WO6(JCPDS 79-2381)。随着反应温度的升高,样品的衍射峰强度逐渐增大,并且峰型变得尖锐,表明样品的结晶度得到提高。当水热温度为180℃时,衍射峰强度最高,半峰宽明显变窄,因此可认为180℃是最合适的水热温度。
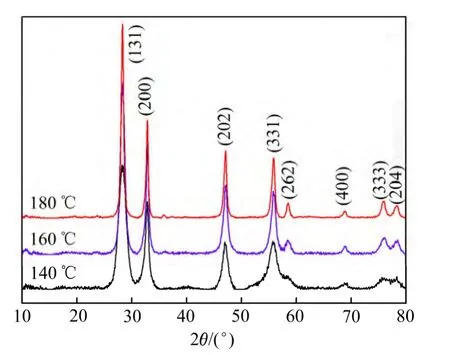
图1 不同反应温度下反应5 h后产物的XRD谱Fig.1 XRD patterns of synthesized products at different temperatures for 5 h
2.1.2 反应时间对Bi2WO6晶相结构的影响
图2所示为采用水热法在4、7和12 h下所制备样品的XRD谱。由图2可知,不同反应温度制备的样品在28.40°、33.06°、47.28°、56.00°、58.76°、68.98°、76.16°和78.40°时均出现了Bi2WO6特征峰。各衍射峰与JCPDS标准卡片(No.79-2381)完全吻合,没有出现任何杂质相,所制得的样品均属于钨铋矿结构的Bi2WO6。这说明水热法合成的Bi2WO6光催化剂的结晶度良好,基本上没有相的转变。在180℃保温4 h,即可合成纯的Bi2WO6,但是衍射峰强度较弱,其中68.98°处的特征峰不明显。随着反应时间的增加,样品的峰型逐渐变得尖锐,峰强略有增强,当t=7 h时,样品的衍射峰的强度最高。继续延长反应时间会导致样品衍射峰下降,结晶度降低,出现这种现象可能是由于反应时间过长,会使晶体重新溶解,导致峰强变弱,结晶度降低,这与HUANG等[24]合成ZnWO4光催化剂时报道的现象一致。

图2 在180℃下保温不同时间后产物的XRD谱Fig.2 XRD patterns of synthesized products holding for different times at 180℃
2.2 不同合成条件所得Bi2WO6样品的形貌分析
2.2.1 反应温度对Bi2WO6样品形貌的影响
反应温度对样品微观形貌的影响如图3所示。反应温度为140℃时,只有少量不规则的微球颗粒形成,同时还存在许多不规则形状的颗粒聚集态,如图3(a)所示。从图3(b)则可看出,当合成温度增至160℃时,不规则形状的颗粒聚集态逐渐消失,开始形成界面清晰的微球颗粒,并且微球颗粒上开始出现纳米片。当合成温度继续升至180℃时,微球颗粒逐渐变得规则均一,完整性提高,并且微球颗粒上出现了大量的纳米片(如图3(c)所示)。综合不同温度的XRD 谱和SEM分析结果,认为180℃为最佳水热合成温度。
2.2.2 反应时间对Bi2WO6样品形貌的影响
图4所示为不同的反应时间下合成的Bi2WO6的SEM像。由图4可知,时间对Bi2WO6光催化剂的形貌有显著影响。反应4 h后,出现不规则的发育不完全的扁平状颗粒。7 h后,Bi2WO6粒子的晶粒尺寸明显增大,并且晶体形状由扁平状颗粒变为由规则纳米片状组装而成的微球。这表明 Bi2WO6晶体在一定的时间范围内随着时间延长继续生长,同时晶粒形貌发育逐步趋于完全。然而,过长的水热时间会破坏这种结构,由图4(d)可知,当反应时间继续增加至12 h时,部分Bi2WO6微球颗粒发生坍塌现象,由XRD分析(见图2)可知此时样品的衍射峰开始下降,结晶度降低。综合不同反应时间的XRD谱分析和SEM分析可知,水热反应7 h的样品微球结构的结晶度较高,颗粒的均匀性和完整性也最好。由图4(c)可以看出,微球状Bi2WO6颗粒是由纳米片高度有序自组装而成,单个微球颗粒的直径为3~4 μm。综合XRD分析和微观形貌分析结果,认为反应温度180℃,反应时间7 h为最佳的合成条件。因此,用此条件下制备的样品进一步进行光催化性能的研究。

图3 不同反应温度下反应 5 h后产物的SEM像Fig.3 SEM images of synthesized products at different temperatures for 5 h: (a) 140℃;(b) 160℃; (c) 180℃

图4 在180℃下保温不同时间后产物的SEM像Fig.4 SEM images of synthesized products holding for different times at 180℃: (a) 4 h; (b), (c) 7 h; (d) 12 h
2.3 光催化活性评估
2.3.1 Bi2WO6光催化剂在可见光下对罗丹明 B的降解率
图5所示为Bi2WO6光催化剂在可见光下(λ>420 nm)照射下罗丹明B(5 mg/L,100 mL)溶液的吸收峰值的变化。由图5可知,随着光照时间增加,罗丹明B溶液的最大吸收峰由于其发色基团苯氨基、羰基键的破坏而迅速降低,并不断向左偏移,发生蓝移现象且发生宽化。在可见光照射下,罗丹明B的降解分为两个步骤进行:首先是对N,N,N,N,-四乙基罗丹明分子进行去乙基化的过程,随着脱乙基化过程的进行,染料的最大吸收峰不断降低。当罗丹明B的乙基完全脱去后,罗丹明B就转化为罗丹明。继续进行降解,使得罗丹明的共轭结构进一步被破坏,最终被完全矿化[25-26]。图6所示为Bi2WO6光催化剂在可见光(λ>420 nm)照射下对罗丹明B的降解图。由图6可知,在可见光照射下,样品表现出较好的光催化性能。光照120 min后,Bi2WO6光催化剂对罗丹明B的降解率达到88.3%。而不加催化剂,仅在可见光照射下,罗丹明B几乎没有发生降解。从图7可知,Bi2WO6在紫外和可见光区域均显示不同程度的光吸收,利用紫外-可见漫反射测量得到的吸光度(A)与波长(λ)数据作图,利用截线法得出吸收波长阈值λg约为449 nm,根据带隙与波长的关系式计算出禁带宽度Eg为2.76 eV,这与ZHANG等[27]的报道结果一致。

图5 可见光照射下RhB溶液的吸收峰值的变化Fig.5 Temporal evolution of absorption spectrum of RhB solution (5 mg/L, 0.2 g Bi2WO6) under visible-light irradiation
2.3.2 Bi2WO6光催化剂投加量对光催化实验的影响
图8所示为可见光照射下不同Bi2WO6光催化剂投加量对罗丹明B(初始浓度为5 mg/L,pH为7,100 mL)降解效果的影响。由图8可知,Bi2WO6光催化剂投加量从0.10 g增加至0.20 g时,罗丹明B的降解率从48.1%增大至88.3%;在投加量为0.20 g时,罗丹明B的降解率达到最大;继续增大投加量,罗丹明B的降解率反而呈下降趋势。这是由于当催化剂投加量较小时,能起作用的催化剂活性中心数量少,形成的电子-空穴对少,催化效果较差。随着光催化剂投加量的增大,反应活性中心数量增多,催化剂对光的利用率增大,染料的降解率也随之增大。但是当催化剂投加量达到一定值时,光量子的利用率达到最大值,此时继续加大投加量会产生光散射,降低溶液的透光性,降解效果反而会降低。

图8 Bi2WO6光催化剂投加量对罗丹明B降解率的影响Fig.8 Effect of different amounts of Bi2WO6 photocatalyst on degradation rate of RhB
2.3.3 罗丹明B初始浓度对光催化实验的影响
图9所示为可见光照射下不同初始浓度罗丹明B溶液对体系降解率的影响。实验中配制100 mL浓度分别为2.5、5、7.5和10 mg/L的罗丹明B溶液进行光降解实验,Bi2WO6光催化剂的投加量为0.2 g,可见光(λ>420 nm)照射时间为60 min。由图9 可知,随着罗丹明B初始浓度的增加,罗丹明B的降解率逐渐降低。造成这种现象的原因可能是,随着罗丹明B初始浓度的增加,吸附在光催化剂表面的染料分子也不断的增加,催化剂表面的活性中心会相应的减少,同时初始浓度增加会使溶液的色度增加,透光率降低,能够参加光催化降解反应的光量子数变少,从而影响了催化剂对染料的降解效率。

图9 罗丹明B初始浓度对降解率的影响Fig.9 Effect of initial concentration of RhB on degradation rate
2.3.4 不同光源对Bi2WO6光催化降解罗丹明B的影响
取100 mL 5 mg/L罗丹明B溶液,加入0.20 g Bi2WO6光催化剂,分别在紫外光、可见光(λ>420 nm)、室内光、无光条件下搅拌2 h进行光催化降解实验,实验结果如图10所示。由图10可知,罗丹明B在紫外光和可见光条件下的降解率远高于室内光和无光,其中在紫外光和可见光(λ>420 nm)条件下2 h降解率均可以达到85.0%以上,在紫外光下最高可达99.8%,而在无光条件下吸附去除率仅为10.4%,在室内光照射下降解率为43.0%。这说明光强对光催化降解效率影响较大,光强越强,光催化降解效果就越好。

图10 不同光源对Bi2WO6光催化降解罗丹明B的影响Fig.10 Effect of different irradiation light sources on degradation RhB by Bi2WO6 samples (Lines a, b, c and d are for irradiations under UV, visible light (λ>420 nm), room light,and without any light, respectively.)
3 结论
1) 反应温度对产物的晶相结构和形貌有显著的影响。当反应温度为140℃时,出现的Bi2WO6特征峰较少,晶体生长不充分,结晶不理想,只有少量不规则的Bi2WO6微球颗粒形成;随着反应温度升高,晶体逐渐生长,Bi2WO6微球颗粒逐渐变得规则均一,颗粒完整性提高。
2) 反应时间与产物的晶相结构和形貌有很大的关系。在180℃保温4 h,即可合成纯的Bi2WO6,但是衍射峰强度较弱,此时合成样品为发育未完全的扁平状颗粒。随着反应时间的增加,样品的峰型逐渐变得尖锐,逐渐出现由纳米片自组装而成的球形颗粒。水热反应7 h的样品微球结构的结晶度较高,均匀性和完整性也最好。综合 XRD和SEM 分析,可认为180℃水热7 h为最佳合成条件。
3) 通过在紫外及可见光下降解 RhB溶液来考察样品的光催化活性,并对罗丹明B的降解过程进行讨论。结果表明,催化剂的最佳投加量为2 g/L。染料的降解率随着罗丹明B的初始浓度的增加而降低。不同光源对染料降解率的影响较大,罗丹明B在紫外光和可见光条件下的降解率远高于室内光和无光条件下的降解率,在紫外光下照射120 min后,催化剂对染料的降解率达到99.8%,这说明光强对光催化降解效率影响较大,光强越强,光催化降解效果就越好。
[1]PAOLA A D, GARCIA-LOPEZ E, MARCI G, PALMISANO L.A survey of photocatalytic materials for environmental remediation[J].Journal of Hazardous Materials, 2012, 211/212:3-29.
[2]ASAHI R, MORIKAWA T, OHWAKI T, AOKI K.Visible-light photocatalysis in nitrogen-doped titanium oxides[J].Science,2001, 293: 269-271.
[3]TADA H, KIYONAGA T, NAYA S.Rational design and applications of highly efficient reaction systems photocatalyzed by noble metal nanoparticle-loaded titanium(Ⅳ) dioxide[J].Chemical Society Reviews, 2009, 38: 1849-1858.
[4]ZHANG H, CHEN G, BAHNEMANN D W.Photoelectrocatalytic materials for environmental applications[J].Journal of Materials Chemistry, 2009, 19: 5089-5121.
[5]TANG J W, ZOU Z G, YE J H.Efficient photocatalysis on BaBiO3driven by visible light[J].The Journal of Physical Chemistry C, 2007, 111: 12779-12785.
[6]SHIMODAIRA Y, KATO H, KOBAYASHI H, KUDO A.Photocatalytic properties and photocatalytic activities of bismuth molybdates under visible light irradiation[J].The Journal of Physical Chemistry C, 2006, 110: 17790-17797.
[7]YU K, YANG S G, HE H, SUN C.Visible light-driven photocatalytic degradation of rhodamine B over NaBiO3:Pathways and Mechanism[J].The Journal of Physical Chemistry C, 2009, 113: 10024-10032.
[8]TANG J W, ZOU Z G, YE J H.Photocatalytic decomposition of organic contaminants by Bi2WO6under visible light irradiation[J].Catalysis Letters, 2004, 92: 53-56.
[9]ZHU J, WANG J G, BIAN Z F, CAO F G, LI H X.Solvothermal synthesis of highly active Bi2WO6visible photocatalyst[J].Research on Chemical Intermediates, 2009, 35: 799-806.
[10]KOHTANI S, HIRO J, YAMAMOTO N, KUDO A.Adsorptive and photocatalytic properties of Ag-loaded BiVO4on the degradation of 4-n-alkylphenols under visible light irradiation[J].Catalysis Communications, 2005, 6: 185-189.
[11]王 敏, 栾海燕, 余 萍, 车寅生, 牛 超, 董 多.S 掺杂对FeVO4光催化材料结构及性能的影响[J].中国有色金属学报,2013, 23(8): 2243-2250.WANG Min, LUAN Hai-yan, YU Ping, CHE Yin-sheng, NIU Chao, DONG Duo.Effect of S doping on structure and properties of FeVO4photocatalyst[J].The Chinese Journal of Nonferrous Metals, 2013, 23(8): 2243-2250.
[12]刘国聪, 金 真, 张喜斌, 李险峰, 刘 鸿.La掺杂BiVO4微米球的水热合成和光催化性能[J].中国有色金属学报, 2013,23(3): 793-801.LIU Guo-cong, JING Zhen, ZHANG Xi-bing, LI Xian-feng, LIU Hong.Hydrothermal synthesis and photocatalytic properties of La-doped BiVO4 microspheres[J].The Chinese Journal of Nonferrous Metals, 2013, 23(3): 793-801.
[13]KIKUGAWA N, YANG L Q, MATSUMOTO T, YE J H.Photoinduced degradation of organic dye over LiBiO3under illumination of white fluorescent light[J].Journal of Materials Research, 2010, 25: 177-181.
[14]KAKO T, ZOU Z G, KATAGIRI M, YE J H.Decomposition of organic compounds over NaBiO3under visible light irradiation[J].Chemistry of Materials, 2007, 19: 198-202.
[15]梁伟夏, 莫伟彬.半导体光催化氧化技术的研究进展[J].化工新型材料, 2009, 37: 18-20.LIANG Wei-xia, MO Wei-bin.Research progress on the photocatalytic oxidation technology with semiconductors[J].New Chemical Materials, 2009, 37: 18-20.
[16]ZHANG S, ZHANG C, MAN Y, ZHU Y F.Visible-light-driven photocatalyst of Bi2WO6nanoparticles prepared via amorphous complex precursor and photocatalytic properties[J].Journal of Solid State Chemistry, 2006, 179: 62-69.
[17]FU H B, ZHANG L W, YAO W Q, ZHU Y F.Photocatalytic properties of nanosized Bi2WO6catalysts synthesized via a hydrothermal process[J].Applied Catalysis B: Environmental,2006, 66: 100-110.
[18]戈 磊, 张宪华.微乳液法合成新型可见光催化剂Bi2WO6及其光催化性能[J].硅酸盐学报, 2010, 38: 457-462.GE Lei, ZHANG Xian-hua.Novel visible light driven Bi2WO6 photocatalysts synthesized via the microemulsion process and its photocatalytic performance[J].Journal of the Chinese Ceramic Society, 2010, 38: 457-462.
[19]徐 缇, 陈建林, 王仪春.Bi2WO6可见光催化降解染料废水实验研究[J].环境科学学报, 2007, 27: 1439-1443.XU Ti, CHEN Jian-lin, WANG Yi-chun.Photocatalysis of dye wastewater by Bi2WO6 under visible light[J].Acta Scientiae Circumstantiae, 2007, 27: 1439-1443.
[20]郑玉芹, 谈国强, 博海洋, 夏 傲, 任慧君.pH 值对Bi2WO6粉体的微波水热法合成及光催化性能的影响[J].硅酸盐学报,2011, 39: 481-485.ZHENG Yu-qin, TAN Guo-qiang, BO Hai-yang, XIA Ao, REN Hui-jun.Effect of pH value on synthesis of Bi2WO6powders by microwave hydrothermal method and photocatalytic properties[J].Journal of the Chinese Ceramic Society, 2011, 39:481-485.
[21]SONG X C, ZHENG Y F, MA R, ZHANG Y Y, YIN H Y.Photocatalytic activities of Mo-doped Bi2WO6three-dimensional hierarchical microspheres[J].Journal of Hazardous Materials,2011, 192: 186-191.
[22]KUDO A, SATOSHI H.H2or O2evolution from aqueous solutions on layered oxide photocatalysts consisting of Bi3+with 6s2configuration and d0transition metal ions[J].Chemistry Letters, 1999, 10: 1103-1104.
[23]HE Z, SUN C, YANG S G, DING Y C, HE H, WANG Z L.Photocatalytic degradation of rhodamine B by Bi2WO6with electron accepting agent under microwave irradiation:Mechanism and pathway[J].Journal of Hazardous Materials,2009, 162: 1477-1486.
[24]HUANG G L, ZHU Y F.Synthesis and photocatalytic performance of ZnWO4catalyst[J].Materials Science and Engineering B, 2007, 139: 201-208.
[25]QU P, ZHAO J C, SHEN T.TiO2-assisted photodegradation of dyes: A study of two competitive primary processes in the degradation of RhB in an aqueous TiO2colloidal solution[J].Journal of Molecular Catalysis A: Chemical, 1998, 129:257-268.
[26]ZHANG C, ZHU Y.Synthesis of square Bi2WO6nanoplates as high-activity visible-light-driven photocatalysts[J].Chemistry of Materials, 2005, 17: 3537-3545.
[27]ZHANG Z J, WANG W Z, GAO E, SHANG M, XU J H.Enhanced photocatalytic activity of Bi2WO6with oxygen vacancies by zirconium doping[J].Journal of Hazardous Materials, 2011, 196: 255-262.
