超急性脑卒中血脑屏障和相关脑代谢物变化的研究
2014-12-13章桃聂婷婷贾岩龙易美芝戴卓智延根吴仁华
章桃,聂婷婷,贾岩龙,易美芝,戴卓智,延根,吴仁华,2*
1.汕头大学医学院第二附属医院放射科,汕头 515041
2.广东省医学影像实验教学示范中心,汕头 515041
组织型纤溶酶原激活剂(recombinant tissue type plasminogen activator,rt-PA)溶栓治疗是改善急性缺血性卒中预后的有效治疗方法,即在急性卒中发病3h时间窗内应给予rt-PA静脉溶栓治疗[1]。但在缺血性脑卒中溶栓治疗的安全性和有效性方面的研究显示,血脑屏障(blood brain barrier,BBB)损伤变化可直接影响溶栓的效果[2-3]。然而,缺血性脑卒中早期阶段BBB损伤的相关评判标准尚未清楚。起病3 h内,尚缺乏有关急诊分诊脑卒中的有效筛查工具及评分系统。目前发病3 h内CT仅能提供排除脑出血的有效信息,并为rt-PA溶栓治疗提供有效依据[4-5]。增强MRI是一种敏感的在活体条件下检测BBB损伤的理想方法[6],但在脑卒中早期因再灌注副影响而使其运用受限,不能为行rt-PA治疗筛查选择提供更有用的客观依据。频谱是在活体上能无创性检测脑代谢物的方法,特别是病变早期能为缺血缺氧所引起的急剧能量衰竭、钙过度的积累、线粒体基因表达失调、自由基的产生、酸中毒及细胞凋亡相关性急性脑卒中的早期诊断提供有效影像学信息及客观依据[7]。笔者利用能准确把握发病时间段的大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)大鼠模型在7.0 T动物MR扫描仪上通过1H MRS和CE-T1WI主要技术,研究缺血性脑卒 中发病3 h内MRS中某些特异性代谢物如牛磺酸及谷氨酸的变化与同一时间段CE-MRI结果(BBB的变 化)的联系,来探讨这些代谢物变化对判定BBB破坏的意义。
1 材料及方法
1.1 动物准备
动物使用过程符合国家卫计委指导动物研究准则(实验动物饲养及使用准则),并经汕头大学动物伦理委员会批准。20只SD雄性大鼠(购自北京实验动物中心),体重250~280 g,饲养于明、暗环境各12 h,自由获取食物和水。所有动物饲养的设施及环境条件符合中国国 家标准《实验动物环境及设施》(GB14925-2001)对普通动物实验设施的有关标准,动物饲养管理和动物实验操作符合《北京市实验动物管理条例》法规的要求。
1.2 缺血脑卒中MCAO大鼠动物模型的建立
利用大鼠大脑中动脉内栓线阻断方法,具体步骤如下:用10%水合氯醛溶液400 mg/kg,腹腔注射麻醉动物,大鼠仰卧位固定四肢,备皮消毒,颈部正中切开皮肤,钝性分离各层组织,分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。用眼科剪剪开颈动脉鞘,暴露右侧颈总动脉(common carotid artery,CCA),沿CCA分离至颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA)分叉后一段,仔细分离避免损伤迷走神经和气管,置5-0丝线备用。将ECA近心端及远心端结扎,中间剪断,并在ICA和ECA分叉处的ECA根部置5-0丝线并打一个活结备用,然后将ICA、CCA用动脉夹夹闭。用眼科剪在ECA游离端剪一小口,并将ECA游离端拉至与ICA成一条直线,将尼龙线由ECA插入,插入后用所置5-0丝线适当用力结扎,以防止出血,打开ICA处动脉夹,将尼龙线插入ICA,继续插入至颅内,插入深度约(18.5±0.5)mm至微感阻力,使尼龙线头端通过大脑中动脉(middle cerebral artery,MCA)起始处,到达较细的大脑前动脉(anterior cerebral artery,ACA),此时即实现右侧MCA的血流阻塞,稍用力拉紧所置5-0丝线,以结扎ECA来固定尼龙线和防止出血。阻断成功后将ECA结扎,然后逐层缝合,以备MRI检查。
所用20只SD大鼠分为4组,每组5只,4组大鼠均在梗死10 min时用DWI确认梗死成功。1~3组用于CE-T1WI扫描,各组分别于梗死后“30 min、1.5 h和2 h”不同时间点再灌注(拔掉线即为再灌注),以梗死后再灌注的时间点不同分组,各组均在再灌注后即刻注入造影剂并行动态扫描,追踪至增强后2h。第4组用于MRS采集,未行再灌注,分别在大脑中动脉梗死1、2及3 h后进行。
1.3 MRI及MRS
在体MRI及MRS实验前,将尚在麻醉状态的MCAO大鼠俯卧位放置,头部固定,头部固定器内有可调节气体管道,在扫描过程中由管道通入1.5%~2.0%异氟烷和空气混合气体(250 ml/min)持续麻醉。20只MCAO大鼠分4组,每组5只全部接受MRI检查,使用Drive 2(安捷伦科技、美国)160 mm孔径7.0 T动物MR扫描仪,400 mT/m梯度线圈,采集波谱使用专用动物脑表面线圈(20 mm,157~350 MHz,安捷伦科技、美国)以激发及接受MRI信号。
第1~3组,首先采集定位图,确定动物位置摆放正确及图像质量,再行DWI序列确认梗死成功,而后获得T1WI(自旋回波SEMS,TR 500 ms,TE 10 ms,层厚1.0 mm,矩阵128×128),于缺血梗死30 min(第1组5只)、1.5 h(第2组5只)和2 h(第3组5只)再灌注,各组均在再灌注后即刻从尾静脉注射钆喷酸葡胺(gadolinium diethylene-trianmine pentaacetic acid,Gd-DTPA),剂量为0.1 mmol/kg,后行动态扫描,追踪至增强后2 h。
第4组,同样采集定位图,确定动物位置摆放正确及图像质量,先行DWI序列确认梗死成功,而后获取FSETrace(快速自旋回波RARE,TR 2500 ms,TE 48 ms,回波链4,层厚1.0 mm,矩阵128×128)图像以备定位感兴趣区(VOI),VOI选择缺血病变区及对侧正常区域(3.5 mm×3.5 mm×3.5 mm),调整VOI使其准确定位于DWI上高信号区。采用Ge3D自动匀场,匀场效果达到水峰带宽15~20 Hz,选用超短回波时间激发序列(STEAM)获取MRS信号,TR 5000 ms,TM 12.72 ms,TE 2.35 ms,光谱宽度5000 Hz,NEX为160,扫描时间13 min。扫描前采集独立水峰,以评价匀场效果、估计涡流影响并作为物质绝对定量分析的参考,波谱采集时使用VAPOR抑制水信号。MRS采集分别在大脑中动脉梗死1、2及3 h后进行。
采集的MRS原始数据使用LCModel绝对定量分析[8]。原始数据采用标准格式(FIDs)输入,没有进一步的T1和T2校正,获取水抑制后谱线在0.2~4.0 ppm之间代表的各物质,分析以下诸代谢物:肌酸(Cr)、γ-氨基丁酸(GABA)、谷氨酸(Glu)、谷氨酰胺(Gln)、甘油磷酰胆碱(GPC)、磷酰胆碱(PCho)、肌醇(MI)、乳酸(Lac)、N-乙酰天冬氨酸(NAA),N-乙酰天冬氨酰谷氨酸(NAAG)、磷酸肌酸(PCr),牛磺酸(Tau)。为获取更可靠的结果,部分代谢物[天冬氨酸和乙酰天冬氨酰谷氨酸化合物(NAA+NAAG)、谷氨酸和谷氨酰胺化合物(Glu+Gln)、甘油磷酰胆碱和磷酰胆碱化合物(GPC+Pcho)、肌酸和磷酸肌酸化合物(Cr+PCr)]以总量形式参与计算,代谢产物MI和Tau单独量化。
用标准误差估计和最大下界(CRLBs)方法对LCModel波谱分析所得的各物质定量赋予可靠性或不确定性[8]。
1.4 统计学处理
所有数据分析均用SPSS 15.0统计软件包处理,计量资料用单因素方差分析(ANOVA),使用t检验在组均值之间执行成对比较,P<0.05为差异有统计学意义。
2 结果
第1组MCAO大鼠缺血梗死30 min再灌注30 min后在增强T1WI上未显示增强效应,第2组梗死1.5 h再灌注30 min后增强扫描观察到脑室系统有明显高信号,而第3组梗死2.0 h再灌注30 min后增强扫描则观察到脑实质内有异常的高信号(图1)。
T2WI上MCAO大鼠均未显示明确的梗死灶,而10 min MCAO大鼠DWI上均显示有异常的高信号分布在大脑中动脉供血的纹状体区及顶叶皮层区,ADC上均观察到有异常的低信号区同DWI上异常高信号区匹配,且出现在同一时间段(图2)。
第4组MCAO大鼠分别以大脑中动脉栓塞1 h后MCAO大鼠病变中心及对侧正常区域为感兴趣区得到MRS数据,用LCModel分析后显示由病变区获得的谱线位于1.33~1.35 ppm的Lac双峰增高,主要位于2.02 ppm的NAA峰下降(图3A,B),大脑中动脉梗死后各小时段测到的病变区Lac和NAA绝对浓度亦较正常对侧组有显著性差异(P<0.01)。病变区主要位于2.1~2.4 ppm和3.65~3.8 ppm的谷氨酸类化合物Glx(Gln+Glu)和兴奋性神经递质Glu、抗氧化与渗透有关代谢物Tau、主要位于3.05 ppm的Cr+PCr浓度,1 h开始逐渐上升,到2 h段呈高峰,3 h段呈明显下降的趋势。其中Tau、Glx和Cr+PCr 2 h段的绝对浓度比1、3 h段测到的浓度高,差异有统计学意义(P<0.01)(图3C,D)。1、2、3 h各时间段主要位于3.20 ppm的GPc+PCh和Lac浓度未见特异性改变。

图1 A:大脑中动脉梗死30 min再灌注30 min后增强T1WI,未见明显高信号;B:大脑中动脉梗死1.5 h再灌注30 min后增强T1WI,可见脑室系统高亮信号 ;C:大脑中动脉梗死2 h再灌注30 min后增强T1WI,可见脑实质内增强信号Fig.1 Evolution of BBB damage and tissue infarction within the fi rst 3 h after MCAO onset.In the 0.5 h MCAO group,after 0.5 h reperfusion,no hyperintense signals were seen(A),while in the 1.5 h MCAO group,abnormal hyperintense signals were seen in both lateral ventricles and the central canal in the CE-T1WI image(B),and expanded with time to other MCA regions,including the ventromedial striatum in the 2 h MCAO group(C),after 0.5 h reperfusion.
3 讨论
溶栓治疗时间窗内发生的BBB的破坏对缺血性脑卒中溶栓治疗安全性和有效性有很大影响。不能获得足够的信息指导溶栓治疗,限制了rt-PA静脉溶栓治疗给患者带来的益处。如何快速、有效、简便筛查出适合rt-PA静脉溶栓治疗的急性脑梗死患者一直是关注和研究的热点,影像学指导的缺血性脑卒中个体化溶栓治疗是今后发展的一个方向。近年来随着CT、MRI技术的发展,可对缺血性脑卒中进行快速神经影像学评价,在急性缺血性脑卒中个体化治疗方面发挥一定的作用。但CT对超急性期的脑梗死以及脑缺血半暗带的诊断敏感性较低,而且对某些部位如幕下病变的敏感性不如MRI。MRI通常比其他断层扫描具有更高的空间分辨率,随着MRI技术的不断进步,能够同时进行解剖定位及生理、代谢方面的分析,并快速评估组织血流变化为临床制定个体化治疗提供帮助。比如,依据DWI和PWI不匹配理论判定缺血半暗带等,使影像学指导的个体化溶栓治疗成为急性缺血性脑卒中治疗研究的热点和发展方向[9-12],但早期DWI可视化扩展及PWI随时间变化等有待解决的问题尚多。笔者初步研究表明:运用多模式MRI检查序列可以在急性缺血性脑卒中发展过程中描述BBB破坏的时空演化,并检测同时间段其脑代谢物变化,这些特异性非常高的代谢物有可能反映BBB的演化过程,在筛选溶栓治疗患者和判断疗效方面均有较大应用价值,特别是对rt-PA溶栓治疗时间窗不明确者的筛选。
增强MRI是一种敏感的在活体条件下检测BBB损伤的理想方法[6],所用对比剂Gd-DTPA是一种顺磁性金属离子螯合物,其原型在体内有很高的稳定性,且毒性很低,可通过肾小球的滤过很快被清除。Gd-DTPA不能通过正常脑组织的BBB[13],因此,如果存在有Gd-DTPA的增强,即表明BBB受到破坏,通透性增加。Lo等[14]采用Gd-DTPA增强MRI和免疫组织化学方法对兔局灶性脑缺血时BBB的破坏进行了对比研究,结果发现增强MRI所显示的BBB受损的区域与血清蛋白漏出引起的免疫组织化学染色的区域相一致。本研究中采用增强MRI的方法研究了短暂脑缺血后BBB的破坏情况,发现缺血30 min后再灌注组沿着时间的变化未见增强效应,但缺血1.5 h后再灌注组30 min可见脑室系统(侧脑室、三脑室)均有显著强化,而缺血2.0 h后再灌注组脑实质部分已被强化,这表明BBB受到了破坏,Gd-DTPA从受损的脉络丛渗透到了侧脑室BBB并渗透到脑实质内。BBB存在于脉络丛上皮,其结构特征为脉络膜上皮细胞的紧密连接,这些紧密连接的上皮细胞限制了蛋白质和其它非脂溶性分子在血液与脑脊液之间的通透。因此,BBB破坏的机制可以认为是由于脉络丛上皮缺血性损伤的结果。脉络丛、海马、背外侧纹状体和新皮层被认为是最易遭受缺血性损伤的区域。本研究结果也表明脉络丛最先受到破坏,纹状体区的BBB皮层更易受到破坏,研究中还清晰观察到缺血后BBB破坏的过程及其时间段[2]。
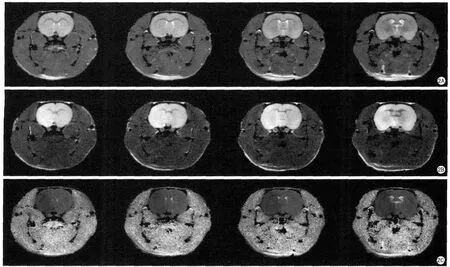
图2 A~C:依次为MCAO 10 min T2WI、DWI、ADC。T2WI上MCAO大鼠均未显示明确的梗死灶,而10 min MCAO大鼠DWI上均显示有异常的高信号分布在大脑中动脉供血的纹状体区、顶叶皮层区,ADC上均观察到有异常的低信号区同DWI上异常高信号区匹配Fig.2 T2-weighted image(A),DWI(B),and ADC map(C)of a rat 10 min after middle cerebral artery occlusion.Hyperintense lesions in the right corpus striatum and parietal cortex are clearly identifi ed on DWI,and a corresponding reduction in ADC values(hypointense)can be seen on the ADC map,whereas no lesion signs were observed on the T2-weighted image acquired 10 min after ischemia onset.

图3 A:是采集频谱VOI区;B:经LCModel 处理后MRS图;C,D:是缺血病变区不同时间段(1、2、3 h)Taurine和Glutamate MRS结果,其中2 h明显高于1、3 h段(*P < 0.05)Fig.3 A:The location of VOI(3.5 mm × 3.5 mm × 3.5 mm)in the brain of MCAO rat subjected to DWI.B:1H-MRS in the ischemic regions.C,D:Taurine and glutamate concentrations in the ischemic regions at different times after MCAO are shown.Error bars indicated the standard deviation.Signifi cance level:*P < 0.05.
1H MRS是目前惟一能无创性观察活体组织代谢及生化变化的技术,已在临床上广泛应用,譬如在神经系统方面的应用[15]。1H MRS在脑内所能探测到的代谢物都与三羧酸循环和能量代谢有关,特别是能为缺血缺氧所引起的急剧能量衰竭、钙过度的积累、线粒体基因表达失调、自由基的产生、酸中毒及细胞凋亡相关性急性脑卒中的早期诊断提供有效影像学信息及客观依据[16]。本研究中大脑中动脉梗死1 h时测到的波谱显示,MCAO大鼠病变中心VOI(DWI高信号区)比对侧正常区域有明显的Lac增高及NAA峰下降。随时间的变化梗死1、2、3 h GABA、NAA和NAA+NAAG浓度呈逐渐下降的趋势。另外,有研究表明Lac值升高而NAA值无明显下降的区域既可能是缺血后可以挽救的组织,即可能诊断缺血性半暗带[16]。但本研究中大脑中动脉栓塞3 h内病变区Lac和NAA的浓度未见相关性。
抗氧化与渗透有关代谢物Tau、谷氨酸类化合物Glx和兴奋性神经递质Glu、Cr+PCr浓度,1 h开始逐渐上升,到2 h时呈高峰,3 h后出现明显下降的趋势。特别其中Tau峰在大脑中动脉栓塞2 h段的绝对浓度明显高于其他时间段测到的浓度,在统计学上有意义(P<0.01)并且有特异性。大脑中牛磺酸水平由亦参与在BBB中的牛磺酸运输系统来调控,就是说缺血性脑卒中病变区牛磺酸水平间接反映BBB损伤变化[17]。因此,这种特异性变化有可能间接反映缺血性脑卒中发病中BBB破坏的发生、发展及转归过程,并在筛选rt-PA治疗者方面起到重要的作用。
利用影像学工具描述超急性缺血性脑卒中BBB时空演化目前还缺乏循证医学依据,因梗死血管不同、不同程度侧支循环的存在及脑组织自身功能程度不同,引起BBB破坏程度和时间不同,所以对脑梗死的病因评价尚需综合分析。另外,在体动物实验结果可能与患者实际情况存在着部分差异,但在准确把握发病时间段方面仍可提供很重要的影像学信息,并将有利于及时挽救急性缺血性卒中患者的缺血脑组织,从而更好的使患者获益。神经影像如何更准确地确定可挽救脑组织、量化评估脑卒中发病时间段,更加准确地筛选适合溶栓治疗者,尚有待技术的开发和进一步研究,笔者运用多模式MRI检查序列初步描绘了急性缺血性脑卒中发展过程中BBB破坏的时空演化,为上述问题的解决提供了可能的途径。
[References]
[1]Jauch EC,Saver JL,Adams HP,et al.Guidelines for the early management of patients with acute ischemic stroke a guideline for healthcare professionals from the american heart association american stroke association.Stroke,2013,44(3):870-947.
[2]Pardridge WM.Blood-brain barrier delivery.Drug Discov Today,2007,12(1):54-61.
[3]Ballabh P,Braun A,Nedergaard M,et al.The blood-brain barrier:an overview:structure,regulation,and clinical implications.Neurobiol Dis,2004,16(1):1-13.
[4]Bahn MM,Oser AB,Cross DT,et al.CT and MRI of stroke.J Magnet Reson Imaging,1996,6(5):833-845.
[5]Liu HJ,Zhang Y,Yang JP.The CT,MRI performances and understanding in cerebral ischemia.Chin J Magn Reson Imaging,2013,4(1):47-58.刘怀军,张岩,杨冀萍.脑缺血的CT、MR表现及其理解.磁共振成像,2013,4(1):47-58.
[6]Ding G,Jiang Q,Li L,et al.Detection of BBB disruption and hemorrhage by Gd-DTPA enhanced MRI after embolic stroke in rat.Brain Res,2006,1114(1):195-203.
[7]Peng J,Luo TY,Lü FJ,et al.Elevated Lip signals on1H-MRS in differential diagnosis of intracranial lesions.Chin J Magn Reson Imaging,2011,2(1):50-54.彭娟,罗天友,吕金,等.质子MRS脂质峰升高在颅内疾病鉴别诊断的价值.磁共振成像,2011,2(1):50-54.
[8]Provencher SW.Automatic quantitation of localizedin vivo1h spectra with lcmodel.NMR Biomed,2001,14(2):260-264.
[9]Tong D,Yenari M,Albers G,et al.Correlation of perfusion and diffusion weighted MRI with nihss score in acute(< 6.5 hour)ischemic stroke.Neurology,1998,50(4):864-869.
[10]Neumann-Haefelin T,Wittsack HJ,Wenserski F,et al.Diffusion-and perfusion-weighted MRI the DWI/PWI mismatch region in acute stroke.Stroke,1999,30(2):1591-1597.
[11]Rordorf G,Koroshetz WJ,Copen WA,et al.Regional ischemia and ischemic injury in patients with acute middle cerebral artery stroke as defi ned by early diffusion-weighted and perfusion-weighted MRI.Stroke,1998,29(5):939-943.
[12]Schellinger P,Bryan R,Caplan L,et al.Evidence-based guideline:the role of diffusion and perfusion MRI for the di agnosis of acute ischemic stroke report of the therapeutics and technology assessment subcommittee of the american academy of neurology.Neurology,2010,75(1):177-185.
[13]Tofts PS,Kermode AG.Measurement of the blood‐brain barrier permeability and leakage space using dynamic MR imaging.Magnet Reson Med,1991,17(2):357-367.
[14]Lo EH,Pan Y,Matsumoto K,et al.Blood-brain barrier disruption in experimental focal ischemia:comparison between in vivo MRI and immunocytochemistry.Magnet Reson Imaging 1994,12(3):403-411.
[15]Wu L,Tang Z,Sun X,et al.Metabolic changes in the visual cortex of binocular blindness macaque monkeys:a proton magnetic resonance spectroscopy study.PLoS One,2013,8(11):e80073.
[16]Yan G,Zhao DW,Dai ZZ,et al.Quantitative assessment of hyperacute ischemic stroke onset time window.Chin J Magn Reson Imaging,2014,5(1):74-79.延根,赵大威,戴卓智,等.评估量化超急性期缺血性脑卒中发病时间窗的研究.磁共振成像,2014,5(1):74-79.
[17]Kang YS,Ohtsuki S,Takanaga H,et al.Regulation of taurine transport at the blood-brain barrier by tumor necrosis factor-α,ta urine and hypertonicity.J Neurochem,2002,83(5):1188-1195.
