黄孢原毛平革菌脂肪合成现象的探讨
2014-12-11杨益君费婷
杨益君 费婷
(杭州杭康卫生检测技术有限公司,浙江杭州 310000)
黄孢原毛平革菌脂肪合成现象的探讨
杨益君 费婷
(杭州杭康卫生检测技术有限公司,浙江杭州 310000)
本文以土豆滤液配制Kirk培养基培养黄孢原毛平革菌,从定性方面研究其产脂规律。
黄孢原毛平革菌 脂肪含量
1 前言
20世纪80年代以来,国内外学者一直着眼于研究微生物产脂这一课题,其中细菌和真菌的产脂规律更是研究的热点,本文以黄孢原毛平革菌(phanerovhaete chrysosporium Burd.)作为实验对象,在定性方面,采用苏丹黑B染色法,在显微镜下观察黄孢原毛平革菌菌丝体内的脂肪粒,对黄孢原毛平革菌的脂肪合成代谢规律进行分析。
2 实验材料
2.1 菌种来源
本研究选用的白腐真菌菌种为黄孢原毛平革菌(phanerovhaete chrysosporium Burd.),由中国科学院微生物研究所菌种保藏中心提供。
2.2 培养基材
PDA培养基:称取200g马铃薯,洗净去皮切碎放入锅中,加入1000ml纯水,置于电炉上加热,待沸腾后开始计时,30min后停止加热。稍稍冷却后,用纱布过滤,将上清液倒入事先准备好的500ml锥形瓶中。然后在高压灭菌锅(121℃,1.2大气压)中灭菌20min,灭菌后冷却,放入冷藏柜,保存备用。移取400ml预制的土豆滤液,加入4g葡萄糖和10g琼脂,充分溶解后在高压灭菌锅(121℃,1.2大气压)中灭菌20min,取出后倒入培养皿中,每个培养皿中倒入约15~20ml,冷却凝固。
Kirk培养基:10g/L葡萄糖、0.221g/L酒石酸铵、2.0g/LKH2PO4、0.5g/LMgSO4·7H2O、0.132g/LCaCl2、1mg/LVB1及1ml/L微量元素、100mL醋酸缓冲剂(pH6.0),以土豆滤液为溶剂,定容至1000ml。
2.3 实验试剂
藏红T;二甲苯;无水乙醇;盐酸;乙醚;石油醚(30℃~60℃沸程);葡萄糖;酒石酸铵;KH2PO4;CaCl2;MgSO4·7H2O;VB1;醋酸钠;冰醋酸。以上化学试剂均为分析纯。
2.4 实验仪器设备
本实验使用的主要实验仪器:FL-107显微镜;BXM-30R立式压力蒸汽灭菌器;GSP-9050MBE隔水式恒温培养箱;AB135-S梅特勒电子分析天平等。
3 实验方法
3.1 黄孢原毛平革菌培养方法
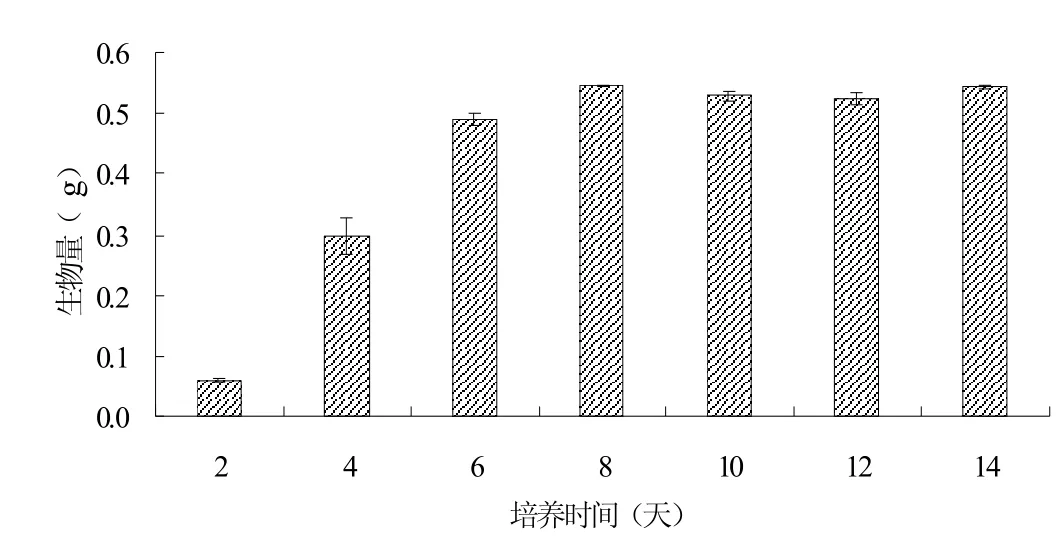
图1 黄孢原毛平革菌生物量变化
采用静置培养方式,将配制的Kirk培养基分别装入培养瓶中,每瓶培养瓶中装50ml培养基,在高压灭菌锅(121℃,1.2大气压)中灭菌40 min。灭菌后,把培养瓶从高压灭菌锅中取出,待冷却至室温。采用打孔器(直径1.0cm)在PDA培养基上打孔取黄孢原毛平革菌的菌块,然后将菌块接入培养瓶里,使菌块漂浮在Kirk培养基表面。接种后将培养瓶放入温度为25℃,湿度为65%的恒温培养箱中培养。每个培养基设置4个平行样。
3.2 生物量测定办法
先把定量滤纸放到80℃的烘箱中烘至恒重,然后放到干燥器中冷却到室温称重得质量m1。用布氏漏斗过滤分离菌球与培养基,滤出菌球后把滤纸及滤纸上的菌球放到40~60℃的干燥箱中烘至恒重。然后放到干燥器中冷却到室温称重得质量m2。菌丝体干重
3.3 苏丹黑B染色法
滴一滴蒸馏水于载玻片上,挑取少许菌丝体于其中进行热固定。待冷却后,加一滴0.3%苏丹黑B染色液,自然干燥10~15min。再滴加二甲苯脱色直至洗出液透明。干燥后,番红复染1~2min,水洗至洗出液透明。干燥后镜检,在光学显微镜(1600×)下观察[2]。
3.4 脂肪含量测定方法
脂肪含量测定方法采用GB/T 5009.6-2003《食品中脂肪的测定》中的酸热法[1]。
4 结果与分析
4.1 黄孢原毛平革菌产脂情况
4.1.1 黄孢原毛平革菌生物量的变化
在温度为25℃,湿度为65%的培养箱中,用Kirk培养基培养黄孢原毛平革菌,观察黄孢原毛平革菌的生长情况,并且测定其在不同培养时间的生物量,运用t检验分析数据间的显著性差异,探讨黄孢原毛平革菌生物量的变化趋势,结果如图1所示。
通过t检验,从图1中发现第2、4、6、8、10天之间的生物量都具有显著性差异(P<0.05),第10、12、14天之间的生物量没有显著性差异(P>0.05),可知第2、4、6、8天的生物量快速增长,第10天的生物量有所下降,而从第10天开始黄孢原毛平革菌的生物量基本不变,维持一个平稳的状态。
由此得出,黄孢原毛平革菌在其生长过程中,初始阶段生物量会有一个迅速增长的趋势,第8天,黄孢原毛平革菌获得了最大的生
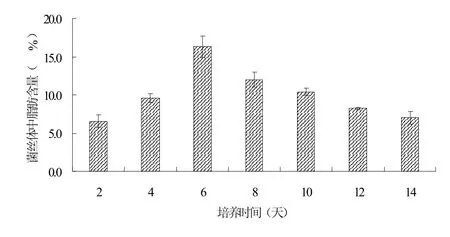
图2 黄孢原毛平革菌菌丝体中脂肪含量变化
物量,为0.5457g,而从第8天到第10天,生物量又会出现短时间的下降趋势。从第10天开始,黄孢原毛平革菌的生物量基本保持不变。
4.1.2 黄孢原毛平革菌产脂量的变化
采用酸热法来测定不同培养时间的黄孢原毛平革菌菌丝体中的脂肪含量。通过测定菌丝体中的脂肪含量,运用t检验分析数据间的显著性差异,来探讨黄孢原毛平革菌在培养过程中是否存在脂肪的合成,并且分析其产脂规律。
如图2所示,第6天,菌丝体中的脂肪含量达到最高值,即为16.29%。通过t检验,可以发现第2、4、6天之间的黄孢原毛平革菌菌丝体中的脂肪含量有显著性差异(P<0.05),得到第2、4、6天黄孢原毛平革菌菌丝体中的脂肪含量呈上升趋势。这可能是因为黄孢原毛平革菌的代谢发生歧化作用,进入了油脂合成阶段。第6、8、10、12天之间的黄孢原毛平革菌菌丝体中的脂肪含量也有显著性差异(P<0.05),得到第6、8、10、12天黄孢原毛平革菌菌丝体中的脂肪含量呈下降趋势。其原因可能是由于培养基中的营养不足,以致于黄孢原毛平革菌以生成的脂肪作为能源来维持自身的生长。第12、14天之间的黄孢原毛平革菌菌丝体中的脂肪含量没有显著性差异(P>0.05),从第12天开始,菌丝体中的脂肪含量维持一个平稳的状态。
4.2 黄孢原毛平革菌菌丝体染色结果
本实验采用苏丹黑B染色法对第2、6、12天的黄孢原毛平革菌菌丝体进行染色。采用苏丹黑B染色后,菌丝体中的脂肪粒呈现蓝灰色,由此可以直观地判断菌丝体中脂肪含量的多寡。
在第2、6、12天,菌丝体内都存在蓝灰色脂肪粒,并且呈现出先增加后减少的现象。第6天,脂肪粒的数量最多并且分布密集,菌丝体脂肪含量达到最高值。这与图2中菌丝体内的脂肪含量呈现先增加后减少再趋于平稳的趋势基本符合。
综上所述,通过黄孢原毛平革菌菌丝体的镜检结果,可以说明在黄孢原毛平革菌的生长过程中有脂肪的合成,并且其变化趋势与产脂培养实验结果基本一致。通过生物量、菌丝体的变化,发现在培养过程中,生物量、菌丝体中脂肪含量都呈现先增加后减少再趋于平稳的趋势。
5 结语
本实验从定性方面来论述这一研究课题。运用苏丹黑B染色法对第2、6、12天的黄孢原毛平革菌菌丝体进行染色,在光学显微镜下观察到第2、6、12天的黄孢原毛平革菌菌丝体内均存在蓝灰色的脂肪粒,并且脂肪粒的数量呈现出先增加后减少的趋势,说明在黄孢原毛平革菌的生长过程中有脂肪的合成,其变化趋势与产脂培养实验中所得到的数据相符。
[1] GB/T 5009.6-2003.食品中脂肪的测定[S].北京:中国标准出版社,2003.
[2] 李元森.产油脂丝状真菌的筛选及其产油脂条件的优化[D].山东轻工业学院硕士学位论文,2009.
