荧光原位杂交法观察小鼠皮肤组织切片中型无绿藻感染的研究
2014-12-09康俞莉赵颖章强强
康俞莉 赵颖 章强强
荧光原位杂交法观察小鼠皮肤组织切片中型无绿藻感染的研究
康俞莉 赵颖 章强强
目的探讨荧光原位杂交技术用于诊断小鼠皮肤中型无绿藻感染模型的可行性。方法制作小鼠皮肤中型无绿藻感染模型,制备皮肤组织石蜡切片,用人工合成的探针PZ-probe进行荧光原位杂交检测,以过碘酸锡夫(PAS)染色、HE染色做阳性对照;取正常及其他真菌感染的皮肤组织石蜡切片做阴性对照,以同样的方法进行荧光原位杂交检测,将各种检测方法的结果进行对比分析。结果小鼠临床体征、病理检测及病原体培养结果均证实皮肤无绿藻感染模型建立成功。通过荧光原位杂交法成功检测出了小鼠皮肤中型无绿藻感染模型皮肤组织中的无绿藻病原体,结果与PAS染色和HE染色一致;而在正常及其他真菌感染的皮肤组织石蜡切片中均未能检测出无绿藻。结论荧光原位杂交法可以检测出小鼠皮肤中型无绿藻感染模型组织石蜡切片中的无绿藻病原体。
原壁菌属;皮肤;原位杂交,荧光;小鼠
无绿藻(Prototheca)是一种直径约3~30 μm的单细胞生物,广泛存在于自然界和动物体表及体内,是一种机会致病菌[1-2]。皮肤无绿藻病是由无绿藻感染导致的一种皮肤真菌病,也是无绿藻病最常见的类型,约占全球无绿藻病例报道的一半以上。其皮损表现多样,四肢与面部多发,呈局限性,多与创伤后病原菌侵入有关,有细胞免疫缺陷者损害易播散[3-5]。因皮肤无绿藻病无特异性临床表现,故诊断困难。目前虽然可以通过直接镜检、真菌培养、组织病理学、PCR等手段对皮肤无绿藻病进行鉴定和诊断,但是这些方法都有其局限性,因此需要探索更好的方法提高对皮肤无绿藻病的早期诊断率。
材料和方法
一、菌株
上海复旦大学附属华山医院皮肤科真菌室提供无绿藻菌株,分离自1例皮肤无绿藻病患者皮损,经形态学及分子生物学鉴定为中型无绿藻波多黎各变种[6],已收藏入美国菌种保藏中心(American Type Culture Collection,ATCC), 编 号 为 ATCC MYA-4789。取适量菌种接种于沙氏液体培养基,28℃恒温培养。
二、小鼠皮肤中型无绿藻感染模型的制作和标本采集
BALB/c雄性小鼠20只,SPF级,6~8周龄,18~22 g,购于复旦大学上海医学院实验动物研究中心[许可证编号:SYXK(沪)2009-0082]。参照小鼠皮肤无绿藻感染模型的建立方法[7],每只小鼠经腹部皮下多点接种1×109cfu/ml中型无绿藻菌悬液200 μl。7 d后处死小鼠,无菌条件下取其腹部皮肤,分别进行真菌镜检、培养和4%甲醛固定、石蜡包埋、4 μm厚连续切片,置于防脱载玻片上,以荧光原位杂交法(FISH)检测无绿藻,同时分别行PAS、HE染色,镜下观察无绿藻的形态特征,作为FISH检测的阳性对照。另外收集正常小鼠皮肤标本3例,收集其他真菌小鼠皮肤感染标本6例(其中白念珠菌感染标本3例,新生隐球菌感染标本3例),分别行PAS染色、HE染色及FISH检测作阴性对照。
三、探针制备
从基因库中下载所有无绿藻菌株及相邻种属代表性菌株的SSU rDNA序列,用Genious(5.65)软件进行序列比对,鉴定无绿藻属特有的序列区域;针对这些特异性序列,用Primer express 5.0进行探针设计。美国Invitrogen公司合成寡核苷酸探针PZ-probe:5'-CGACGACTCTCCCAACCCGCG-3',FITC荧光标记,并置于-20℃避光保存。用纯中型无绿藻悬液制成涂片,检验探针是否有效。将探针稀释至50 μmol/L,分装备用。
四、FISH检测
[8],方法简述如下:①脱蜡:石蜡切片经常规二甲苯脱蜡3次,每次5 min,100%乙醇脱蜡2次,每次3 min;②破壁:60℃预热的十六烷基三甲基溴化铵(CTAB)溶液,水浴20 min;③变性:80℃立式染缸预热,变性6 min,即移入预冷的70%、80%、100%乙醇内,每缸2 min,空气干燥;④杂交:准备探针,滴10 μl探针在组织上,终浓度为1 μmol/L(共20例标本),加盖玻片,胶水密封,37℃黑暗湿盒孵育6 h;⑤杂交后水洗,去除胶水和盖玻片,常温下2×SSC洗涤液中洗涤2次,每次3 min,梯度乙醇脱水,空气干燥;⑥在杂交区加入 10 μl 4',6-二脒基-2-苯基吲哚衬染细胞,盖上盖玻片,在Olympus荧光显微镜下观察、拍照,应用Photoshop CS 9.0软件进行图片处理。自步骤④开始均需避光操作。阳性对照和阴性对照同上述方法作FISH检测。
结 果
一、小鼠皮肤中型无绿藻感染模型
肉眼观察20只小鼠,接种无绿藻处均出现丘疹、脓肿,部分出现溃疡、结痂(图1),皮损直接镜检可见大小不一的抱子囊,内含数个无色透明的内生抱子(图2)。挑取小鼠皮损处分泌物,接种在沙氏培养基上,待单一菌落生长后,挑取典型菌落转接,采用划线分离法反复直至获得纯培养体,再接种于沙氏培养基上,7 d后可见白色奶油样、酵母样菌落,表面光滑,为无绿藻生长(图3)。根据小鼠临床体征、病理检测及病原体培养结果,小鼠皮肤中型无绿藻感染模型建立成功。
二、PAS、HE 染色结果
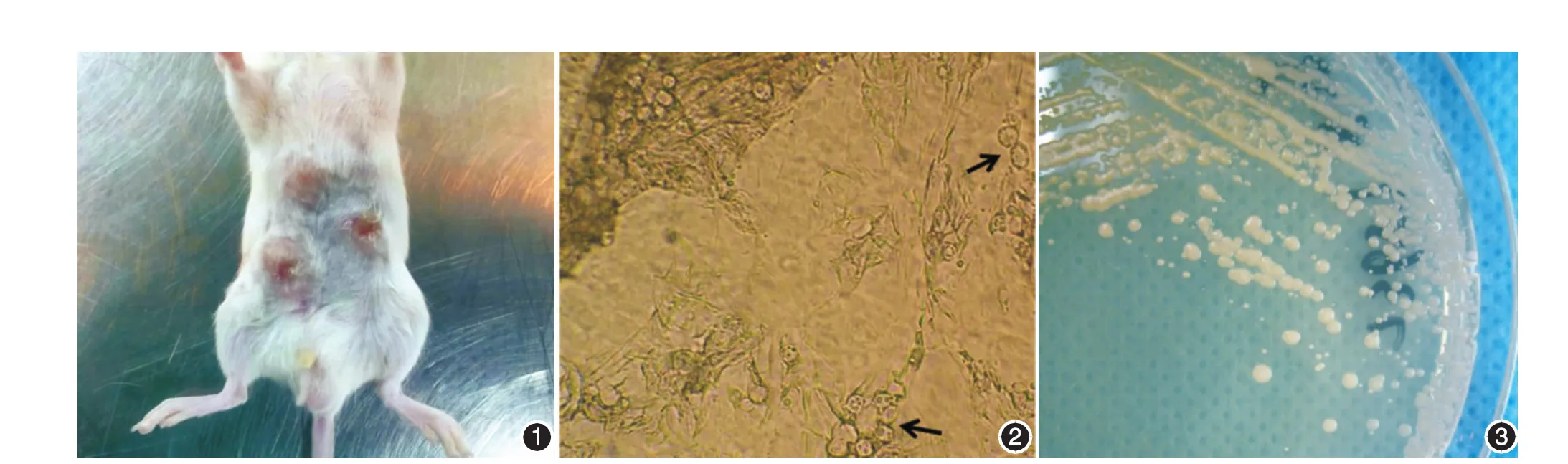
图1 小鼠皮肤中型无绿藻感染模型皮损大体观察:每只小鼠经腹部皮下多点接种1×109cfu/ml中型无绿藻菌悬液200 μl,7 d后观察,小鼠腹部皮肤表现为局部脓性丘疹,表面有破溃,结痂 图2 小鼠皮肤中型无绿藻感染模型,腹部皮损组织直接镜检观察。可见大小不一的抱子囊,内含数个无色透明的内生抱子(箭头),无菌丝(×400) 图3 挑取小鼠皮损处分泌物,经反复分离获得纯培养体后,接种在沙氏培养基上培养7 d,可见白色奶油样、酵母样菌落,表面光滑,为无绿藻生长的典型表现
20例小鼠皮肤中型无绿藻感染模型皮肤组织石蜡切片经PAS染色均可见无绿藻呈圆形、卵圆形、椭圆形,内含数个厚壁内抱子,不出芽(图4a)。PAS染色可清楚地检测出白念珠菌及新生隐球菌(图4b,4c)。15例小鼠皮肤中型无绿藻感染模型皮肤组织石蜡切片经HE染色可见典型无绿藻(图5a)。HE染色可检测出白念珠菌及新生隐球菌(图5b,5c)。根据病理检测结果,无绿藻、白念珠菌、新生隐球菌三者形态完全不同(图4,5)。

图4 小鼠皮肤真菌感染模型皮损组织病理(PAS染色×1 000,标尺20 μm) 4a:无绿藻,可见真皮组织无绿藻表现为圆形及椭圆形的内含内抱子的厚壁抱子囊,不出芽(箭头);4b:白念珠菌(箭头);4c:新生隐球菌(箭头) 图5 小鼠皮肤真菌感染模型皮损组织病理(HE×1 000,标尺20 μm) 5a:无绿藻,真皮层可见大量抱子,周围淋巴细胞和中性粒细胞浸润,无绿藻的内抱子清晰可见,呈分叶状(箭头);5b:白念珠菌(箭头);5c:新生隐球菌(箭头)
三、FISH检测结果
通过标记纯培养的中型无绿藻检测DNA探针的效果,结果提示该探针可完全标记中型无绿藻(图6)。20例小鼠皮肤中型无绿藻感染皮肤组织石蜡切片中,18例经FISH检测显示绿色颗粒状杂交信号,呈局灶性或散在分布,信号较强,易与背景区分,可确定为无绿藻病原体(图7);9例阴性对照小鼠皮肤组织石蜡切片未检出荧光信号。PAS、HE、FISH 3种方法诊断小鼠皮肤中型无绿藻模型的结果统计见表1。

表1 3种方法诊断小鼠皮肤中型无绿藻感染的结果(例)
讨 论

图6 DNA探针标记纯培养的中型无绿藻,结果显示无绿藻可被设计的探针标记(×1 000,标尺20 μm) 图7 小鼠皮肤中型无绿藻感染皮损组织石蜡切片探针检测(×1 000,标尺20 μm) 7a:呈卵圆形的绿色亮点即为无绿藻;7b:蓝色为4',6-二脒基-2-苯基吲哚
无绿藻病的诊断目前主要依靠直接镜检、真菌培养、组织病理学等手段对无绿藻进行鉴定。皮肤无绿藻感染的组织病理学检测可见桑葚样、草莓样抱子囊,内含数个厚壁内抱子,不出芽,PAS染色可清晰分辨病原菌的形态与结构,嗜银染色及免疫荧光亦可显色[9]。但某些真菌在组织中的形态与无绿藻相似,因此单纯用组织病理学难以确诊无绿藻病。真菌培养是明确诊断的最好办法,但其周期太长,往往需要1~2周,可能耽误患者病情,一些已送检的标本也常因体外生长条件不适合而无法培养出致病菌,导致假阴性[10]。近年来,PCR技术已成功用于检测真菌,但需要用物理液氮研磨的方法破碎细胞壁,提取DNA,其操作过程太过复杂[11]。由于上述常规手段在诊断无绿藻等真菌感染性疾病方面均存在敏感性低、周期长、操作复杂等不足,因此需要探索更好的方法。
FISH技术是在已有的放射性原位杂交技术的基础上发展起来的一种非放射性DNA分子原位杂交技术。它利用荧光标记的核酸片段做探针,与染色体上或DNA显微切片上的目标DNA序列特异性杂交,通过荧光检测系统(荧光显微镜)检测信号DNA序列在染色体或DNA显微切片上的表达,进而确定其杂交位点[12]。荧光标记探针不会对环境造成污染,灵敏度高,可进行多色观察分析,因而可同时使用多个探针,缩短因单个探针分开使用导致的周期长、过程复杂和技术障碍,可以在细胞标本或组织标本上进行。在FISH检测中,如何提高寡核苷酸探针透过细胞壁/膜进入细胞的效率是一个难点。已有研究证实,寡核苷酸探针通过疏水作用或者静电吸引作用,可穿透被CTAB包被的细胞壁,因此CTAB可以提高探针的穿透力。在本次研究中,我们使用CTAB包被无绿藻,提高了DNA探针进入无绿藻的穿透力,保证了实验的顺利进行。
与其他常规方法诸如,直接镜检、真菌培养、组织病理、PCR等比较,FISH具有以下特点:①所需时间短,一旦条件摸索成熟、方法建立,1 h内即可诊断,达到快速诊断的目的;②明显提高检测的阳性率,即使真菌培养和PAS染色均为阴性,也可检测出是否含有无绿藻;③无需提取DNA,可通过探针上所标记的检测系统将其在核酸的原有位置上显示出来,更直观地观察到无绿藻所在的部位;④在DNA分子的水平上进行杂交,不仅可以诊断出无绿藻的种属,也能也可用种特异性探针,直接鉴定到其种级水平;⑤可利用存放多年的石蜡切片;⑥实验所需用切片标本量少,不影响蜡块的保存和重复使用。
综上所述,本研究突破了常规真菌检测方法的局限性,设计中型无绿藻特异性DNA探针,首次尝试将FISH用于检测皮肤组织石蜡切片中的无绿藻感染,结果发现与PAS、HE染色检测结果一致。此技术为临床快速、准确诊断皮肤无绿藻病提供了新的方法。
参考文献
[1]Lass-Florl C,Mayr A.Human protothecosis[J].Clin Microbiol Rev,2007,20(2):230-242.
[2]章强强.中国无绿藻病发病的现状分析及其诊治[J].实用皮肤病学杂志,2013,6(2):65-67.
[3]Todd JR,King JW,Oberle A,et al.Protothecosis:report of a case with 20-year follow-up,and review of previously published cases[J].Med Mycol,2012,50(7):673-689.
[4]Zhang QQ,Li L,Zhu LP,et al.Cutaneous protothecosis in patient with diabetes mellitus and review of published case reports[J].Mycopathologia,2012,173(2-3):163-171.
[5]Lu S,Xi L,Qin W,et al.Cutaneous protothecosis:two new cases in China and literature review[J].Int J Dermatol,2012,51(3):328-331.
[6]Zhang Q,Weng X,Li L,et al.An unusual case of granulomatous lymphadenitis due toPrototheca zopfiivar.portoricensis in an immunocompetent man in China[J].Int J Infect Dis,2010,14(Suppl 3):e32-e355.
[7]曾义斌,赵颖,章强强.无绿藻感染小鼠皮肤模型的构建[J].中华皮肤科杂志,2013,46(10):746-748.
[8]马蕾,李若瑜.应用种特异性探针原位杂交技术检测系统性曲霉感染[J].中华皮肤科杂志,2002,35(2):128-130.
[9]李若瑜.应用现代化诊断方法提高我国真菌病诊断水平[J].中华检验医学杂志,2008,31(2):125-127.
[10]吕雪莲,刘泽虎,梅亚宁,等.二次用于临床标本真菌感染快速分子诊断的研究[J].中华皮肤科杂志,2009,42(6):390-392.
[11]赵婷婷.荧光原位杂交技术的发展与应用[J].生命科学仪器,2008,6(7):38-41.
[12]Ueno R.Visualization of sporopollenin-containing pathogenic green micro-algaPrototheca wickerhamiiby fluorescent in situ hybridization(FISH)[J].Can J Microbiol,2009,55(4):465-472.
2013-12-11)
(本文编辑:吴晓初)
Detection ofPrototheca zopfiiinfection in mouse skin tissue sections by using fluorescencein situ hybridization
Kang Yuli,Zhao Ying,Zhang Qiangqiang.Department of Dermatology,Huashan Hospital,Fudan University,Shanghai 200040,China
Zhang Qiangqiang,Email:zhangqq8@163.com
ObjectiveTo evaluate the feasibility to detectProtothecain a mouse model ofPrototheca zopfiicutaneous infection by using fluorescencein situhybridization(FISH).MethodsThe model ofPrototheca zopfiicutaneous infection was established by abdominal subcutaneous inoculation ofPrototheca zopfiisuspensions into 20 male BALB/c mice.Seven days after the inoculation,the mice were sacrificed,and tissue specimens were obtained from abdominal skin and subjected to microscopic examination,fungal culture and paraffin embedding.A PZ-probe was artificially synthesized and used to detectProtothecain paraffin-embedded sections by using FISH.Moreover,both periodic acid-Schiff(PAS)and hematoxylin-eosin(HE)staining were performed to examine the paraffinembedded sections.Skin specimens obtained from normal mice andCandida albicans-orCryptococcus neoformansinfected mice served as the negative control.ResultsClinical presentations,pathological examination and fungal culture results all confirmed the successful establishment ofPrototheca zopfiiskin infection model in mice.Protothecawas identified by FISH with the PZ-probe in the paraffin-embedded skin tissue sections from the murine model ofPrototheca zopfiicutaneous infection,but not detected in the negative control tissue specimens,which was consistent with the results of PAS and HE staining.ConclusionFISH can be used to detectProtothecain paraffinembedded skin sections from the mouse model ofPrototheca zopfiicutaneous infection.
Prototheca;Skin;In situhybridization,fluorescence;Mice
10.3760/cma.j.issn.0412-4030.2014.09.010
200040上海,复旦大学附属华山医院皮肤科
章强强,Email:zhangqq8@163.com
