ZFX在小细胞肺癌组织中的表达及临床意义
2014-12-06苏文媚武奋萍罗亮许贝杨志雄赖振南
苏文媚 武奋萍 罗亮 许贝 杨志雄 赖振南
广东医学院附属医院肿瘤中心,广东 湛江 524000
小细胞肺癌(small cell lung cancer,SCLC)是一种以生长迅速、早期转移、高度侵袭性为特点的肺癌类型,其发病率约占原发性肺癌的15%~20%[1-2]。SCLC的肿瘤细胞对化疗和放疗都非常敏感,但几十年来多方案的临床试验并没能找到彻底治愈SCLC的有效方法,多数患者在一线治疗以后仍会复发或转移,临床预后 差[3-4]。X染色体耦联锌指蛋白(zinc finger protein X-linked,ZFX)是锌指蛋白家族中的一员,其含有13个C2H2的锌指结构。ZFX基因位于哺乳动物的X染色体上,其表达在哺乳动物中呈高度保守性,其结构包含一个酸性转录激活区、一个核定位序列及一个DNA结合位点[5]。早期研究认为ZFX基因与哺乳动物的性别决定有关,目前研究发现ZFX基因在多种类型的干细胞和肿瘤细胞中表达增高[6],其与肿瘤的关系已经成为国内外普遍关注的热点。在肿瘤学研究中已经发现ZFX在前列腺癌、乳腺癌、白血病等人常见恶性肿瘤中出现异常表达[7-9]。然而关于ZFX在SCLC中的作用目前国内外尚未见相关 报道。
1 材料和方法
1.1 一般资料
收集2008年1月—2013年8月在广东医学院附属医院肿瘤中心行手术切除或支气管镜活检的SCLC组织标本98例,选择资料完整的SCLC患者78例进行研究,其中男性36例,女性42例;患者年龄30~82岁,中位年龄53岁,53岁以下患者43例,53岁以上患者35例;广泛期43例,局限期35例;化疗敏感者(化疗5~6个周期后肿瘤完全缓解或部分缓解)35例,化疗耐药者(化疗5~6个周期后疾病稳定或进展者)43例,组织标本放入液氮冷冻后,用锡纸包裹,在研钵中充分研磨,研磨后用TRIzol反复洗涤研磨的碎末,用经DEPC水处理后的冻存管收集,放入液氮,用时提取RNA进行检测。所有患者术前均未行放化疗,临床资料完整,患者未并发其他系统疾病。所有患者均经过病理学检查确诊为SCLC,78例患者均接受EP方案化疗。本研究经本院伦理委员会批准,所有患者均签署知情同意书。全部78例患者出院后均随访,随访方式为电话和门诊随访,随访内容包括一般情况、临床症状和影像学检查。随访起点为病理确诊日期,末次随访时间为2013年8月31日,截止随访终止时,存活患者22例(21.74%),死亡患者56例(78.26%),无失访患者。
1.2 总RNA的提取及实时荧光定量PCR
按照试剂说明书,通过TRIzol提取试剂盒从SCLC组织标本中提取总RNA;测量总RNA浓度,取1 μg RNA按逆转录合成试剂盒说明合成cDNA,然后以该cDNA为模板,PCR仪中扩增从SCLC组织标本中提取的总RNA进行逆转录和实时荧光定量PCR。ZFX及内参照GAPDH的引物序列见表1。逆转录反应及PCR扩增参照试剂盒说明进行,以ZFX基因的上下游引物进行PCR扩增,PCR反应在实时定量PCR反应仪上进行;3次独立实验后得到的数据运用公式RQ=2-∆∆Ct的方法进行分析。ΔΔCt=(待测样品的目的基因的Ct的平均值-待测样本的管家基因的Ct的平均值)-(对照样品的目的基因的Ct的平均值-对照样本的管家基因的Ct的平均值)。
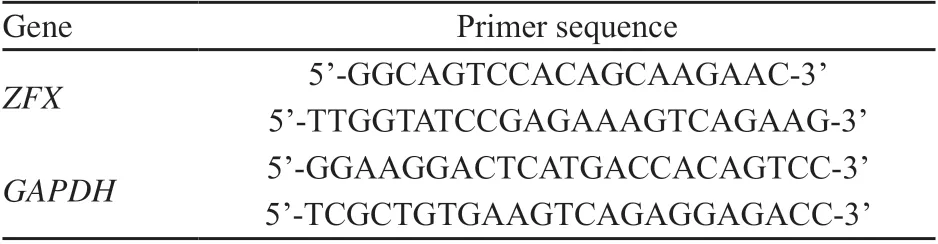
表1 ZFX及内参照GAPDH的引物序列Tab. 1 The primer sequence of ZFX and GAPDH
1.3 统计学处理
采用SPSS 13.0统计学软件进行数据分析。ZFX在小细胞肺癌组织中的表达差异采取t检验进行分析,ZFX的表达与各临床病理参数之间的关系使用Chi-Square检验;采用Kaplan-Meier法分析ZFX的表达与生存期的关系,P<0.05为差异有统计学意义。
2 结 果
2.1 ZFX基因在SCLC组织中的表达
实时荧光定量PCR法检测ZFX基因在SCLC组织(SCLC局限期患者组织标本和广泛期组织标本)中的表达,结果提示ZFX基因在SCLC局限期组织标本中的表达水平较广泛期患者明显降低,差异有统计学意义(P<0.001,图1)。
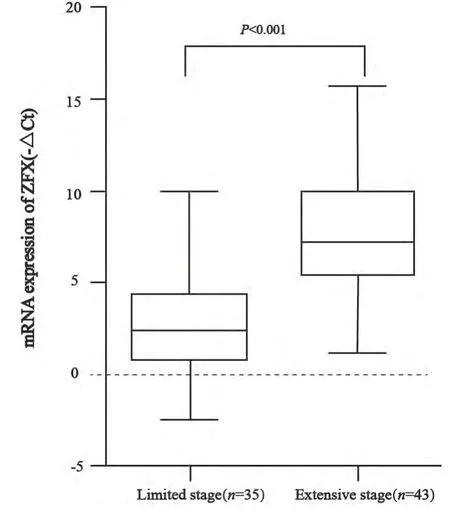
图1 实时荧光定量PCR检测ZFX基因在SCLC局限期和广泛期组织标本中的差异表达Fig. 1 The differential expression of ZFX gene was presented in the limited stage tissues and extensive stage SCLC tissues by QRT-PCR
2.2 ZFX蛋白在SCLC组织中的表达及其与临床病理特征的关系
ZFX的表达与患者的性别无关,差异无统计学意义(χ2=0.179,P=0.672)。ZFX的表达与患者的年龄无关,差异无统计学意义(χ2=2.474,P=1.116)。ZFX在局限期患者中的表达较广泛期患者低,两者的ZFX表达率差异有统计学意义(χ2=20.539,P<0.001)。ZFX在化疗敏感患者中的表达较耐药患者低,差异有统计学意义(χ2=15.84,P<0.001)。ZFX在存活患者中的表达较死亡患者低,差异有统计学意义 (χ2=18.022,P<0.001,表2)。
2.3 SCLC患者生存分析
采用Kaplan-Meier法估计患者生存时间,结果发现患者的生存时间与性别和年龄无相关性,差异无统计学意义(P>0.05);疾病的分期、患者对化疗的敏感性及ZFX的表达与患者的生存时间相关。对化疗敏感者的生存时间长于耐药患者,差异有统计学意义(χ2=4.585,P=0.032,图2A);局限期患者的生存时间长于广泛期患者,差异有统计学意义(χ2=9.921,P=0.002,图2B);ZFX低表达患者的生存时间长于高表达患者,差异有统计学意义 (χ2=19.841,P=0.000,图2C)。

表2 ZFX的阳性表达与患者临床病理特征的关系Tab. 2 Association of ZFX with clinicopathological parameters
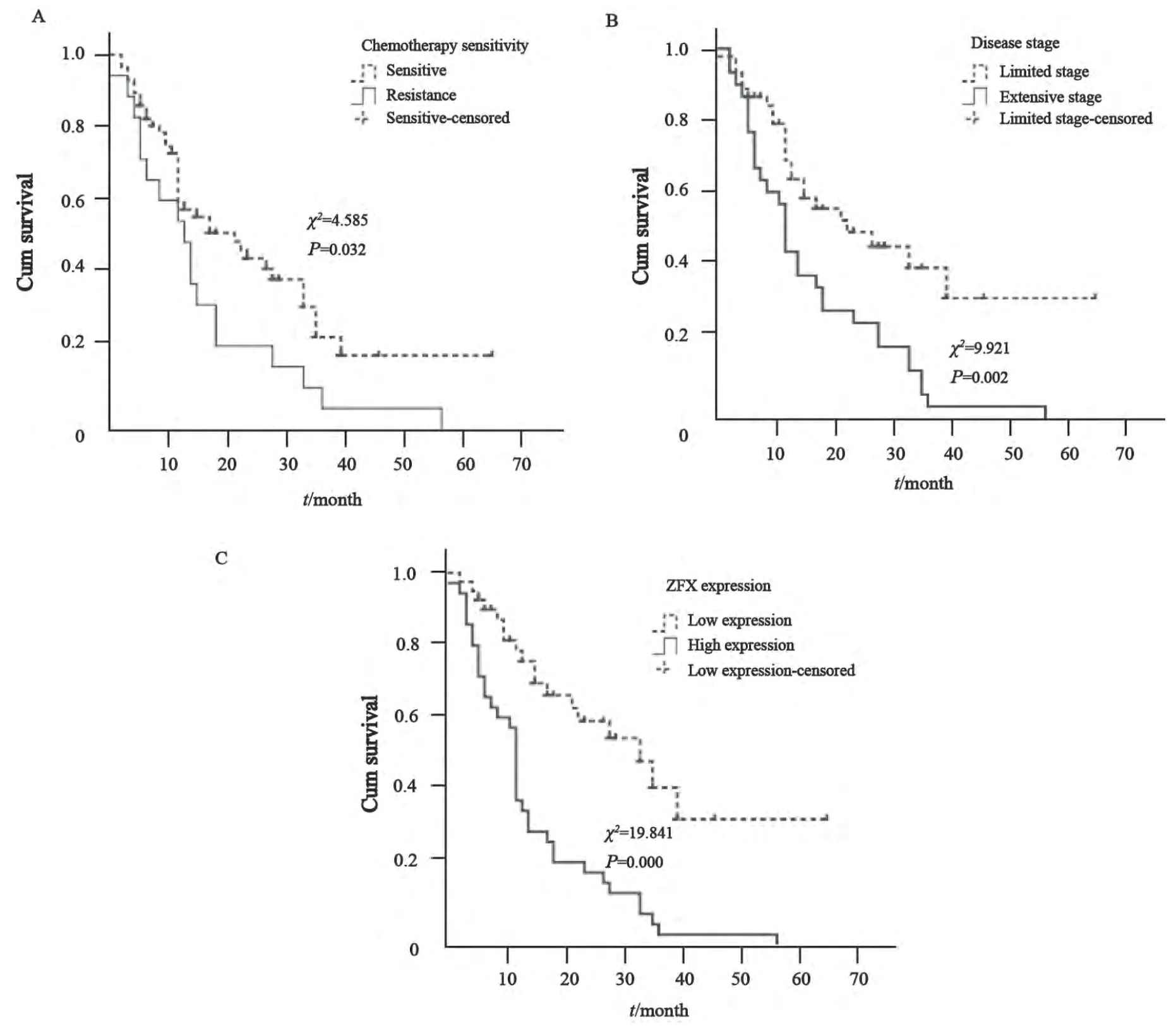
图2 Kaplan-Meier法估计患者生存时间Fig. 2 Survival times was evaluated by Kaplan-Meier assay
3 讨 论
肺癌是当今世界对人类健康危害最大的恶性肿瘤之一,我国肺癌发病率增长迅速,多数学者把更多的研究目光集中在非小细胞肺癌(non-small cell lung cancer,NSCLC)治疗上,而SCLC的发病率却悄然增长,由于研究的关注度和力度明显不及前者,多年来治疗无明显突 破[10-11]。SCLC的治疗以全身化疗为主,联合放疗和手术为主要治疗手段。目前临床上化疗一般采取顺铂为基础的两药联合治疗方案,尽管SCLC患者对化疗敏感,但很快出现的多药耐药现象导致化疗失败,极易复发[12]。复发后对任何细胞毒药物均无作用。因此,如何克服SCLC的耐药性,成为临床上治疗SCLC及提高生活质量、延长生存时间的急需解决的重要 问题。
锌指蛋白是指含有短的稳定的能与Zn2+结合并自我折叠形成“手指”结构的一类蛋白质。由于其自身的结构特点,锌指蛋白可以选择性地结合特异的靶结构,在基因的表达调控、细胞分化、胚胎发育等生命过程中发挥重要作 用[13-14]。近年来Galan-Caridad等[15]报道ZFX是胚胎干细胞和成体干细胞自我更新的共同分子基础。Arenzana等[16]报道在B淋巴细胞中ZFX调控BCR介导的细胞增殖。研究者发现ZFX在胚胎干细胞和成体造血干细胞中高表达;ZFX基因敲除的胚胎干细胞和成体造血干细胞出现大量AnnexinⅤ阳性的凋亡细胞,而ZFX基因过表达的干细胞自我更新良好、生长迅速,且维持未分化状态。这表明ZFX蛋白在多种干细胞的自我更新和抗凋亡机制中起着重要作用。还有研究发现ZFX沉默并不影响Oct4、Sox2、Nanog等经典的干细胞自我更新通路[17]。然而关于ZFX蛋白在SCLC中的研究目前国内外尚未见相关报道。本研究通过发现ZFX基因在SCLC局限期组织标本中的表达较广泛期患者明显降低,且与患者的疾病分期、对化疗药物的敏感性及生存时间相关。然而影响SCLC临床预后的因素很多,本研究结果可能为基于ZFX研究SCLC治疗及预后的研究提供一定的理论基础和治疗靶点。
[1]CALIFANO R, ABIDIN A Z, ZPECK R, et al. Management of small cell lung cancer: recent developments for optimal care [J]. Drugs, 2012, 72(4): 471-490.
[2]KALEMKERIAN G P, AKERLEY W, BOQNER P, et al. Small cell lung cancer[J]. J Natl Compr Canc Netw, 2013, 11(1): 78-98.
[3]LOPEZ-CHAVEZ A, SANDLER A. Systemic issues in small cell lung cancer[J]. Curr Probl Cancer, 2012, 36(3): 131-155.
[4]METRO G, DURANTI S, FISCHER M J, et al. Emerging drugs for small cell lung cancer--an update[J]. Expert Opin Emerg Drugs, 2012, 17(1): 31-36.
[5]LAI W S, PERERA L, HICKS S N, et al. Mutational and structural analysis of the tandem zinc finger domain of tristetraprolin[J]. J Biol Chem, 2014, 289(1): 565-580.
[6]JIANG R, GAO Z L, SUN M, et al. Zinc finger X-chromosomal protein promotes growth and tumorigenesis in human osteosarcoma cells[J]. Pak J Med Sci, 2013, 29(4): 997-1002.
[7]DONG S, ZHANG P, LIANG S, et al. The role of the retinoblastoma protein-interacting zinc finger gene 1 tumor suppressor gene in human esophageal squamous cell carcinoma cells[J]. Oncol Lett, 2013, 6(6): 1656-1662.
[8]AHMED S, WANG A, CELIUS T, et al. Zinc finger nucleasemediated knockout of AHR or ARNT in human breast cancer cells abolishes basal and ligand-dependent regulation of CYP1B1 and differentially affects estrogen receptor alpha transactivation[J]. Toxicol Sci, 2014, 138(1): 89-103.
[9]HU R, WANG E, PENG G, et al. Zinc finger protein 668 interacts with Tip60 to promote H2AX acetylation after DNA damage[J]. Cell Cycle, 2013, 12(13): 2033-2041.
[10]LI D, ZHANG Y, XIE Y, et al. Enhanced tumor suppression by adenoviral PTEN gene therapy combined with cisplatin chemotherapy in small-cell lung cancer[J]. Cancer Gene Ther, 2013, 20(4): 251-259.
[11]OLSZEWSKI U, DEALLY A, TACKE M, et al. Alterations of phosphoproteins in NCI-H526 small cell lung cancer cells involved in cytotoxicity of cisplatin and titanocene Y[J]. Neoplasia, 2012, 14(9): 813-822.
[12]MICHAELSEN S R, CHRISTENSEN C L, SEHESTED M, et al. Single agent- and combination treatment with two targeted suicide gene therapy systems is effective in chemoresistant small cell lung cancer cells[J]. J Gene Med, 2012, 14(7): 445-458.
[13]CHANDRASEKHARAN S, KUMAR S, VALLEY C M, et al. Proprietary science, open science and the role of patent disclosure: the case of zinc-finger proteins[J]. Nat Biotechnol, 2009, 27(2): 140-144.
[14]SCHNIDAR H, EBERL M, KLINGLER S, et al. Epidermal growth factor receptor signaling synergizes with Hedgehog/GLI in oncogenic transformation via activation of the MEK/ERK/JUN pathway[J]. Cancer Res, 2009, 69(4): 1284-1292.
[15]GALAN-CARIDAD J M, HAREL S, ARENZANA T L, et al. Zfx controls the self-renewal of embryonic and hematopoietic stem cells[J]. Cell, 2007, 129(2): 345-357.
[16]ARENZANA T L, SMITH-RASKA M R, REIZIS B. Transcription factor Zfx controls BCR-induced proliferation and survival of B lymphocytes[J]. Blood, 2009, 113(23): 5857-5867.
[17]HU G, KIM J, XU Q, et al. A genome-wide RNAi screen identifies a new transcriptional module required for selfrenewal[J]. Genes Dev, 2009, 23(7): 837-848.
