骨髓间充质干细胞向角膜上皮细胞分化及其免疫调节作用
2014-12-06LiWenMeidongZhuConPetsoglou
Li Wen Meidong Zhu Con Petsoglou
角膜是位于眼前端的透明组织,由复层上皮,基质层和单层内皮组成。作为最前端的眼睛屈光介质,角膜发挥着非常重要的作用。角膜上皮是一种可以快速增生的复层上皮,它在维持眼表角膜的透明性和完整性方面发挥着关键作用。位于角膜缘基底部上皮中的角膜缘干细胞(limbal stem cells,LSCs)负责维持角膜上皮细胞的再生[1-2]。除了更新角膜上皮,LSCs也是介于结膜上皮与角膜上皮之间的屏障,防止前者向后者的移行[3]。
角膜缘干细胞缺乏症(LSC deficiency,LSCD)是一种以LSCs功能缺失或数目减少为特征的疾病。这种疾病有多种诱因,包括化学或者热灼伤,佩戴角膜接触镜诱导的眼表疾病,遗传性(如无虹膜和外胚层发育不良症),医源性因素(如放射线疗法和冷冻疗法)和炎症眼部疾病(如多形性红斑和眼瘢痕性类天疱疮)[4]。在LSCD中,结膜上皮和其下的血管会生长到角膜表面从而导致视觉障碍,甚至失明。此外,被破坏的角膜上皮将失去自愈能力,从而导致持续的上皮糜烂和缺失,患者会出现慢性疼痛和畏光的症状[4]。
角膜缘移植是治疗LSCD的最有效方法[5]。该技术需要移植大片健康的角膜缘,其来源包括患者的另一只健康眼球(自体移植)或活体和死者捐献的眼球(异体移植)。但每种手术都有很大的局限性。在自体移植和活体来源异体移植手术中,由于可能产生医源性的LSCD风险导致可供移植的角膜缘组织量非常有限[3-4]。此外,无论从活体还是尸体捐献的异体组织都存在组织量有限和免疫排斥的问题。根据2012年的”澳大利亚角膜移植登记”报告,角膜缘移植1年的存活率为64﹪,5年的存活率只有43﹪[6]确凿证据表明,异体角膜缘移植的存活需要持续的全身免疫抑制[7],这种免疫抑制会导致患者其他疾病发病率升高及患者生活质量显著下降[8],因此,迫切需要研发一种替代物用于移植以取代损伤角膜组织。
间充质干细胞(mesenchymal stem cells,MSCs)被认为是一种可以自我更新的多潜能前体细胞,能够分化为多种间质细胞。MSCs可从骨髓中分离获得,并能在体内外培养和分化。骨髓来源的间充质干细胞(bone marrow-derived MSCs,BMMSCs)已被应用于不同器官和组织的移植。由于它们在组织再生方面的应用潜能,受到越来越多的关注[9-11]。已有研究表明,不同物种的BMMSCs都可以分化为上皮样细胞[12-15]。BMMSCs可以通过体内血管注射移植到受损的角膜,这些细胞可以通过分化,增殖以及与造血干细胞协作从而促进角膜伤口修复[14-15]。但是各实验室用于分离和分化BMMSCs的方法仍存在很大的差别。此外MSCs除具有转分化作用,还具有抗炎和抗新生血管的作用[16-18],研究证明MSCs移植治疗的机制可能同时包含抗炎和抗新生血管的作用[15,19]。将损伤的角膜上皮细胞与MSC共培养时,MSCs分泌可溶性因子具有免疫抑制和抗新生血管的作用[18]。
至今,BMMSC通过免疫调节作用修复损伤角膜的机制尚未阐明。本研究分离培养大鼠BMMSCs(rBMMSCs),并通过角膜上皮细胞的生长微环境诱导其分化为上皮样细胞。同时,联合应用IFN-γ和TNF-α模拟炎症微环境作用于共培养的rBMMSCs和角膜上皮细胞(human corneal epithelial cells,hCECs)模式以阐述rBMMSCs对炎症因子刺激的hCECs中ICAM-1的表达,以及对单核细胞黏附于hCECs能力的调控作用。
材料和方法
一、材料
1.试剂:胎牛血清(fetal bovine serum,FBS)、DMEM低糖培养基(DMEM/LG)、DMEM高糖培养基(DMEM/HG)、DMEM/F12培 养基、RPMI-1640培养基(RPMI-1640)、青霉素/链霉素、人表皮生长因子(EGF)和trypsin/EDTA均购于Gibco(Invitrogen,Australia,Pty Ltd.Sydney,Australia)组织培养的塑料皿购于(Nunc,Australia,Pty Ltd.)Ficoll-PaqueTM PLUS(Sigma-Aldrich,St.Louis,USA)。
2.抗体:本研究使用的抗体为异硫氰酸荧光素(FITC)标记的小鼠抗大鼠CD34、兔抗人和鼠ZO-1抗体 (Santa Cruz Biotechnology Inc.Sydney,NSW,Australia)、PE标记的仓鼠抗大鼠CD29、Alexa荧光素488标记的鼠抗人CD54(ICAM-1)抗体(Biolegend,Balcatta,Western Australia)、PE标记的仓鼠IgG(Biolegend)、FITC标记的小鼠IgG(Santa Cruz Biotechnology)、鼠抗角蛋白5&8抗体 (CK5&8)(Abcam,UK)、兔IgG(Amrad Biotech Pty.Ltd.,Melbourne,Australia)和鼠IgG(Zymed,Invitrogen)作为阴性对照,FITC标记的羊抗鼠二抗(Amrad Biotech Pty Ltd.,Australia)。Alexa荧光素594标记的羊抗鼠和Alexa荧光素488标记的羊抗兔等二抗(Molecular Probe,Australia)。所有用于流式细胞检测和免疫荧光染色的抗体均经过滴度测定。
二、方法
(一)组织培养
本研究经悉尼大学动物伦理委员会批准。实验中所有操作都遵循悉尼大学动物伦理委员会制定的实验动物操作规范。
1.MSC分离和培养:采用CO2处死3~6周龄的Vista大鼠。收集股骨和胫骨,去除骨骺暴露骨髓腔,采用10ml的注射器和添加了10﹪FBS及抗生素的DMEM/LG将骨髓内容物从股骨和胫骨的骨髓腔中冲出。用16、18或20 G的针头接在同一个10ml注射器上,通过不断的吹打将骨髓分散成单个细胞。将骨髓细胞小心转移到50ml离心管中15ml的Ficoll-PaqueTM液面上,18℃,800×g离心20min。收集界面层的细胞,用新鲜的DMEM/LG洗2次,4℃,400×g离心10min。细胞重悬于含15﹪FBS,50 U/ml青霉素/50 μg/ml链霉素和2mmol/L谷氨酰胺的DMEM/LG中。将5×106细胞接种到25 cm2的培养瓶中,5﹪ CO2,37℃培养。细胞贴壁2 d后进行换液,之后每周换液2次。细胞融合后用0.25﹪胰酶/0.1﹪EDTA消化传代,培养液改用含10﹪FBS。3-4代的细胞用于实验。
2.rBMMSC条件培养液制备:在培养融合后第1代细胞的25 cm2培养瓶中加入5ml含5﹪FBS,50 U/ml青霉素/50 μg/ml链霉素和2mmol/L谷氨酰胺的DMEM/LG的新鲜培养液,2 d后收集培养液,离心并保存于-80℃备用。
3.大鼠皮肤成纤维细胞分离培养:从大鼠身上获取皮肤组织,PBS洗2次,剪刀剪成碎块。用瓷研钵和研杵匀浆组织,用0.25﹪胰酶/0.1﹪EDTA,37℃,持续震荡消化20min。用含10﹪牛血清的培养液终止消化后,经70目滤器过滤。细胞重悬在含10﹪FBS,50 U/ml青霉素/50 μg/ml链霉素和2mmol/L谷氨酰胺的DMEM/LG培养液中培养,每周换液2次。细胞融合后用0.25﹪胰酶/0.1﹪EDTA消化传代,3-4代细胞作为阴性对照细胞用于实验。
4.永生化hCECs培养:实验用人SV40腺病毒载体转化的hCECs培养于含5﹪FBS、50 U/ml青霉素/50 μg/ml链霉素、2mmol/L谷氨酰胺和10 ng/ml EGF的DMEM/F12培养液中。细胞长满融合后用0.25﹪胰酶/0.1﹪ EDTA消化传代。
人白血病单核淋巴瘤细胞系U937细胞培养在含5﹪FBS、50 U/ml青霉素/50 μg/ml链霉素和2mmol/L谷氨酰胺的RPMI-1640培养液中。细胞按1:5比例,每周传代2次。
(二)诱导rBMMSCs分化
第二代rBMMSCs和表皮成纤维细胞重悬于含5﹪FBS、50 U/ml青霉素/50 μg/ml链霉素和2mmol/L谷氨酰胺的DMEM/LG的培养液并接种于6孔板。培养过夜后,更换含5﹪FBS、50 U/ml青霉素/50 μg/ml链霉素、2mmol/L谷氨酰胺和10 ng/ml EGF的DMEM/F12培养液。分别于培养5 d和3周后,采用流式细胞技术,免疫组化和Westernblot鉴定分化的细胞。
(三)rBMMSCs对hCECs的免疫调节作用
hCECs和rBMMSCs共培养:hCECs接种于6孔板中,MSC细胞接种到Transwell插入膜上(孔径 :0.45 μm,直径 24.5 mm,康宁公司,NY,USA),并置于6孔中培养的hCECs上面。
1.处理方案:处理方案共分为以下几组:(1) 未处理 hCECs;(2)hCECs培养 3 d 后用 INF-γ(100 U/ml)和TNF-α(100 U/ml)处理 24及 48h;(3)hCECs在hCEC培养液和rBMMSC条件培养液(1:1)中培养 3 d,再用 INF-γ(100 U/ml) 和TNF-α (100 U/ml)处理24及48h。培养结束后,采用流式细胞技术分析细胞表型变化。
2.黏附实验:hCECs接种在24孔板中(8×103/孔),用hCEC培养基或含rBMMSC条件培养基的细胞培养液培养3 d。含rBMMSC条件培养基的培养液为1:1hCEC培养基:rBMMSC条件培养基。3 d后分别更换新鲜培养液,并用INF-γ (100 U/ml) 和TNF-α(100 U/ml) 处理 6 h。采 用CM-Dil标 记U937细 胞1h(Molecular probes,Invitrogen)。PBS洗 3次,将U937细胞分别加入各孔中(5×104/孔),37℃孵育 1h。采用细胞培养液洗3次,继而PBS洗2次除去未结合的U937细胞。消化收集细胞并重悬于0.2ml培养基中。在倒置荧光显微镜计数U937细胞,3个复孔,实验重复2次。
(四)流式细胞检测
第3代rBMMSCs用胰酶消化收集。细胞用PE标记的抗CD29,或FITC标记的抗CD34,或同型对照抗体4℃孵育1h。PBS清洗细胞后用培养液重悬后用于流式细胞分析。或采用2﹪冷多聚甲醛固定细胞15min,PBS洗2次,0.4﹪皂素重悬细胞,10min后离心,细胞用抗CD29和抗CK5&8抗体或同型对照抗体4℃孵育1h。PBS清洗细胞2次,用FITC标记的抗小鼠抗体4℃孵育1h。PBS清洗细胞后,重悬后用于流式细胞仪(Becton Dickinson,Sydney,Australia)分析。每个样品分析位于同一区域的104个细胞。用CELLQUEST程序(Becton Dickinson)进行数据分析,结果以直方图、散点图或条形图表示。
(五)免疫荧光
将rBMMSCs接种到48孔培养板中(5×103/孔),培养细胞用2﹪多聚甲醛4℃固定,PBS清洗10min,并在10﹪驴血清/0.4﹪皂苷/PBS中封闭15min,然后用抗CD29,抗CD34抗体,抗CK5&8和抗ZO-1抗体4℃孵育过夜。小鼠或兔IgG作为阴性对照。PBS清洗3次,细胞同荧光素488标记的羊抗兔或荧光素594标记的山羊抗小鼠二抗室温孵育1h。用Hoechest33342(Sigma)共染细胞,倒置荧光显微镜下进行观察。
(六)Western blot 检测CK5&8的表达
rBMMSCs、hCECs和大鼠皮肤成纤维细胞生长达融合后,经预冷的PBS清洗2次,加入含有蛋白酶抑制剂的预冷裂解液裂解,采用Bradford法进行蛋白定量。样品上样(15 μg/孔),进行10﹪的SDS-聚丙烯酰胺凝胶电泳,蛋白转移到PVDF(Invitrogen)膜上,用封闭液(Santa Cruz)室温封闭30min,抗CK5&8的抗体4℃孵育过夜,洗膜后,同HRP标记的羊抗鼠二抗(Millipore,MA USA)室温孵育2h,用化学发光法进行信号检测。膜结合的抗体用洗脱液(Thermo Scientific)除去后与鼠源抗GAPDH抗体(Hytest Ltd.Finland)孵育作为内参。
三、统计学分析方法
数据用GraphPad Prism 5(GraphPad Software,La Jolla,CA,USA)软件分析,各组数据均采用表示,多组间比较采用带有Tukey’s多重比较的单因素方差分析(ANOVA),两组间比较采用双侧t检验,以P < 0.05为差异有统计学意义。
结 果
一、大鼠rBMMSCs的形态和免疫表型
本研究首先建立了从大鼠骨髓中分离rBMMSCs的方法。rBMMSCs分离培养72h后进行首次换液,大多数不贴壁的细胞通过换液去除,接种培养5 d后,可见许多贴壁的成纤维样的细胞(图1a)。这些细胞呈现纺锤形,14 d后达到融合生长(图1b)。流式细胞仪检测结果显示这些细胞呈CD29阳性表达,阳性率达95﹪(图2a),CD34呈阴性表达(图2b)。免疫荧光染色进一步确定rBMMSCs阳性表达CD29,阴性表达CD34(图 2c、d)。
二、鼠rBMMSCs向上皮样细胞分化
本研究采用角膜上皮细胞生长培养基诱导rBMMSCs分化,培养5 d后,出现一些上皮细胞样的小岛,这些小岛呈现典型的鹅卵石样(图3a),流式细胞仪检测结果显示,这些类似于上皮细胞样的小岛中大约有4﹪的细胞表达上皮细胞的表面标记抗原CK5&8(图3b、c),CK5&8阳性细胞不表达CD29,证明rBMMSCs往上皮样细胞分化过程中,细胞的免疫表型发生了改变。然而在相同的培养条件下,大鼠皮肤成纤维细胞中并未检测到CK5&8阳性表达的细胞(图3d、e)。
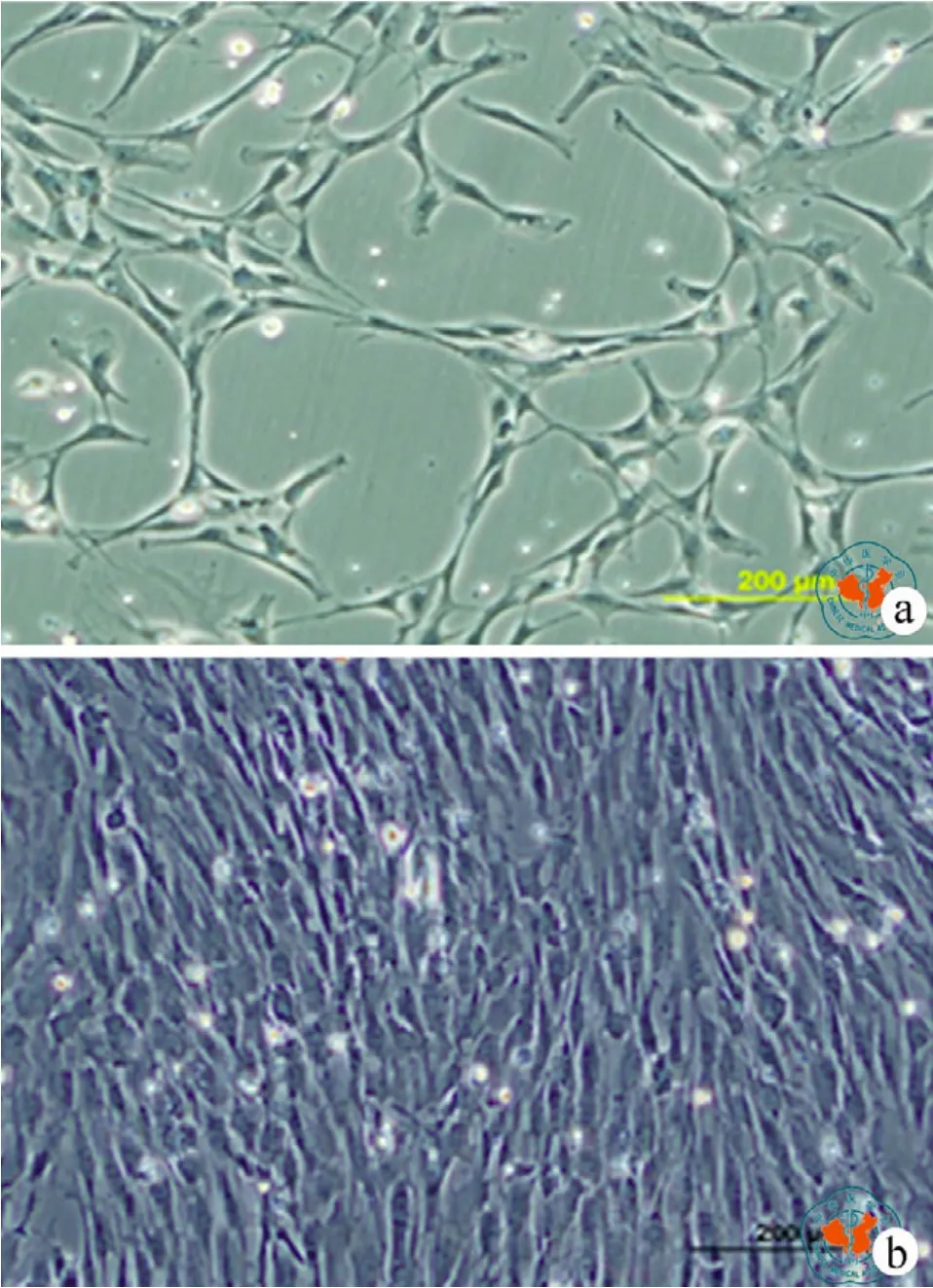
图1 倒置位相光学显微镜下观察rBMMSCs的分离培养
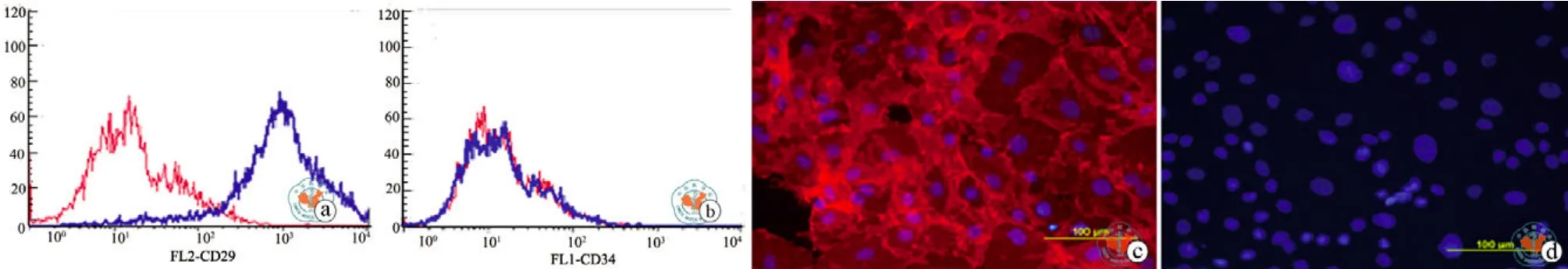
图2 流式细胞和免疫荧光分析rBMMSCs的表型
培养3周后,上皮样的小岛长大,并且融合在一起形成大面积的具有鹅卵石样的单层细胞结构(图4a、b)。双色免疫荧光染色显示分化的rBMMSCs中,细胞膜上高度表达ZO-1的细胞同时胞质中也高度表达CK5&8 (图4c、d、e)。而培养皿中形态上仍然保持纺锤样的细胞,CK5&8和ZO-1都呈阴性表达(图4c)。
Western blot进一步确定rBMMSCs分化来的上皮样细胞中CK5&8的表达。定量分析结果显示,分化的rBMMSCs同hCECs相比,CK5&8蛋白表达没有显著性的差异(其值分别为191.6﹪±16.8﹪,226.7﹪±37.6﹪,P=0.443),然而在相同分化培养条件下培养的大鼠皮肤成纤维细胞几乎检测不到CK5&8的表达(6.3﹪±2.0﹪),明显低于CK5&8在hCECs(226.7﹪±37.6﹪,P=0.0043)和分化的rBMMSCs中的表达(P < 0.01)(图5)。

图3 rBMMSCs体外分化5 d 情况
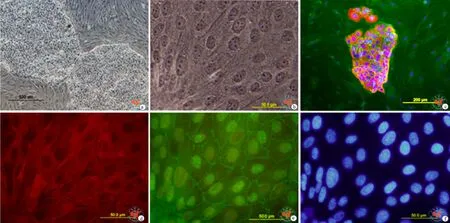
图4 rBMMSCs体外分化3周

图5 Western blot 检测CK5&8的表达结果
三、rBMMSCs对细胞因子刺激的hCECs的调节作用
流式细胞分析结果显示:hCECs恒定性的表 达 ICAM-1。IFN-γ(100 U/ml) 和TNF-α(100 U/ml)刺激24 h后,ICAM-1的表达升高到达最大值,同未处理对照组相比,升高了10倍达到4524±554.2(P=0.0025)。处 理 48h 后 有 所下降,和未处理对照组相比,升高了8倍达到3107±329.6(P=0.0014)。然 而,rBMMSC 条件培养液能够在24 h和48h显著降低ICAM-1的上调表达 [P=0.0249 (24h),0.0184 (48h)],且当hCECs和rBMMSCs共培养时,rBMMSCs对ICAM-1表达的抑制更显著,均值为1356±326(24 h),1323±107(48h) [P=0.0079 (24 h),0.0024(48h)](图 6)。
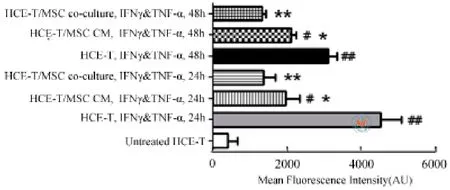
图6 rBMMSCs对ICAM-1表达的调节作用
黏附结果显示,和未处理对照组相比,IFN-γ和TNF-α共同刺激能够显著的增强U937单核细胞对hCEC的黏附力,然而,当hCECs在rBMMSC条件培养液中培养3d后,被炎症因子刺激后升高的U937单核细胞的黏附能力被完全终止,黏附细胞数从IFN-γ和TNF-α刺激后的 (10.01±3.01)×103/ml细胞降至 (2.21±0.19)×103/ml 细胞 (P=0.0271,图 7)。
讨 论
由于BMMSCs在分化潜能方面显示出非常强的可塑性,所以它是一种非常适合用于治疗的细胞资源。BMMSCs和其他器官来源的干细胞相比具有很多优点:好鉴定,易分离,并且注射后经血液可到达全身其他组织,相比之下更适合于细胞治疗[20-21]。

图7 rBMMSCs 对 hCECs 黏附 U937 细胞的调节作用
已经有报道表明BMMSCs在经过体内注射或体外培养后能够分化成各种类型的上皮细胞。据报道,BMMSCs能够分化为II型肺泡上皮细胞[22]、皮肤上皮细胞、皮脂腺导管细胞[23]、视网膜色素上皮细胞[24]、角膜细胞[25]和角膜上皮样细胞[13,26]。本研究成功分离培养了rBMMSCs,细胞阳性表达CD29,阳性率为95﹪,该结果和Gu从兔子中分离得到的BMMSCs非常相似,其得到的细胞CD29的阳性率为97.5﹪,但是比Jiang从大鼠中分离得到的BMMSCs的CD29阳性率(81.56﹪)更高。
干细胞的命运受内源性和外源性信号的调节,外源性信号组成干细胞调控的微环境,主要包括:分泌的因子,介导细胞间相互作的膜整合蛋白,细胞外基质[27]。诱导MSCs分化成角膜上皮样细胞的方法有很多种,这些方法通常是采用不同的角膜上皮相邻细胞培养的上清液作为条件培养基[27-28],或是通过与其他细胞共培养这两种方式来提供外源调控信号[13]。和以往研究不同的是,本研究使用了一种简单的角膜上皮细胞生长培养液,这种培养液血清含量较低,不涉及到角膜上皮相邻细胞,而且同样可以用于诱导MSCs往上皮样细胞分化。培养5 d后得到了CK5&8阳性的细胞,而且分化效率达到4﹪,分化效率与其他研究结果相似[13,26]。大鼠成纤维细胞以同样方法分化培养后,未检测到CK5&8阳性细胞。表明同样的培养条件下表皮成纤维细胞不能被诱导分化为上皮样细胞。本研究所用的培养条件因避免了rBMMSCs与角膜细胞产生接触性的相互作用,因而推断由角膜上皮细胞或rBMMSCs本身分泌的细胞因子作用于rBMMSCs,可能主要激活rBMMSCs内源性信号通路,从而调节rBMMSCs分化,表明内源性的调节信号也很重要。
BMMSCs的治疗作用主要是通过细胞分化、免疫调节以及产生营养和生长因子作用于组织中的细胞。这些特点使其具备治疗眼表病变和重塑眼睛角膜的潜能[29-30]。干细胞不仅可通过转分化在角膜创伤愈合和上皮再生过程中发挥重要的作用[13-14,26],其潜在的抗炎作用也逐渐受到更多的关注[15-19,31-32]。细胞黏附对细胞迁移是至关重要的,组织损伤的初始步骤是炎症细胞浸润到损伤部位,该过程依赖于黏附分子之间的相互作用,例如上皮细胞表面的ICAM-1[33]。ICAM-1属于定位在淋巴细胞和单核细胞表面的免疫球蛋白超家族成员[3],是β2-整合素(CD11/18)和Mac-1的配体。Mac-1在骨髓细胞和单核细胞中表达,促进中性粒细胞和单核细胞黏附到表达ICAM-1的细胞表面,并促进其在细胞表面的伸展[34-35]。IFN-γ/TNF-α 可 刺 激 hCECs 明 显 提 高 表 达ICAM-1,并显著增加单核细胞黏附到hCECs单层细胞上。然而同rBMMSCs共培养或使用rBMMSCs条件培养基可阻断这一效应。该结果同以往研究MSCs同肺内皮细胞[36]或人脐带内皮细胞[37]共培养时也可抑制ICAM-1表达相一致。本研究首次证实BMMSCs抑制ICAM-1在角膜上皮上的表达。虽然BMMSCs对白细胞及上皮细胞表面ICAM-1表达的调控作用机制仍不十分清楚,但MSCs有可能同时调节损伤部位白细胞之间以及白细胞对组织细胞如上皮细胞的黏附作用[38]。
单核细胞是巨噬细胞和树突状细胞的前体,受微环境以及分化刺激信号调节,这几种细胞表型可以相互转换。在体内,单核细胞可转变成抗原提呈细胞或清道夫巨噬细胞。MSCs除可影响细胞黏附外,还可以体外抑制异源性细胞引起的T细胞增殖,从而介导系统性免疫抑制作用[39]。本研究结果显示BMMSCs能够抑制IFN-γ/TNF-α刺激后单核细胞对hCEC的黏附作用,从而进一步证实BMMSCs的免疫抑制作用。
本研究探讨异种rBMMSCs对hCECs的免疫调节作用。结果证实rBMMSCs能影响不同物种的靶细胞的抗炎作用。活体研究异种MSCs对角膜损伤的修复功能也支持这一观点[15]。然而,以往的研究是把人BMMSC用于动物模型,笔者是将大鼠BMMSC作用于人角膜上皮细胞。
BMMSCs通过调节炎症因子修复损伤角膜的保护机制尚不清楚。同终末分化的细胞相比,MSCs突出的优势是它们的可塑性,以及在不同刺激下可以产生合适的微环境以利于细胞分化生长。实际上,免疫系统的发育同间充质组织密切相关,相互之间可在多个水平上发生相互作用。不可否认,上皮样细胞和免疫细胞的分化均需要一个特殊的微环境[40]。正如Anderson所讲述[41],细胞正常的功能同它们在培养条件下或移植到新的环境中所发挥的功能有很大的差异。然而,从细胞治疗的角度出发,细胞能发挥的功能可能更重要。在大多数报道中,供体细胞发生分化,其分化表型可通过形态或免疫染色确定,但往往不能从功能上进行验证。因此,供体细胞可能只获得了新细胞类型的很少的一部分特征,但是不具备新的功能。因而,有必要对分化细胞的功能进一步验证。
本研究可获得原代培养的纯度较高的rBMMSCs。这些细胞有分化为角膜上皮样细胞的潜能。促炎细胞因子可诱导hCECs细胞表达黏附分子,rBMMSCs可抑制这一诱导作用,并可阻断促炎性因子诱导的单核细胞对hCEC黏附的作用。本研究开启了角膜组织工程利用MSCs治疗角膜疾病比如LSCD的可能性。BMMSCs的免疫调节作用可能为角膜上皮再生提供更有利的微环境,表明BMMSCs在角膜损伤修复和再生过程中的治疗潜能。
1 Schermer A,Galvin S,Sun TT.Differentiation-related expression of a major 64K corneal keratin in vivo and in culture suggests limbal location of corneal epithelial stem cells[J].J Cell Biol,1986,103(1):49-62.
2 Ahmad S,Figuelredo F,Lako M,et al.Corneal epithelial stem cells: charisterization,culture and transplantation[J].Regen Med,2008,1(1):29-44.
3 Chen JJ,Tseng SC.Abnormal corneal epithelial wound healing in partial-thickness removal of limbal epithelium[J].Invest Ophthalmol Vis Sci,1991,32(8):2219-2233.
4 Kolli S,Lako M,Figueiredo F,et al.Loss of corneal epithelial stem cell properties in outgrowths from human limbal explants cultured on intact amniotic membrane[J].Regenerative Medicine,2008,3(3):329-342.
5 Kenyon KR,Tseng SC.Limbal autograft transplantation for ocular surface disorders[J].Ophthalmology,1989,96(5):709-722; discussion 722-723.
6 Williams KA,MT Lowe MT,Keane MC,et al.Australian Corneal Graft Registry Report 2012.Snap Printing,Adelaide,2012.
7 Holland EJ,Djalilian AR,Schwartz GS.Management of aniridic keratopathy with keratolimbal allograft: a limbal stem cell transplantation technique[J].Ophthalmology,2003,110(1):125-130.
8 Jabs DA,Rosenbaum JT,Foster CS,et al.Guidelines for the use of immunosuppressive drugs in patients with ocular inflammatory disorders: recommendations of an expert panel[J].Am J Ophthalmol,2000,130(4):492-513.
9 Tuli R,Seghatoleslami MR,Tuli S,et al.A simple,highyield method for obtaining multipotential mesenchymal progenitor cells from trabecular bone[J].Mol Biotechnol,2003,23(1):37-49.
10 Jiang Y,Vaessen B,Lenvik T,et al.Multipotent progenitor cells can be isolated from postnatal murine bone marrow,muscle,and brain[J].Exp Hematol,2002,30(8):896-904.
11 Prockop DJ.Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276(5309):71-74.
12 Shu C,Li TY,Tsang LL,et al.Differentiation of adult rat bone marrow stem cells into epithelial progenitor cells in culture[J].Cell Biology International,2006,30(10):823-882.
13 Jiang TS,Cai L,Ji WY,et al.Reconstruction of the corneal epithelium with induced marrow mesenchymal stem cells in rats[J].Molecular Vision,2010,16:1304-1316.
14 Ye J,Yao K,Kim JC.Mesenchymal stem cell transplantation in a rabbit corneal alkali burn model:engraftment and involvement in wound healing[J].Eye,2006,20(4):482-490.
15 Ma Y,Xu Y,Xiao Z,et al.Reconstruction of chemically burned rat corneal surface by bone marrow-derived human mesenchymal stem cells[J].Stem Cells,2006,24(2):315-321.
16 Oh JY,Kim MK,Shin MS,et al.The anti-inflammatory and anti-angiogenic role of mesenchymal stem cells in corneal wound healing following chemical injury[J].Stem Cells,2008,26(4):1047-1055.
17 Roddy GW,Oh JY,Lee RH,et al.Action at a distance:systemically administered adult stem/progenitor cells(MSCs) reduce in flammatory damage to the cornea without engraftment and primarily by secretion of TNF-alpha stimulated gene/protein 6[J].Stem Cells,2011,29(10):1572-1579.
18 Oh JY,Kim MK,Shin MS,et al.Cytokine secretion by human mesenchymal stem cells cocultured with damaged corneal epithelial cells[J].Cytokine,2009,46(1):100-103.
19 Holan V,Pokorna K,Prochazkova J,et al.Immunoregulatory properties of mouse limbal stem cells[J].J Immunol,2010,184(4):2124-2129.
20 Catacchio I,Berardi S,Reale A,et al.Evidence for bone marrow adult stem cell plasticity: properties,molecular mechanisms,negative aspects,clinical applications of hematopoietic and mesenchymal stem cells transdifferentiation[J].Stem Cells Int,2013,2013:1-11N.
21 Graf T.Differentiation plasticity of hematopoietic cells[J].Blood,2002,99(9):3089-3101.
22 Ma H,Gai J,Mei et al.Bone marrow mesenchymal stem cells can differentiate into type II alveolar epithelial cells in vitro[J].Cell Biol Int,2011,35(12):1261-1266.
23 Fu X,Fang L,Li X,et al,Enhanced wound-healing quality with bone marrow mesenchymal stem cells autografting after skin injury[J].Wound Repair Regen.2006,14(3):325-335.
24 Huang C,Zhang J,Ao M,et al.Combination of retinal pigment epithelium cell-conditioned medium and photoreceptor outer segments stimulate mesenchymal stem cell differentiation toward a functional retinal pigment epitheliumcell phenotype[J].J Cell Biochem,2012,113(2):590-598.
25 Liu H,Zhang J,Liu CY,et al,Bone marrow mesenchymal stem cells can differentiate and assume corneal keratocyte phenotype[J].J Cell Mol Med,2012,16(5):1114-1124.
26 Gu S,Xing C,Han J,et al.Differentiation of rabbit bone marrow mesenchymal stem cells into corneal epithelial cells in vivo and ex vivo[J].Mol Vis,2009,15:99-107.
27 Watt FM,Hogan B.Out of eden: stem cells and their niches[J].Science,2000,287(5457):1427-1430.
28 Holan V,Javorkova E.Mesenchymal Stem Cells,Nanofiber Scaffolds and Ocular Surface Reconstruction[J].Stem Cell Rev,2013,9(5):609-619.
29 Casaroli-Marano RP,Nieto-Nicolau N,Martínez-Conesa EM.Progenitor cells for ocular surface regenerative therapy[J].Ophthalmic Res,2012,49(3):115-121.
30 Otto WR,Wright NA.Mesenchymal stem cells: from experiment to clinic[J].Fibrogenesis Tissue Repair,2011,4:20.
31 Carrero R,Cerrada I,Lledó E,et al.IL1β Induces Mesenchymal Stem Cells Migration and Leucocyte chemotaxis through NF-κB[J].Stem Cell Rev.2012,8(3):905-916.
32 Trosan P,Svobodova E,Chudickova M,et al.The key role of insulin-like growth factor I in limbal stem cell differentiation and corneal wound healing process[J].Stem Cells Dev,2012,21(18):3341-3350.
33 Zhang F,Wang C,Wang H,et al.Ox-LDL promotes migration and adhesion of bone marrow-derived mesenchymal stem cells via regulation of MCP-1 expression[J].Mediators In flamm.2013,2013:691023.
34 Beekhuizen H,van Furth R.Monocyte adherence to human vascular endothelium[J].J Leukoc Biol,1993,54(4):363-378.
35 Von Andrian UH,Chambers JD,McEvoy LM,et al.Two-step model of leukocyte-endothelial cell interaction in inflammation: distinct roles for LECAM-1 and the leukocyte b2-integrins in vivo[J].Proc Natl Acad Sci USA,1991,88(17):7538-7542.
36 Pati S,Gerber MH,Menge TD et al.Bone marrow derived mesenchymal stem cells inhibit in flammation and preserve vascular endothelial integrity in the lungs after hemorrhagic shock[J].PLoS One,2011,6(9):1-14.
37 Luu NT,McGettrick HM,Buckley CD,et al.Crosstalk between mesenchymal stem sells and endothelial cells leads to down-regulation of cytokine-induced leukocyte recruitment[J].Stem Cells.2013,31(12):2690-2702.
38 Meisel SR,Shapiro H,Radnay J,et al.Increased expression of neutrophil and monocyte adhesion molecules lfa-1 and mac-1 and their ligand icam-1 and vla-4 throughout the acute phase of myocardial infarctionpossible implications for leukocyte aggregation and microvascular plugging [J].JACC,1998,31(1):120-125.
39 Di Nicola M,Carlo-Stella C,Magni M,et al.Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli[J].Blood,2002,99(10):3838-3843.
40 Jiang X,Zhang Y,Liu B,et al.Human mesenchymal stem cells inhibit differentiation and function of monocytederived dendritic cells[J].Blood,2005,105(10):4120-4126.
41 Anderson DJ.Stem cells and pattern formation in the nervous system: the possible versus the actual[J].Neuron,2001,30(1):19-35.
