荧光法研究3,5-二溴水杨醛缩4-溴苯胺铜配合物与DNA的作用机理
2014-12-03
(怀化学院 化学与化学工程系,湖南 怀化 418000)
因Schiff 碱及其配合物具有抗癌、抗肿瘤、抗菌、载氧和抑制超氧阴离子自由基活性等生物活性作用,而其配合物因具有更强的脂溶性和细胞穿透性,且不易产生耐药性,拥有更好的医药价值[1-5].铜元素是一种许多生物酶都需要依靠的反应来激发其活性的重要生物元素,从而完成它在生物体中对新陈代谢过程的催化作用,因而铜的配合物的制备与其生物活性的研究成为一个广泛的热点领域[6,7].另外溴酚类化合物具有降血糖、抗菌、抗氧化和抗肿瘤等生物活性,近年来引起了药物研究人员的重视[8,9].笔者以溴酚类化合物3,5-二溴水杨醛,参照文献[10]合成了3,5-二溴水杨醛缩4-溴苯胺Schiff 碱,并制备了结构式图1的二价铜的配合物,本文采用荧光光谱法对该配合物与DNA的相互作用的机理进行了研究.

图1 3,5-二溴水杨醛缩4-溴苯胺铜配合物的结构式
1 实验部分
1.1 试药与仪器
三羟甲基氨基甲烷(Tris)(BR,含量≥99.9%),鱼精DNA (BR,含量≥99.9%),溴化乙锭 (EB)(BR,含量≥98.0%),pHS-2C 数字酸度计(杭州万达仪器仪表厂),RF-5301PC 荧光分光光度计(日本津岛公司),其它试剂均为分析纯,实验用水为二次蒸馏水.
1.2 缓冲溶液配制
缓冲溶液用二次蒸馏水配制,含有5 ×10-3mol/L Tris,5 ×10-2mol/L NaCl,盐酸调节酸度使pH=7.22.
1.3 配合物溶液配制
取13.9 mg 配合物溶于100 mL 容量瓶中,用缓冲溶液使之溶解,另加入2%的DMSO 使配合物完全溶解,最后用缓冲溶液定容,使之形成2.8 ×10-4mol/L的溶液.
1.4 鱼精DNA和EB 配制
称取鱼精DNA 10 mg 溶于100 mL 含有5 ×10-3mol/L Tris,5 ×10-2mol/L NaCl 缓冲溶液中,使其形成均匀溶液.用紫外光谱测定A260/A280的比值在1.8~2.0之间,说明纯度符合要求[11].利用ε=6 600 dm3·mol-1·cm-1[12]计算溶液的浓度为3.35 ×10-4mol/L.用上述缓冲溶液配制100 mg/L的EB 溶液.配好的溶液保存于冰箱(4℃)中备用.
1.5 配合物与DNA-EB 作用的荧光光谱
在不同的10 mL 容量瓶中加入1 mL 鱼精DNA和1 mL 溴化乙锭 (EB)溶液,在分别加入0.0、0.4、0.8、1.2、1.6、2.0 mL和3.0 mL 2.8 ×10-4mol/L的配合物的缓冲溶液,然后以Tris-NaCl 缓冲液定容,避光作用12 h.在狭缝宽度为5 nm,激发波长260~320nm (λem=596 nm)和发射波长570~620 nm (λex=297 nm)进行荧光检测.
1.6 Scatchard 图
固定DNA的浓度为1.0 ×10-5mol/L,配合物的浓度依次增大(即配合物溶液与DNA 溶液的浓度比依次为0、0.25、0.5、0.75),室温反应12 h 后,用100 mg/L EB 溶液滴定(每次10 uL),待其稳定 (约5 min)后,在狭缝宽度为5 nm,固定最佳激发波长和最佳发射波长(λex=297 nm,λem=596 nm),测量加入不同EB 量时的荧光强度F,把数据代入Scatchard 方程进行计算,以r/c 对c 作图,即得到不同浓度配合物的DNA 与EB 相结合时的Scatchard 图.r是DNA 上平均每个核苷酸键合的EB分子数,c是自由EB的浓度.
1.7 DNA的热变性行为
在含不同浓度配合物的DNA-EB 溶液中,按荧光实验法配好溶液,固定最佳激发波长和最佳发射波长(λex=297 nm,λem=596 nm),每升高5℃测量一次,测量20~90℃体系的荧光强度F.以F0/Ft对温度作图,即得DNA的热变性曲线图(F0为20℃时的荧光强度).
1.8 离子强度与DNA-EB 作用的荧光光谱
在4组含不同浓度配合物(分别为2.8 ×10-4mol/L,2.8 × 10-5mol/L,2.8 × 10-6mol/L,2.8 × 10-7mol/L)的DNA-EB 溶液中,分别加入不同浓度的NaCl 溶液 (即分别加入0、30、50、70、90、110 mmol/L的NaCl 溶液),测其荧光强度F,以F/F0对NaCl 浓度作图(F0为不含NaCl 时的荧光强度).
2 结果与讨论
2.1 配合物对DNA-EB 荧光光谱的影响
EB 本身的荧光很弱,但能平行地插入双螺旋DNA内部的碱基之间,从而使荧光显著增强,当EB 从双螺旋中出来或DNA 双螺旋减少时,荧光显著降低,因而EB可用作DNA 结构的荧光探针[13].
由图2可见,随着配合物浓度的增大,EB-DNA的荧光光谱的荧光强度变弱.且发射峰位略有红移,发射峰位红移是EB 由疏水环境进入亲水环境的结果,表明配合物作用后,EB 从DNA分子中游离出来.认为配合物与DNA 作用可能有插入和静电结合两种,静电作用使磷酸根上所带负电荷被中和,使分子收缩,同样可将EB 挤出.
为了解这种猝灭过程,根据经典Stern-Volmer 方程[14]:

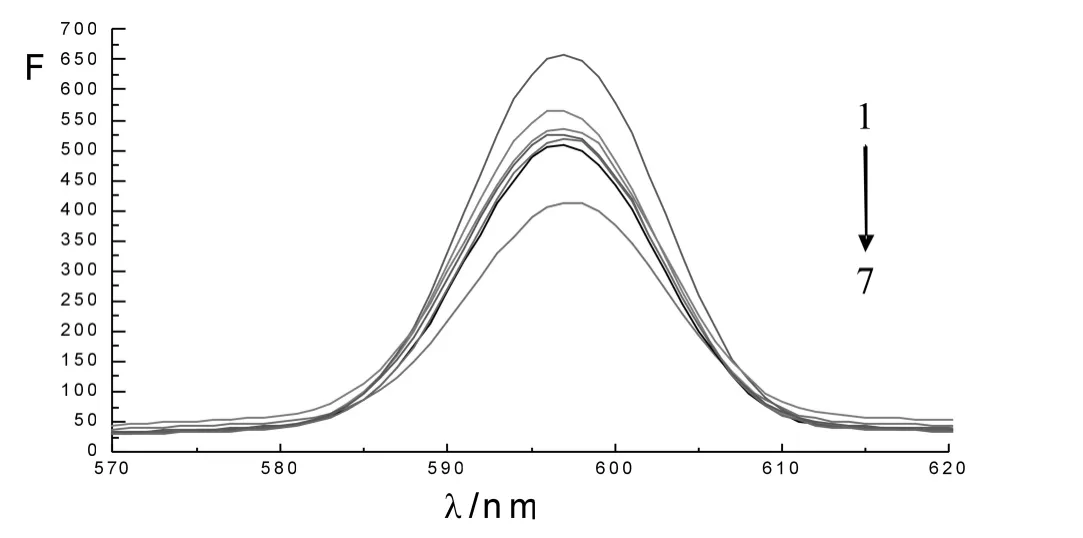
图2 不同浓度的配合物对EB-DNA 荧光猝灭的发射光谱图
F0是不加猝灭剂时体系的荧光强度,F是加入猝灭剂时体系的荧光强度,Kq为动态荧光猝灭过程速率常数,[Q]表示猝灭剂浓度.τ0为猝灭剂不存在时荧光分子的平均寿命(大多数的荧光分子τ0值为10-8s)[15],KD为Stern-Volmer 动态猝灭常数.以F0/F 对配合物浓度作图,得到配合物对DNA-EB 荧光猝灭的Stern-Volmer 图,如图3所示.得到猝灭曲线的回归方程F0/F=1.08021+5.227 ×103[Q],相关系数r =0.9985.由斜率求得动态猝灭常数KD为5.227 ×103L·mol-1,从KD=Kqτ0得到动态荧光猝灭过程速率常数Kq为5.227 ×1011L·mol-1,远大于各类小分子对生物大分子的最大扩散碰撞猝灭速率常数2.0 ×1010L·mol-1[16],表明以上猝灭过程不是由于动态碰撞引起的,而是由于配合物与DNA 结合形成化合物引起的静态猝灭.

图3 配合物对DNA-EB 作用Stern-Volmer 图
2.2 配合物与DNA 作用的Scatchard 图
以EB作为荧光探针,研究配合物与DNA的相互作用,EB 与DNA的结合的特点可用Scatchard 方程[17]描述:
r/c=K (n-r)
式中r是DNA 上平均每个核苷酸键合的EB分子数,n是每个核苷酸上的成键位点数,K是每一点固有的结合常数,c是自由EB的浓度,以r/c 对r 作图得到一直线.利用药物存在下的Scatchard 图可判别药物的作用方式[18],当药物以插入方式与DNA 键合时,即药物与EB 对DNA 上同一位点的结合是竞争性的,则Scatchard 图中K值变化,n值不变;当药物以静电方式与DNA 结合时,即药物与EB 对DNA 上不同位点的结合是非竞争性的,则Scatchard 图中n值变化,K值不变;当药物与DNA的结合存在插入和非插入两种方式时,则表现混合型,Scatchard 图中K值及n值都将改变.
由图4,根据直线的斜率和截距,可求得配合物DNA-EB 体系核苷酸上每一位点固有的结合常数K值分别为:1.625 ×106L·mol-1,1.128 ×106L·mol-1,8.718 ×105L·mol-1,4.159 ×105L·mol-1;每个核苷酸上的成键位点数n分别为:0.23,0.20,0.18,0.17.表明随着配合物浓度的增大DNA 与EB的结合常数K 改变,而DNA 上平均键合位点数n 也改变,这是典型的混合型模型.因此配合物在与DNA 作用时,配合物与DNA的磷酸基团可能发生静电结合,也可能以部分希夫碱配体插入到DNA 双螺旋碱基对中.
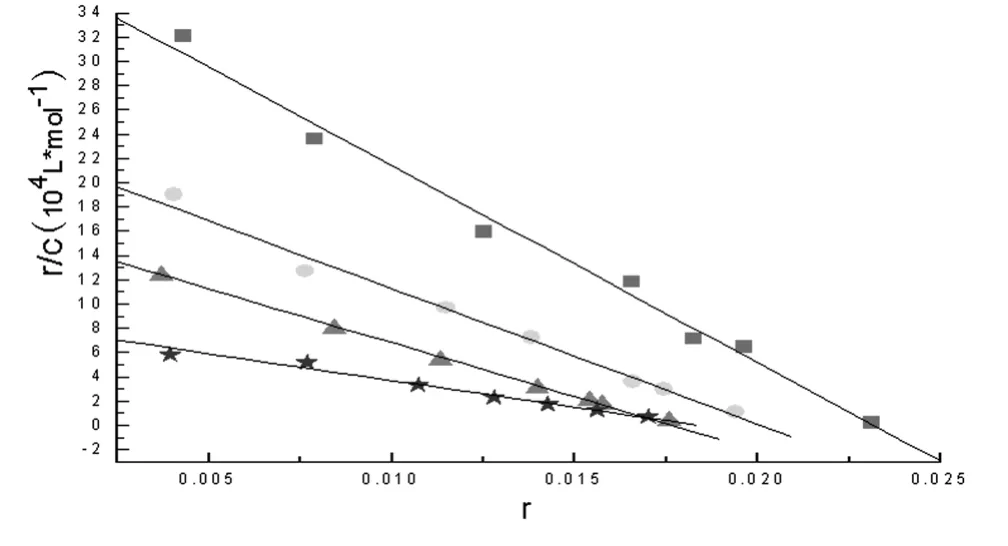
图4 DNA 在不同浓度配合物下的Scatchard 图
2.3 温度对DNA 热变性行为的影响
由图5可见,随着配合物浓度的增加,DNA的熔解温度逐渐降低,熔解热逐渐减小.这是因为在离子强度很小的溶液中,DNA 上的电荷不能有效的被中和,DNA 双链间的静电排斥力很大,DNA 不能稳定地存在于这种溶液中.按照Debye-Huckel 离子屏蔽理论[19],当有盐类加入时,DNA 中带负电荷的磷酸基团可以被中和也就是正离子围绕在磷基团周围形成“离子云”有效地屏蔽了磷酸基间的静电斥力,DNA 将更加稳定,Tm(熔解温度)值将上升[20].然而实验结果却与此相反.这说明DNA 与配合物之间除了静电作用外,应该还有其它作用力,可能是部分的希夫碱配体插入了DNA 中.
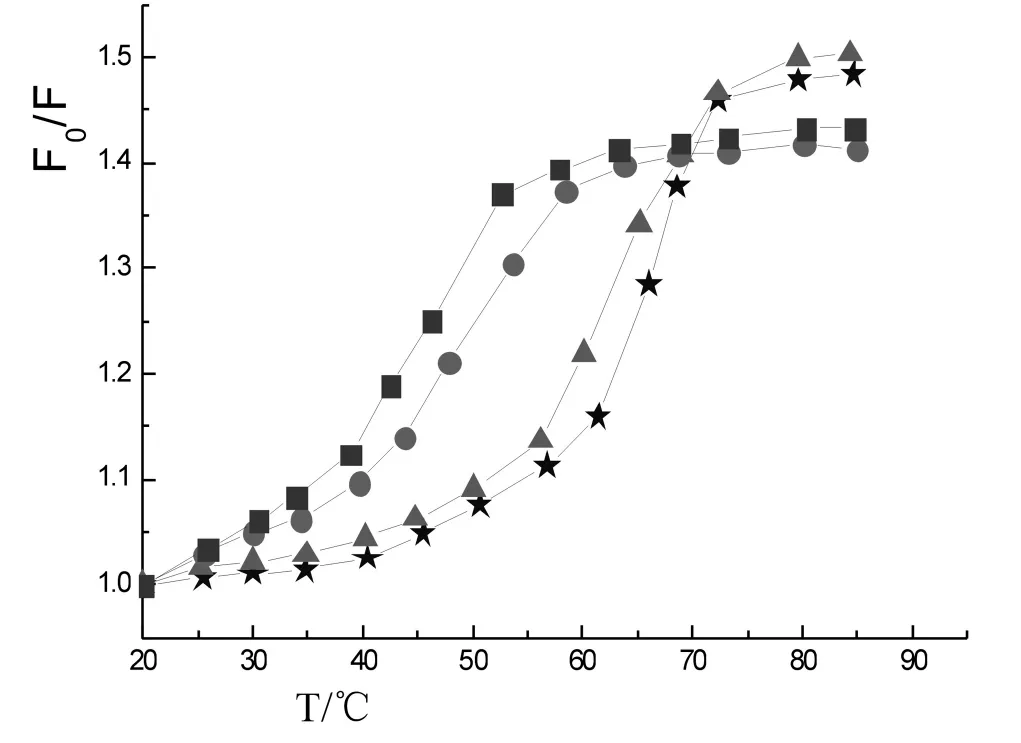
图5 不同浓度配合物对DNA的Tm的影响
2.4 盐浓度对DNA-EB 体系的荧光强度的影响
由图6可见,随着离子强度的增加,配合物DNA-EB 体系荧光强度均明显升高,虽然离子强度增加对纯DNA-EB 本身有一定的粹灭作用,但在配合物存在下,体系总的荧光强度仍在增加,表明配合物对DNA-EB 荧光碎灭程度的减弱,这是由于Na+等盐类阳离子以静电作用与DNA的磷酸基团作用而使周围形成一个阳离子氛,从而使带正电荷的配合物不易靠近,减少了对的DNA的作用,因此荧光强度增加[13].

图6 不同浓度NaCl 对配合物与DNA-EB 荧光强度的影响
3 结论
3,5-二溴水杨醛缩4-溴苯胺铜配合物与DNA-EB 相互作用的体系的荧光强度具有静态猝灭作用,以及配合物在不同浓度下的Scatchard 图表现为混合型抑制模型,其结合常数K和成键位点数n 随着配合物浓度的改变而改变,表明配合物与DNA 作用可能有插入和静电结合两种模式.离子强度对配合物DNA-EB荧光光谱的影响中,随着离子强度的增加,体系荧光强度均明显升高,这是配合物与DNA之间有静电作用的表现.DNA 热效应实验中,随着配合物浓度的增加,DNA的熔解温度逐渐降低,说明DNA 与配合物之间除了静电作用外,应该还有其它作用力,可能是部分的希夫碱配体插入了DNA 中.
[1]Sylvain R,Bernier J L,Waring M J.Synthesis of a functionalized Salen-copper complex and its interaction with DNA[J].Org Chem,1996,61 (7):2326-2331.
[2]H.Chen,J.Rhodes.Sch iff base fo rm ing drugs:mech-anism s of immune po tent iat ion and therapeut ic potential[J].J Mol Med,1996,74:497-504.
[3]Santanu B,Subhrangsu SM.Ambient oxygen activating water soluble Cobalt-Salen complex for DNA cleavage[J].J Chem Soc.Chem Commun,1995,24:2489-2490.
[4]江道勇,高蕊,丁国华,等.一种氨基酸Schiff 碱及其铜、锌配合物的合成及抑菌活性[J].化学试剂,2013,35 (11):1023-1027.
[5]柳翠英,赵全芹,郭秀英.5-氯,N-(2-羟基乙基)水杨醛亚胺Sch iff 碱的合成与表征[J].化学试剂,1998,20 (1):42-43.
[6]LI Lian O zhi,ZH AO Chao,XU Tao,et al.Synthesis,cr ystal str ucture and nuclease act ivity of a Schiff base copper (Ⅱ)complex[J].J.Inorg Biochem,2005,99(5):1076-1082.
[7]WANG L R,WANG R X,YANG L Z,et al.Study o f the interaction of CT ZAM BOCu (Ⅱ)with DNA and the determinatio n of DNA[J].J.Electroanal.Chem.,2005,585 (2):214-219.
[8]Oh K B,Lee J H,Chung S C,et al.Antimicrobial activities of the bromophenols from the red alga Odonthalia corymbifera and some synthetic derivatives[J].Bioorg Med Chem Lett,2008,18 (1):104-108.
[9]孙雪,徐年军,郭俊明,等.2种海藻溴酚化合物的抗肿瘤作用及其机制研究[J].中国中药杂志,2010,35(9):1173-1176.
[10]ML.Guo and L.Zhang.2,4-Dibromo-6-(4-bromophenyliminomethyl) phenol[J].Acta Crystallographica Section E,2007,63:4558-4559.
[11]孙乃恩,孙东旭.分子遗传学[M].南京:南京大学出版社,1996:5-6.
[12]李安之,丁玫,于海鹰.不同价态金属离子对DNA 构象的影响[J].物理化学学报,1992,8 (2):207-211.
[13]靳兰,杨频,李青山.荧光法研究手性金属配合物与DNA的作用机理[J].高等学校化学学报,1996,17(9):13-45.
[14]Jiang C Q,Gao M X,Meng X Z..Study of the interaction between daunorubicin and humanserum albumin and the determination of daunorubicin in blood serum samples[J].SpectrochimicaActa Part A,2003,59 (7):1605-1610.
[15]李来生,葛小辉,黄志兵,等.光谱法研究羟基葫芦脲与对氨基苯磺酸的分子识别用[J].应用化学,2006,23 (7):747-752.
[16]陈国珍,黄贤志,许金钩,等.荧光分析法 (第2版)[M].北京:科学出版社,1990:112.
[17]LEPECQ J B,PAOLETTI C.A fluorescence complex between ethidium bromide and nucleic acids[J].J Mol Biol,1967:27-87.
[18]日本化学会编.无机化合物合成手册 (第3卷)[M].曹惠民译.北京:化学工业出版社,1988,73:523-524.
[19]孙乃恩,孙东旭.分子遗传学[M].南京:南京大学出版社,1996:5-6.
[20]李来生,王宇晓,黄伟东,等.荧光法研究金属配合物与DNA的相互作用[J].江西师范大学学报(自然科学版),2001,25 (4):297-298.
