miR-203对人食管癌细胞生物学行为的影响
2014-12-03杨志平北华大学附属医院吉林吉林132001
牛 彤 杨志平 (北华大学附属医院,吉林 吉林 132001)
食管癌是发生在食管黏膜上皮组织的肿瘤,是一类严重影响人类健康的高致死性肿瘤。食管癌患者的预后较差,所以早期诊断、早期预防显得尤为重要。微RNA(miRNA)是一类在生物体内普遍存在的单链非编码蛋白质小分子RNA,研究表明它们可以特异性识别靶基因mRNA的3'UTR并与之结合,引起靶mRNAs发生降解或翻译受到抑制〔1,2〕。近年来研究发现,miRNA具有广泛的生物学功能,其通过对细胞中与增殖、分化、凋亡等相关基因的调控,参与肿瘤的发生、发展过程〔3,4〕。本研究通过构建miR-203表达载体,进而观察其对食管癌细胞生物学行为的影响,旨在为食管癌的诊断和治疗提供新的途径。
1 实验材料
1.1 菌株与质粒 大肠杆菌DH5和Top10感受态购自TIANGEN公司;转化用大肠杆菌stable3感受态细胞初次购自Invitrogen公司;质粒 pcDNA6.2-GW/EmGFP-miR载体购自 Invitrogen公司;引物合成及基因测序由上海生物工程有限公司和上海英骏生物技术公司完成。
1.2 细胞培养试剂 RPMI 1640培养基、DMEM培养基、胎牛血清、胰酶、LipofectAMINE2000 Reagent均购自Invitrogen公司。
1.3 检测试剂 Total RNA提取试剂盒(RNeasy Mini Kit)购自Qiagen公司;ImProm-ⅡTM反转录试剂盒购自美国Promega公司;Taq PCR酶购于New England BioLabs公司;Oligo dT、Random Primer、dNTP购自上海生工有限公司;DNA Loading Buffer等购自日本TaKaRa公司;琼脂糖胶粉购自BIOWEST;Ⅰ型鼠尾胶原蛋白购自胜友公司;Realtime PCR所用的试剂为BrilliantⅡSYBR Green QPCR Master mix(stratagene)。Total RNA提取试剂盒mirVanaTMmiRNA Isolation Kit,和RNA提取试剂Trizol购自Invitrogen公司;miRNA定量检测试剂盒为NCodeTMmiRNA First-StrandcDNA Synthesis and qRT-PCR Kits;限制性内切酶MscⅠ、BfuAⅠ、SacⅠ、XhoⅠ、Taq 酶、T4DNA 连接酶等均购自NEB公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;细胞迁移实验所用的支架购于Corning公司,matrigel购于BD公司。
1.4 方法
1.4.1 细胞培养 人食管鳞癌细胞系(EC-109)由中国疾病控制中心病毒病研究所周玲研究院提供。将细胞按105/cm2种于25 cm2培养瓶内,加入RPMI 1640(含 10%FBS、2 mmol/L L-Gln、100 U/ml SP)抗生素培养,37℃ CO2孵箱培养。每3天更换新鲜培养基1次。细胞铺满瓶底后用胰蛋白酶消化液消化,按 1∶4传代、扩增。
1.4.2 载体构建 按照miRNA设计原则,合成两条单链miRNA,Hsa-miR-203双链的设计如下:正义:5'-TGCTGTTAATATCGGACAACCATTGTGTTTTGGCCACTGACTGACACAATGGTTCCGATATTAA-3';反义:5'-CCTGTTAATATCGGAACCATTGTGTCAGTCAGTGGCCAAAACACAATGGTTGTCCGATAT-TAAC-3',分别进行双链退火与连接、转化、质粒提取(步骤详见说明书)。将提取的质粒用MSCⅠ进行酶切鉴定,琼脂糖凝胶电泳,观察结果;将经酶切初步鉴定的阳性克隆送至Invitrogen公司进行DNA测序。测序正确的质粒按照QIAGEN Plasmid Midi Purification Kit的操作说明进行质粒的中提。
1.4.3 细胞转染 参照说明书。
1.4.4 real-time PCR检测 参照说明书。
1.4.5 细胞增殖实验 采用MTT法检测。
1.4.6 细胞迁移和侵袭实验 六孔板中加入约5×105个细胞,待细胞铺满板底,横线划痕PBS洗细胞3次,去除划下的细胞,加入无血清培养基,37℃、5%CO2培养箱培养,按 0、6、12、24 h取样,拍照。细胞迁移实验结束后,利用transwell实验检测细胞的侵袭能力的变化。具体操作如下:将小室放入培养板中,上室加入300 μl预温的无血清培养基,室温下静置15~30 min,使基质胶再水化,再吸去剩余培养液;制备血清饥饿细胞悬液,取细胞悬液100~200 μl加入transwell小室,向24孔板下室加入500 μl含FBS的培养基,常规培养36 h,棉签擦去基质胶和上室内的细胞,0.1%结晶紫染色,细胞计数并拍照。
2 结果
2.1 MiR-203成功克隆到表达载体中并进行酶切鉴定 鉴定图见图1。
2.2 形态学观察 转染miRNA前细胞的形态和转染miRNA后细胞形态发生变化。转染miR-203后细胞的形态由原来的球形向纤维样发生变化。见图2。
2.3 细胞增殖结果 通过blasticidin筛选获得稳定表达miR-203的EC-109细胞。Real-time PCR实验证实与对照组相比,转染miRNA的细胞高表达miR-203转染miR-203后细胞的增殖情况的变化见图3。
2.4 miR-203抑制肿瘤的形成 与对照组相比外源性的miR-203可以有效地降低EC-109细胞的迁移,降低率为32.4%。进一步通过体外实验检测了miR-203对EC-109细胞侵袭能力的作用,与对照组相比,在高表达miR-203的实验组中,miR-203可以抑制EC-109细胞76.8%的侵袭能力,见图4,图5。
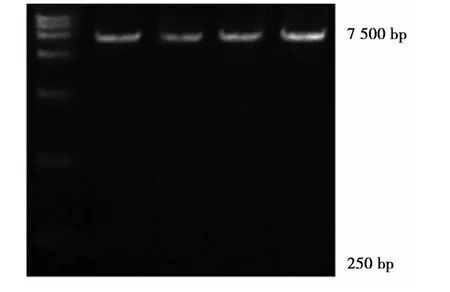
图1 miR-203克隆的电泳酶切鉴定

图2 转染miR-203后细胞形态的变化
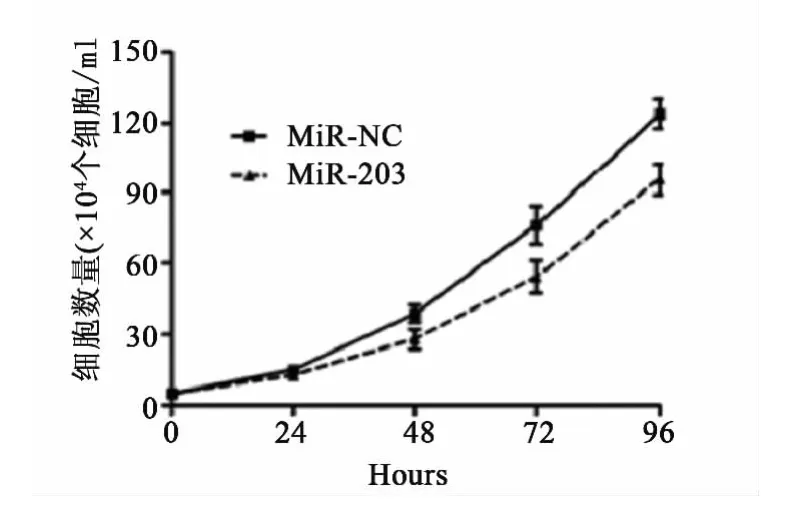
图3 转染miR-203后,EC-109细胞周期减慢
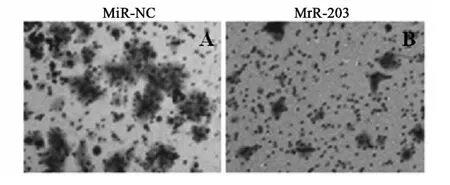
图4 miR-203抑制肿瘤细胞迁徙实验
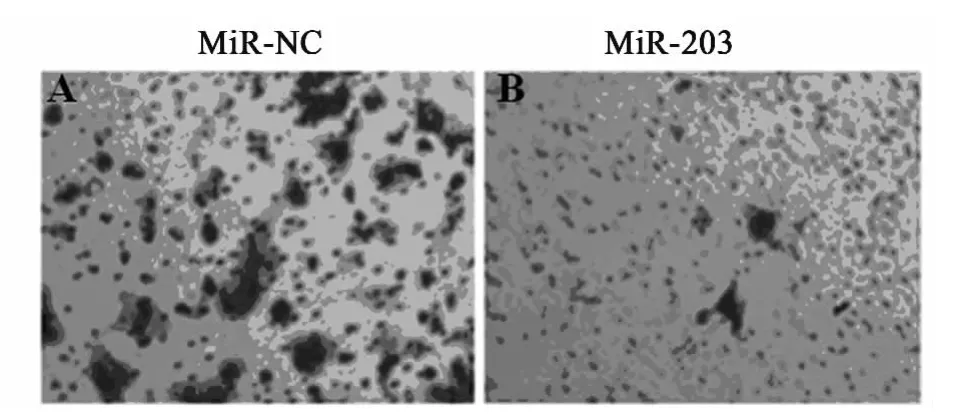
图5 miR-203抑制肿瘤细胞的侵袭实验
3 讨论
在肿瘤的发生过程中,原癌基因和抑癌基因的表达失调被认为是导致肿瘤发生的重要原因。最近的研究表明miRNA在肿瘤的发生发展过程中有重要的调控作用。miRNA可以结合到靶基因的3’UTR区域来清除靶基因mRNA或抑制靶基因的表达。通过芯片分析结果显示异常表达的miRNA可以作为肿瘤的识别标志,大量证据显示miRNA的表达与肿瘤的发生发展有着密切的关系〔1〕。至今为止只有少数的miRNA在肿瘤发生发展中的功能被认定。
MiR-203的表达下调与很多肿瘤的发生有密切的关系,其中与食道癌的发生密切相关,有报道证实有几个与食道癌相关的基因被认定为miR-203的靶基因。本研究的目的是分析miR-203在食道癌中的生物学意义。本研究中证实miR-203的异常高表达明显的抑制食道癌细胞的增殖、迁移、侵袭并且可以诱导细胞的凋亡。实验结果显示miR-203对食道癌的发病中起到抑制作用,其分子机制有待进一步研究。
1 Zhang H,Li Y,Lai M.The microRNA network and tumor metastasis〔J〕.Oncogene,2010;29(7):937-48.
2 Ocana OH,Nieto MA.A new regulatory loop in cancer-cell invasion〔J〕.EMBO Rep,2008;9(6):521-2.
3 Santarpial L,Nicoloso M,Calin GA.MicroRNAs:a complex regulatory network drives the acquisition of malignant cell phenotype〔J〕.Endocrelat Cancer,2010;17(1):F51-75.
4 Voorhoeve PM.MicroRNAs:Oncogenes,tumor suppressors or master regulators of cancer heterogeneity〔J〕.Biochim Biophys Acta,2010;1805(1):72-86.
