pGPU6/GFP质粒介导的表达钙网织蛋白基因的短发夹RNA的构建和鉴定
2014-12-03李晓曦孟凡东孙大鹏仇凤启刘新莉
李晓曦 孟凡东 孙大鹏 仇凤启 刘新莉 赵 丹 马 萍
(中国医科大学附属第一医院肿瘤研究所二室,辽宁 沈阳 110001)
乳腺癌发病率占全身各种恶性肿瘤的7% ~10%,在美国乳腺癌的年发病率已接近130/10万人口〔1〕。在传统的手术、放疗和化疗基础上,应用生物治疗是肿瘤治疗的新方向。近来研究发现构建靶向钙网织蛋白(CRT)除钙在心血管系统中的调节作用外,在肿瘤的血管形成,侵袭转移和凋亡方面也有一定作用〔2〕。近年来,RNA干扰(RNAi)越来越为人们所重视。RNAi是一种进化上保守的基因组水平的免疫监控机制,是多步骤过程,通过RNaseⅢ内切核酸酶Dicer的作用产生小的(21~23 nt)短干扰性RNA(siR2NA),介导其互补同源mRNA序列的特异性降解〔3,4〕。本项研究拟利用基因克隆技术构建表达CRT shRNA的质粒,为研究CRT基因在乳腺癌细胞株凋亡、侵袭和转移方面的作用奠定实验基础。
1 材料与方法
1.1 主要试剂 pGPU6/GFP载体购自上海吉玛公司;限制性内切酶 Pst I、BamH I、Bbs I、T4 DNA L Ligase 购自美国 NEB 公司;胶回收试剂盒购自Agarose Gel DNA Purification Kit Ver2.0(TaKaRa);质粒抽提试剂盒购自Axygen。Lipofectamine 2000转染试剂为Invitrogen公司产品。人乳腺癌细胞MDA-MB-231、大肠杆菌DH5a为本实验室保存;RPMI 1640培养基购自Thermo公司;标准胎牛血清购自Boermei公司。
1.2 方法
1.2.1 CRT siRNA转录模板DNA链的设计、合成 人CRT mRNA的序列信息从NCBI Entrez核苷酸数据库获得。CRT基因的两个靶位置从人CRT mRNA序列中选择(Genebank Accession NG_029662),分别选择CRT编码序列中第359~379,535~555,747~767,1 051~1 071特异性序列为siRNA的正义链。经Blast Search检索确认与EGFR以外的人类已知基因序列无同源性。由上海吉玛公司设计、合成1#,2#,3#,4#CRT 4对shRNA。shRNA模板中的loop结构选用了TTCAAGAGA以避免形成终止信号,shRNA的转录终止序列采用T6结构。正义链模板的5'端添加了CACC,与BbsI酶切后形成的黏端互补;反义链模板的5'端添加了GATC,与BamHⅠ酶切后形成的黏端互补;如果siRNA的第一个碱基不是G,则在CACC后补加一个G。序列如下:1#S:5'-CACCGCAGT TCACGGTGA AACATGATT CAAGAGATC ATGTTTCAC CGTGAACTG CTTTTTTG-3',A:5'-GATCCAAAA AAGCAGTTC ACGGTGAAA CATGATCTC TTGAATCAT GTTTCACCG TGAACTGC-3';2#S:5'-CACCGCAAG AACGTGCTG ATCAACATT CAAGAGATG TTGATCAGC ACGTTCTTG CTTTTTTG-3',A:5'-GATCCAAAA AAGCAAGAA CGTGCTGAT CAACATCTC TTGAATGTT GATCAGCAC GTTCTTGC-3';3#S:5'-CACCGCCAA GATCGATGA TCCCACATT CAAGAGATG TGGGATCAT CGATCTTGG CTTTTTTG-3',A:5'-GATCCAAAA AAGCCAAGA TCGATGATC CCACATCTC TTGAATGTG GGATCATCG ATCTTGGC-3';4#S:5'-CACCGCACC ATCTTTGAC AACTTCCTT CAAGAGAGG AAGTTGTCA AAGATGGTG CTTTTTTG-3',A:5'-GATCCAAAA AAGCACCAT CTTTGACAA CTTCCTCTC TTGAAGGAA GTTGTCAAA GATGGTGC-3'。
1.2.2 重组质粒pGPU6/GFP/Neo-CRT shRNA的构建 将DNA oligo 分别用 TE(pH 8.0)溶解,浓度为 100 μmol/L。按说明配比反应体系,在PCR仪上按照如下程序进行退火处理:95℃ 5 min;85℃ 5 min;75℃ 5 min;70℃ 5 min;4℃保存。退火处理后得到浓度为10 μmol/L的shRNA模板。将所得模板溶液稀释500倍,终浓度为20 nmol/L,用于连接反应。BamHⅠ和BbsⅠ在 37℃ 酶切质粒 pGPU6/GFP/Neo 1 h,琼脂糖凝胶电泳,胶回收线性化质粒。用T4连接酶将退火DNA定向插入到空载体中。将重组体转化感受态大肠杆菌DH5a,每个连接反应挑取5个菌落,接种到含50 μg/ml Kanamycin的LB培养集中筛选阳性克隆,使用碱裂解法抽提质粒。
1.2.3 重组质粒的鉴定 所得质粒用BamHⅠ,PstⅠ分别酶切鉴定(图1)。阳性重组载体应该可以被BamHⅠ酶切,而不能被PstⅠ酶切。每组选择两个克隆送上海英骏生物技术有限公司测序鉴定。
1.2.4 细胞培养及转染 MDA-MB-231细胞加入含10%胎牛血清的RPMI 1640培养基中,于5%CO2、37℃ 饱和湿度的恒温培养箱中常规培养。每天观察细胞的生长状态,适时换液、传代。当细胞处于对数生长期,且存活细胞百分率均在95%以上时,用0.25%胰酶消化后铺6孔板,每孔接种5×105个细,隔日进行转染。用无血清RPMI1640 250 μl稀释4 μg质粒载体和10 μl Lipofectamine 2000转染试剂静置5 min后混合20 min加入6孔板中进行转染。转染48 h后,于荧光显微镜下观察绿色荧光蛋白的表达。
1.2.5 转染细胞及总蛋白的提取 收集转染48 h后的MDAMB-231细胞,以RIPA法提取细胞总蛋白,测定蛋白浓度。于-80℃保存备用。
1.2.6 细胞中CRT蛋白表达的检测 采用Western印迹法。取提取的5种质粒转染细胞的总蛋白各40 μg,经10%SDSPAGE分离后,电转移至PVDF膜上,用含5%脱脂奶粉的TBST 4℃封闭过夜;加入兔抗CRT抗体(1∶1 000稀释),4℃孵育6 h;TBST洗涤2次,TBS洗涤1次,加入HRP标记的羊抗兔IgG(1∶200稀释),37℃孵育2 h;洗膜,ECL发光,Bio-Rad凝胶成像系统进行图像采集。
2 结果
2.1 重组质粒鉴定 pGPU6/GFP/Neo-CRT经酶切后电泳,可观察到在5 000 bp和100 bp左右各有1条带,符合pGPU6/GFP/Neo质粒(5 117 bp)及插入的siRNA片段(58 bp)的特征(见图1)。
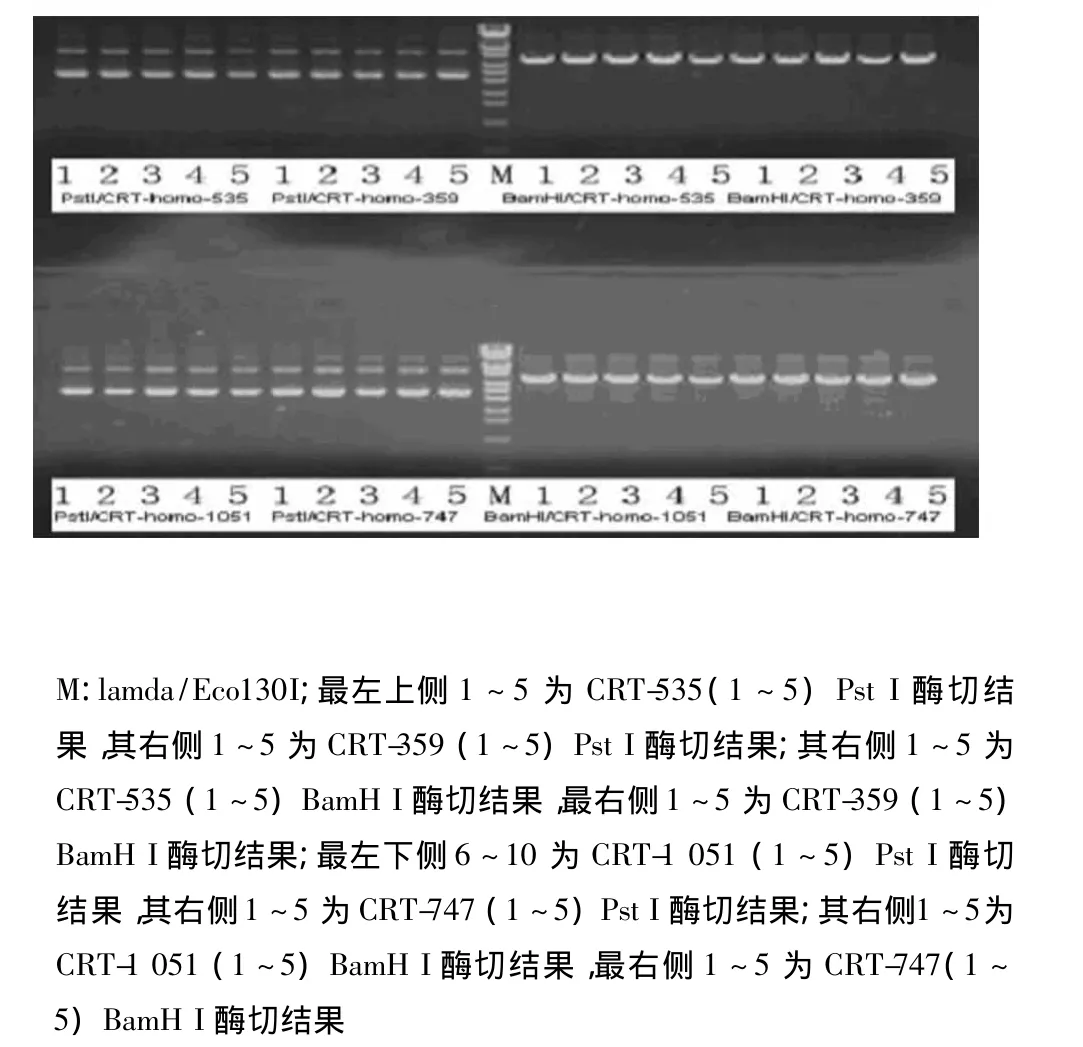
图1 重组载体的酶切鉴定
2.2 测序分析 将重组质粒pGPU6/GFP/Neo-CRT1,pGPU6/GFP/Neo-CRT2,pGPU6/GFP/Neo-CRT3 和 pGPU6/GFP/Neo-CRT4送上海英骏生物技术有限公司测序鉴定。测序结果均与目的序列相同。见图2。
2.3 重组质粒的转染效果 荧光显微镜下观察显示,转染48 h后,5种重组质粒转染的MDA-MB-231细胞中均可见明显的绿色荧光,表明重组质粒已成功转入细胞。见图3。
2.4 各组细胞中CRT蛋白的表达 Western印迹法分析显示,重组质粒 pGPU6/GFP/Neo-CRT1,pGPU6/GFP/Neo-CRT2,pGPU6/GFP/Neo-CRT3及 pGPU6/GFP/Neo-CRT4均可抑制MDA-MB-231细胞中CRT蛋白的表达,其中pGPU6/GFP/Neo-CRT1质粒的抑制作用最为显著。见图4。
图2 测序分析

图3 转染MDA-MD-231细胞图片(×100)

图4 Western印迹法分析各组细胞中CRT蛋白的表达
3 讨论
CRT是一种在调节细胞功能方面有作用的多功能蛋白,广泛分布在有核细胞的内质网表面〔5〕,其在防止新蛋白合成过程中的蛋白聚合和协助蛋白正确折叠方面有重要作用并有效调节体内 Ca2+的平衡〔6〕。
RNAi是由双链RNA诱发的基因沉默现象,其机制是当细胞中导入与内源性mRNA编码区同源的双链RNA时,该mRNA发生降解而导致基因表达沉默。与其他基因沉默技术相比,其具有高效抑制基因的表达及高度的序列特异性的优点〔8〕。shRNA在体内加工后形成类似siRNAs的分子,引发基因沉默。有研究表明,通过质粒表达siRNA并携带进入细胞内可以抑制特定基因的表达〔9,10〕。
本实验针对CRT基因设计、合成了4对正、反义RNA干扰寡核苷酸链,退火形成双链,与双酶切的载体pGPU6/GFP连接后转染MDA-MB-231细胞。利用实时定量PCR和Western印迹技术检测靶基因被抑制的效果,并筛选出了最有效的干扰质粒pGPU6/GFP/Neo-CRT1,避免仅设计1组干扰序列导致的干扰效果无对照,无法选择干扰效率最优的质粒进入后续实验的问题,从而为进一步研究该基因在乳腺癌凋亡、侵袭及转移中的作用奠定了基础。
1 Jemal A,Siegel R,Ward E,et al.Cancer statistics〔J〕.CA Cancer J Clin,2006;56(2):106-30.
2 Yi-Chien Lu,Chiung-Nien Chen,et al.Changes in tumor growth and metastatic capacities of J82 human bladder cancer cells suppressed by downregulation of calreticulin expression〔J〕.Am J Pathol,2011;179(3):1425-33.
3 Sharp PA.RNA interference〔J〕.Genes Dev,2001;15(5):485-90.
4 Zamore PD.RNA interference:listening to the sound of silence〔J〕.Nat Struct Biol,2001;8(9):746-50.
5 Michalak M,Corbett EF,Mesaeli N,,et al.One protein,one gene,many functions〔J〕.Biochem,1999;344(2):281-92.
6 Michalak M,Robert Parker JM,Opas M.Ca2+signaling and calcium binding chaperones of the endoplasmic reticulum〔J〕.Cell Calcium,2002;32(5-6):269-78.
7 Liu XL,Zhao D,Sun DP,et al.Adenovirus-mediated delivery of CALR and MAGE-A3 inhibits invasion and angiogenesis of glioblastoma cell line U87〔J〕.J Exp Clin Cancer Res,2012;31(1):8.
8 Hammond SM,Caudy AA,Hannon GJ.Post-transcriptional gene silencing by double-stranded RNA〔J〕.Nature Rev Gen,2001;2(2):110-9.
9 Lee NS,Dohjima T,Bauer G,et al.Expression of small interfering RNAs targeted against HIV1 rev transcripts in human cells〔J〕.Nature Biotechnol,2002;20(5):500-5.
10 Yu JY,DeRuiter SL,Turner DL.RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells〔J〕.Proc Natl Acad Sci USA,2002;99(9):6047-52.
