东海赤潮高发区沉积物柱状样中正构烷烃和脂肪醇的分布与来源①
2014-12-02刘亚娟王江涛贺行良
李 凤 刘亚娟 王江涛 贺行良
0 引言
东海是典型的大河影响下的边缘海,接受了来自长江等河流的陆源有机碳输入和近岸初级生产产生的海洋(自生的)有机碳[1]。目前,生物标志物作为一类新的地球化学指标,在不同的边缘海系统中被大量应用[2~6]。但这些化合物在应用时存在一些问题,比如,浮游生物中丰富的硅藻、颗石藻及细菌输入和细菌的改造作用,可以使高碳数正构烷烃不具有明显的奇偶优势,混淆其物源的指示意义[7];在沉积物中甾醇化合物的差异不仅与生物来源有关,沉降过程中甾烯醇的细菌加氢还原作用也可以产生甾醇,因此,可能混淆甾醇的指示作用[8],且陆架区因受高沉积速率、细胞产生量、早期成岩等诸多因素的影响,生物标志物在内陆架区保存机制尚不完全明确。所以,要在这一海区使用生物标志物反演生态变化,研究边缘海沉积有机质来源,通常将两种或两种以上的生物标志物与能反映有机物总体特征的参数结合使用。本文以东海赤潮高发区为研究区域,通过对柱状沉积物中δ13CTOC和生物标志物的研究,探讨了有机质的来源、分布、迁移和转化,丰富了对边缘海有机地球化学过程的认识。
1 材料与方法
1.1 样品采集与处理
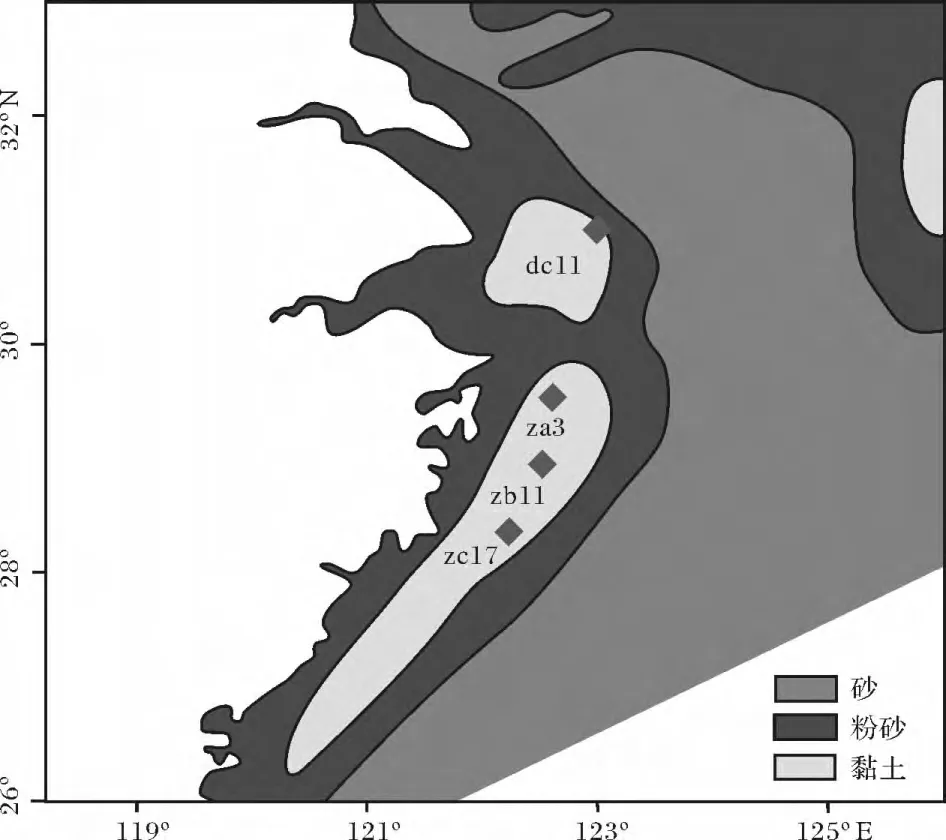
图1 采样站位(底图改绘自文献[9])Fig.1 Location map of the study area and sampling stations
沉积物柱状样用多管式重力采样器取得,站位如图1所示。样品采得后,现场按密集型1cm间距分割成子样,放入450℃灼烧过的铝箔中包裹封装,冷冻(-20℃)保存至实验室分析。分析前,样品经冷冻干燥后研磨过80~100目筛。部分样品进行碳同位素分析,剩余样品用于生物标志物的分析。
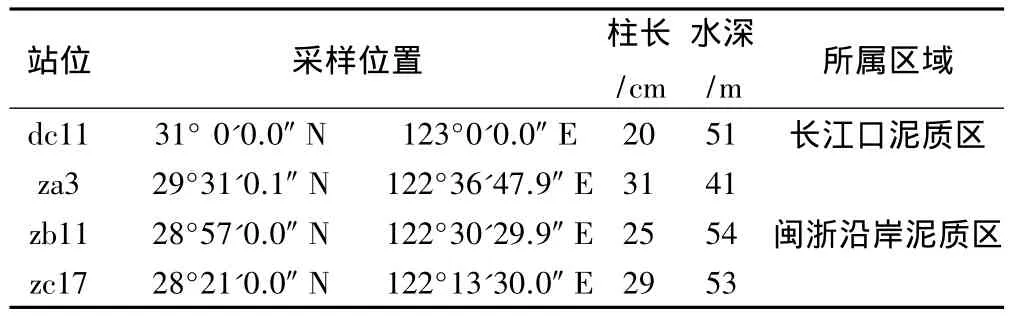
表1 沉积物柱状样基本信息Table 1 Information of four sediment cores
1.2 分析方法
1.2.1 稳定碳同位素分析
取各站位表、中、底三个层次的样品,加入5%HCl,放置 12 h,然后 80℃水浴加热 0.5~1 h,除去无机碳。用去离子水洗至 pH>6,在105℃下烘干,称重。用Flash EA1112型元素分析仪(EA)-MAT253同位素比值质谱联用仪测定。EA:炉温950℃;Con-FloⅢ氦气压力120 kPa,CO2压力150 kPa;IRMS真空度为 2.6×10-8kPa,发射电流 1.5 mA。同位素结果的计算式如下:δ13CTOC(‰)=(R样品/R标准-1)×1000,其中标准物质为国际标准物质PDB。
1.2.2 生物标志物分析
样品冷冻干燥后,加入二氯甲烷/甲醇(V/V 3∶1)萃取液和C24D50、C19-OH组成的内标,超声萃取4次得到总可萃取有机质。萃取液加活性铜片除硫后,在柔和氮气下吹干,加入6%KOH/CH3OH溶液皂化12 h,再以正己烷萃取得到中性脂类物质。萃取液经氮吹富集后,用硅胶层析柱进行净化,先用正己烷淋洗得到烷烃组分,再用甲醇/二氯甲烷(V/V 5∶95)淋洗得到醇组分。将烷烃组分吹干用正己烷定容后直接上机分析;对醇类组分需进行衍生化反应,加40 μL二氯甲烷和 40 μL BSTFA衍生化试剂加热(70℃),反应1 h,再上仪器分析。
GC-MS分析在 Agilent7890A/5975C型气相色谱/质谱联用仪(GC/MS)上完成,离子源为电子轰击源(70 eV),离子源温度230℃,四级杆温度150℃,色谱柱:DB-5MS弹性石英毛细管柱(30 m×0.25 mm×0.25 μm),载气:氮气,流速:1.0 mL/min。无分流进样1 μL,进样口温度300℃,具体升温程序如下:
a.烷烃组分:初始温度60℃保持1 min,以5℃/min升至310℃,终温保持20 min。
b.醇组分:初始温度80℃保持1 min,以25℃/min升至200℃,再以4℃/min升至300℃,终温保持15 min。
化合物鉴定依据色谱保留时间和质谱图与文献报道和标准谱库(美国NIST02L)中的谱图相比较完成。空白样分析在每一样品分析前进行,以确保色谱柱无污染。化合物的量在假定内标与各化合物具有相同响应因子的前提下,根据所加内标和各化合物在总离子流图上的响应值求的[9]。经重复测定,化合物分析的相对标准误差在±5%内。由于有些样品化合物含量很低,因此,对样品进行了浓缩富集,所以没有进行回收率的计算。
2 结果与讨论
2.1 总有机碳同位素组成特征
各站位不同层次沉积物δ13CTOC分布如图2所示,4 个泥质区的碳同位素组成在-22.7‰~ -24.5‰之间,平均值-23.4‰,闽浙沿岸泥质区站位较长江口泥质区δ13CTOC富集。按照文献[9]的双端元模型计算了陆源和海源的贡献率,计算结果如表2。研究海区陆源有机碳的贡献率在42%~62%之间,平均贡献率为51%。就不同采样站位而言,dc11站陆源有机碳最高,平均值为57%。其中表层有机碳由海洋自身贡献占50%以上,随着深度的增加,陆源有机碳的比例逐渐增多,达60%以上。闽浙沿岸泥质区表层沉积物中来自海洋浮游植物的有机碳输入较多,中层和底层沉积物中陆源有机碳比例较表层来说有所上升。zb11站由δ13C指示的两端元贡献率基本各占一半,这与刘亚娟[10]测定的该站位C/N比指示的物质来源情况基本一致。按照站位由北向南,陆源有机碳的输入逐渐减少,海源有机碳的输入逐渐增加,这基本上反映了长江对该海域有机碳输入的影响。
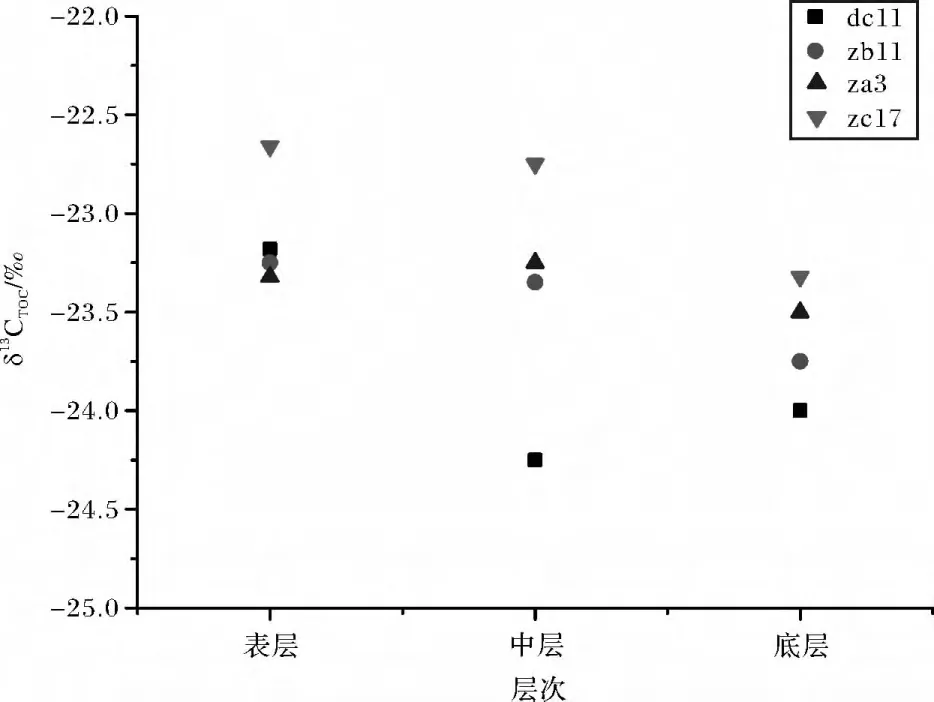
图2 不同层次沉积物δ13CTOC值Fig.2 δ13CTOCvalues in sediments of different levels
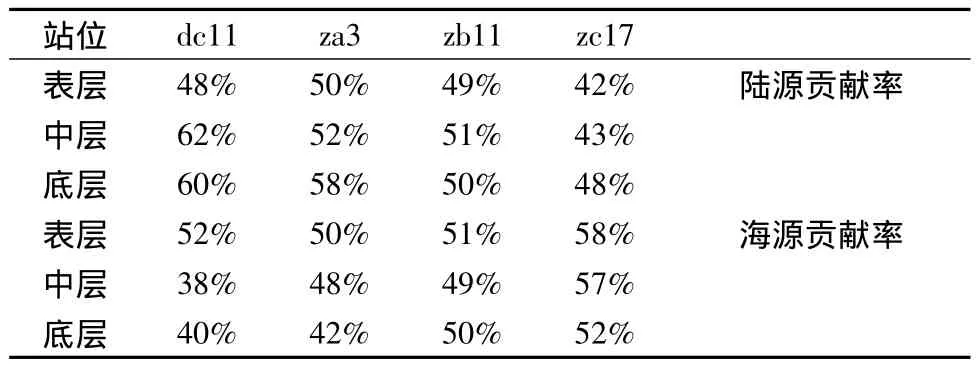
表2 采样站位不同层次两端元模型计算结果Table 2 Sampling stations with different levels using a binary model calculation results
2.2 正构烷烃
2.2.1 正构烷烃的组成与分布
沉积物样品中正构烷烃Cn的分布范围为C14~C35,个别站位达到C38。典型的正构烷烃气相色谱图如图3所示的zb11站19~20 cm样品的色谱图。正构烷烃分布多呈双峰型群,前峰群链长在C14~C21,主碳峰为C18或 C19,后峰群碳数在 C25~C36之间,主峰碳为C29或C31,与前峰群相比后峰群奇碳优势更加明显。前峰群和后峰群的碳数奇偶优势指数CPI1和CPI2如表2所示。各站位前峰群短链烷烃的CPI1在1.0左右,无明显奇偶优势,主要来源于海洋浮游藻类和细菌;后峰群长链烷烃的CPI2大多在2.0~5.0范围内,有明显的奇碳数优势,主要以陆源输入为主。
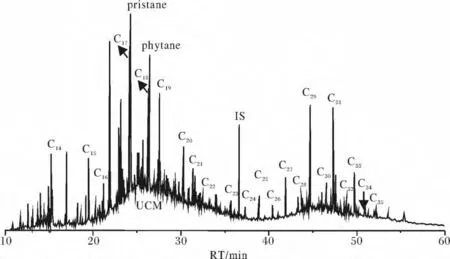
图3 zb11站19~20 cm样品正构烷烃气相色谱图Fig.3 The GC spectrum of n-alkanes in 19~20 cm sample of zb11 station
dc11 站 T-ALK 分布在 1.02~10.05 μg/g,平均含量为 6.24 μg/g;za3 站在 0.39~15.99 μg/g,平均值为4.31 μg/g;zb11 站含量在 1.19~7.86 μg/g 之间,平均含量 3.85 μg/g;zc17 站含量分布在 2.25~4.89 μg/g,平均含量3.63 μg/g。dc11站 T-ALK 含量最高,闽浙沿岸泥质区三个站位表层含量则出现由北向南依次递减的趋势。不同站位T-ALK含量垂直变化不同(图4),从整体上看,dc11站的垂直变化最为剧烈,由表层至7 cm呈增加的趋势,最大值为9.44 μg/g,随后又下降到 1.02 μg/g,然后又增加到 10.05 μg/g;za3站表层T-ALK含量最高,以后不断减小,在15 cm处有一个最小值,但总体上表层以下含量较为稳定;zd11站随深度增加,虽然有一些波动,但基本上呈现单向减小趋势;zc17站T-ALK含量在四个站位中是最低的,总体趋势也是不断减小。对比四个站位,除dc11站外其余三个站位T-ALK在波动中随深度增加均呈降低趋势。这可能与沉积物本身粒径有关。一般来说,粒度细的颗粒比较容易吸附有机质。za3站表层样品粒径明显较下层细,含砂量较低,这可能是造成za3站表层烷烃含量偏高的原因。

图4 采样站位T-ALK含量的垂直变化Fig.4 Sampling station’s T-ALK content vertical variation
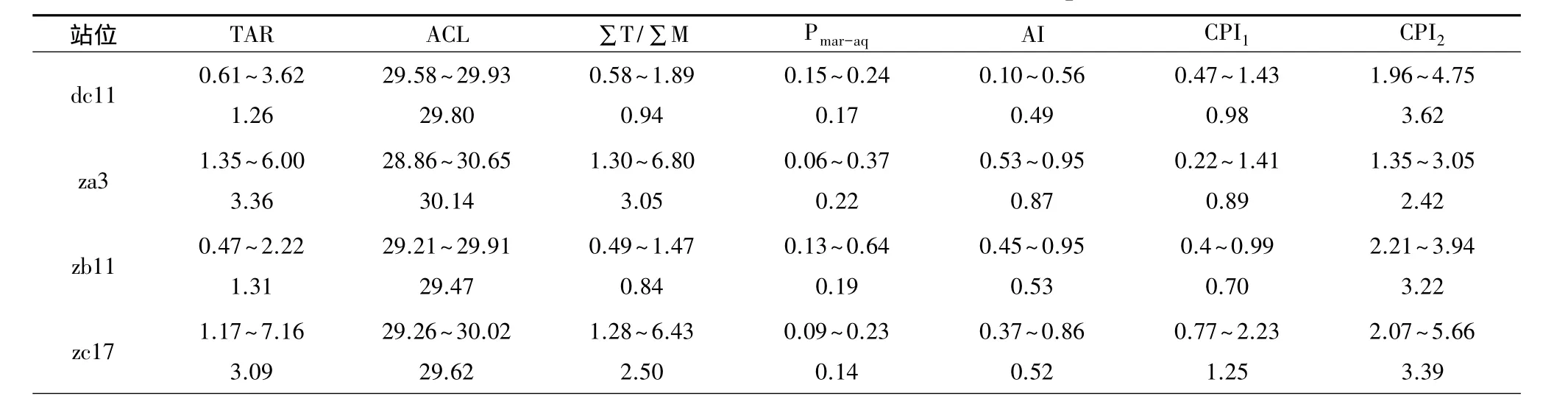
表3 采样站位正构烷烃分子组成特征指数Table 3 Characteristic index of N-alkane molecule composition
2.2.2 正构烷烃指示的沉积有机质来源
应用特征指数可对正构烷烃的分子组合特征进行分析,从而反演沉积有机质的来源和沉积环境。计算结果如表3所示。
为消除粒度和沉积速率的影响,利用陆源正构烷烃与海源正构烷烃之比(ΣT/ΣM)可更准确的指示有机质的来源[11]。从表3中看出,ΣT/ΣM变化范围在0.58~6.80 之间。dc11 站随着深度的增加,ΣT/ΣM逐渐增大,za3站情况与之类似,说明在过去的几十年中陆源有机质输入的比例在逐渐降低,这与该地区赤潮频发的现实情况是一致的;zb11站在<10 cm的深度范围内,ΣT/ΣM同样是增大的,可能同样是受到海洋初级生产力升高、浮游植物增加的影响;10 cm以下则表现出陆源输入比例的增加;zc17站则没有明显变化,该站位的陆源输入比例相对稳定。TAR也是评价陆源正构烷烃和海源正构烷烃相对贡献的一个常用参数[12]。通过相关性分析发现,TAR与∑T/∑M 的相关性可达 r=0.87~0.98,两者分布类似,指示意义一致。
正构烷烃特征指标Pmar-aq用于区分陆地维管植物、浮水植物以及海洋大型植物的不同输入[13,14]。其中,当 Pmar-aq在 0.01~0.25 之间时代表了陆源输入,在0.4~0.6之间则指示浮水植物的输入,淡水及海洋大型植物输入的正构烷烃Pmar-aq值则在0.6以上。各站位沉积物中正构烷烃的Pmar-aq平均值变化范围在0.14~0.22之间,反映出东海赤潮高发区的正构烷烃的输入以陆源为主,且仅在zb11站部分深层样品中可以找到大型水生植物输入的影响。
平均链长(ACL)可以用来指示沉积区陆源植被种类[13]。木本植物C29正构烷烃含量为最高,草本植物则多以C31为主峰。ACL值越大代表草本植被的输入越多,减小则表示木本植被输入的增加。各站位沉积物中正构烷烃的ACL变化范围在29~30之间。其中za3站最高,为30.14。说明影响该海域的陆源输入植被主要为草本植物。在柱状样分布中ACL也没有发生明显的变化,说明在沉积样可追溯的年代中没有发生植被的明显改变。烷烃指数(AI),可帮助判断母质植被类型[13]。当AI≈0.5时可表示陆源沉积有机质中草本植被与木本植被在母质中所占比例相近,大于该值则说明草本植物的比例较大。从表2可知,草本植物输入的比例大于木本植物。由ACL与AI两者可共同确定影响赤潮高发区的陆源输入主要以草本植被为主。
2.3 脂肪醇
2.3.1 直链烷醇和植醇对有机质输入的指示
浮游植物中烷基醇以C16、C18为主;浮游动物中以C20烷基醇含量最高;水生大型植物则以C22或C24烷基醇占优势,C24或C28烷基醇也可能来自于陆地高等植物或细菌。典型的直链烷基醇碳数分布如图5所示za3站2~3 cm分布图,各站位直链烷基醇前峰群以C16、C18为主碳峰,表明海洋输入中以浮游植物为主;后峰群以 C24和 C28为主碳峰,C24、C26、C28烷基醇的含量最高,以高等植物或细菌的输入为主。另外,∑n-C22+/∑n-C22-比值,在 dc11 站为 0.25~0.66,za3 站为 0.22~6.20,zb11 站为 0.37~0.83,zc17 站为0.19~2.85,均低于东海大陆架(∑n-C22+/∑n-C22-值=6.70)。这说明较之东海大陆架,采样站位有更多的陆源烷基醇的输入,这与脂肪酸的研究结果相吻合[10]。
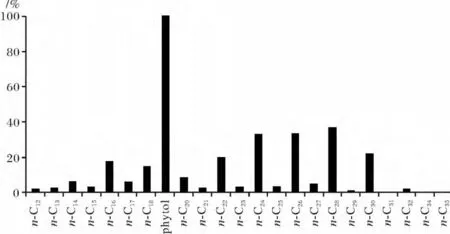
图5 za3站2~3 cm样品直链烷基醇碳数分布图Fig.5 The GC spectrum of n-fatty alcohol in 2~3 cm sample of za3 station
植醇是Chl-a的生物和生物化学水解作用产物,在不同的氧化还原环境下能进一步转化为姥鲛烷和植烷。表层沉积物中,植醇/∑n-烷基醇在dc11、za3、zb11、zc17 站位分别为 0.24、0.36、0.43 和 0.21,与同一海区上层水体中4~5月间叶绿素分布趋势一致,说明东海赤潮高发区植醇所经历的生物和生物化学作用强度相似。同时,这也反映出调查海区叶绿素含量应该较东海大陆架高(植醇/∑n-烷基醇=0.03)[16]。
2.3.2 甾醇指示的物质来源
C27甾醇在浮游动物粪粒中含量较高,主要反映了海洋浮游动物的输入;C29甾醇的主要生产者为陆源高等维管植物,其中24-乙基胆甾-5,22-二烯醇和24-乙基胆甾-5-烯醇是高等植物中甾醇的主要成分;C28甾醇没有特异的专属性,一般认为来源于湖泊藻类,也被用于海洋藻类的生态示踪[15]。将 C27-C28-C29的百分比含量以三角图表示,以直观表示不同来源甾醇的贡献。由图6可知,四个站位不同沉积年代的样品在三角图上的数据点分布较为集中,所测样品甾醇中,陆源C29甾醇贡献率在50%左右;代表着湖泊、海洋等水生环境的C28、C27甾醇的总贡献率也在50%左右,两者间百分含量基本相当,与δ13C两端元混合模型计算结果一致。另外,za3站位5~6 cm、9~12 cm样品中来自水生环境的甾醇百分含量较高,占75%左右,说明在对应的沉积时期海洋藻类生长比较繁盛。
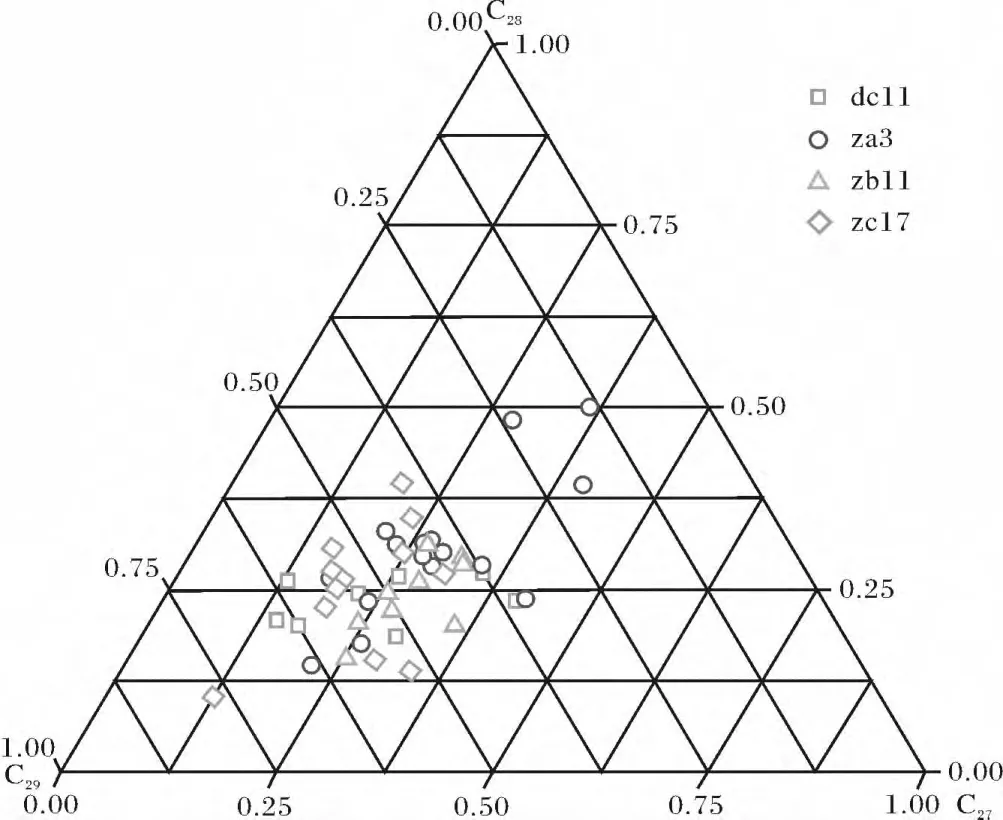
图6 东海沉积物中C27、C28、C29甾醇的分布Fig.6 Distribution of C27,C28,C29sterols in sediments from the East China Sea sediments
2.3.3 甾醇对浮游植物群落结构的指示
甾醇为一系列以环戊烷多氢菲为基本结构的化合物,其双键位置和侧链甲基的位置使其与特定的物质来源有很好的对应性[16]。本文主要以甲藻甾醇(Dinosterol)代表甲藻,以菜籽甾醇(Brassicasterol)作为硅藻特征指示物,反演上层水体浮游植物的群落结构。由于这两种特征生物标志物的降解速率相近,用菜籽甾醇与甲藻甾醇之间的比值(Brassicasterol/Dinosterol)可以用来指示过去一段时期中研究海区浮游植物种群结构的变化情况。
典型浮游植物生物标志物指示的硅藻与甲藻比例变化由图7所示,在过去的一段历史时期中,东海赤潮高发区硅藻/甲藻比例发生了改变。整体上,长江口与闽浙沿岸区域由甾醇指示的硅藻/甲藻比例变化并不相同。长江口dc11站10 cm以上层次硅藻在浮游植物群落中强度随着埋藏深度的变浅而逐渐增大,10 cm以下硅藻/甲藻比例波动较大,主要表现在甲藻相对比例在13 cm达到高值后又在17 cm有低值后又降低。而闽浙沿岸三个站位中,一致性地呈现近年来该海域甲藻增加的趋势。zc17站位甲藻的相对比例在0~17 cm整体上呈增加趋势,17 cm以下层次中,随着埋藏深度的变浅而增大,在25 cm有低值后又在27 cm有高值。两泥质区硅藻/甲藻比例不同可能是因为长江口泥质区受陆源输入的影响大,硅藻比例相对较高。这一变化与东海自上世纪八九十年代以来由于水体富营养化的日益加重所导致的赤潮由简单的硅藻赤潮向硅藻甲藻赤潮交替发生的转变相吻合。
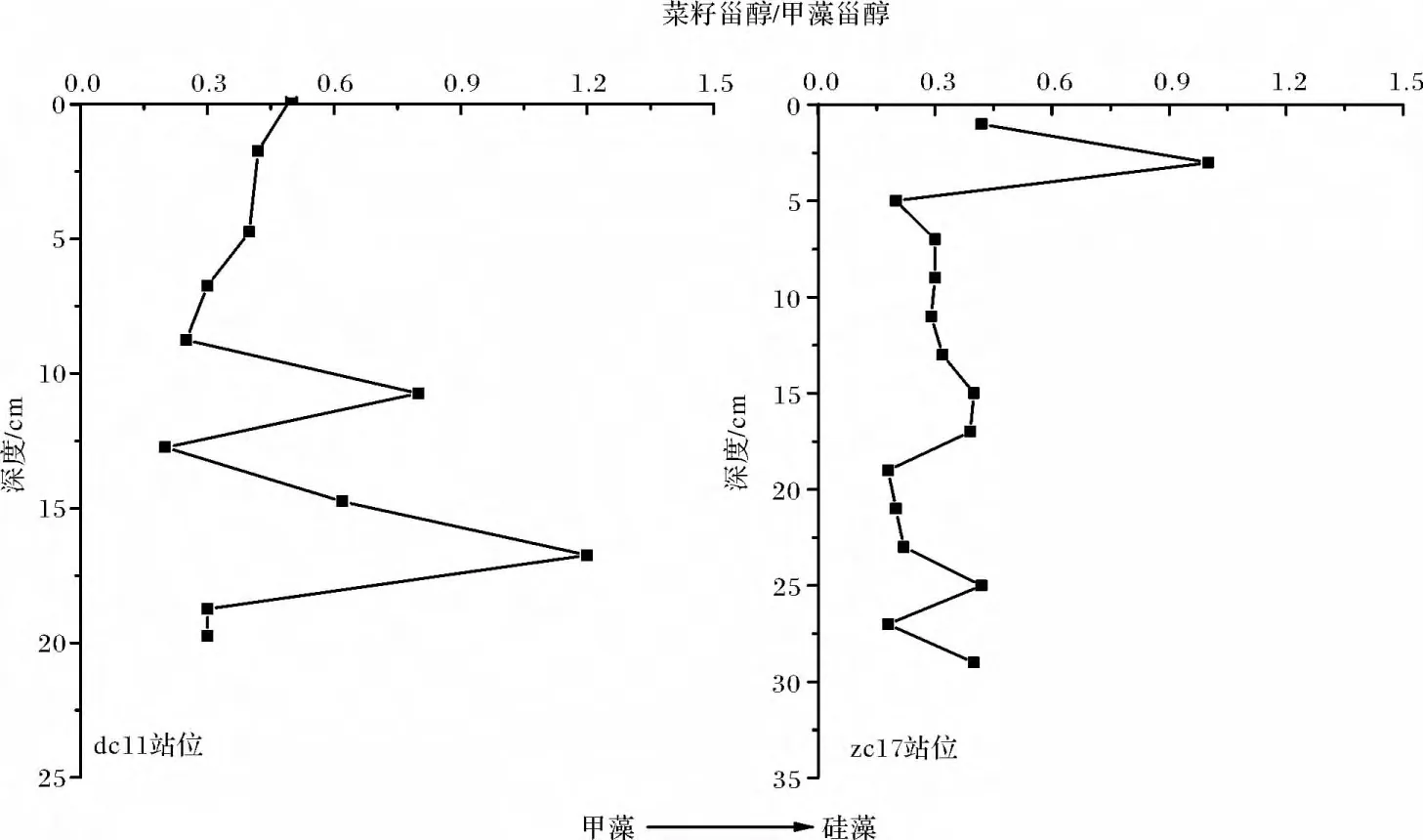
图7 浮游植物生物标志物指示的硅藻与甲藻比例的变化Fig.7 The phytoplankton biomarkers indicates the changing proportion of diatoms and dinoflagellates
同时,还利用沉积速率与za3站位位置接近的值s=0.86 cm/y[17]反演了二十世纪 70 年代以来硅/甲藻种群结构的变化。表层沉积物易受再悬浮等因素的影响,未纳入计算,结果如图8所示。
自上世纪以来,虽在某些年份硅藻比例有所上升,但总体趋势上za3站甲藻的比例不断增大。特别是以1980年为界,之前年份中硅甲藻比例较为稳定,且有硅藻比例增大的趋势,1980年之后,甲藻比例增加的趋势更较为明显。其中2005年、2008年甲藻比例最高。可能与2004年、2005年东海赤潮面积大于其他年份[18]有关。
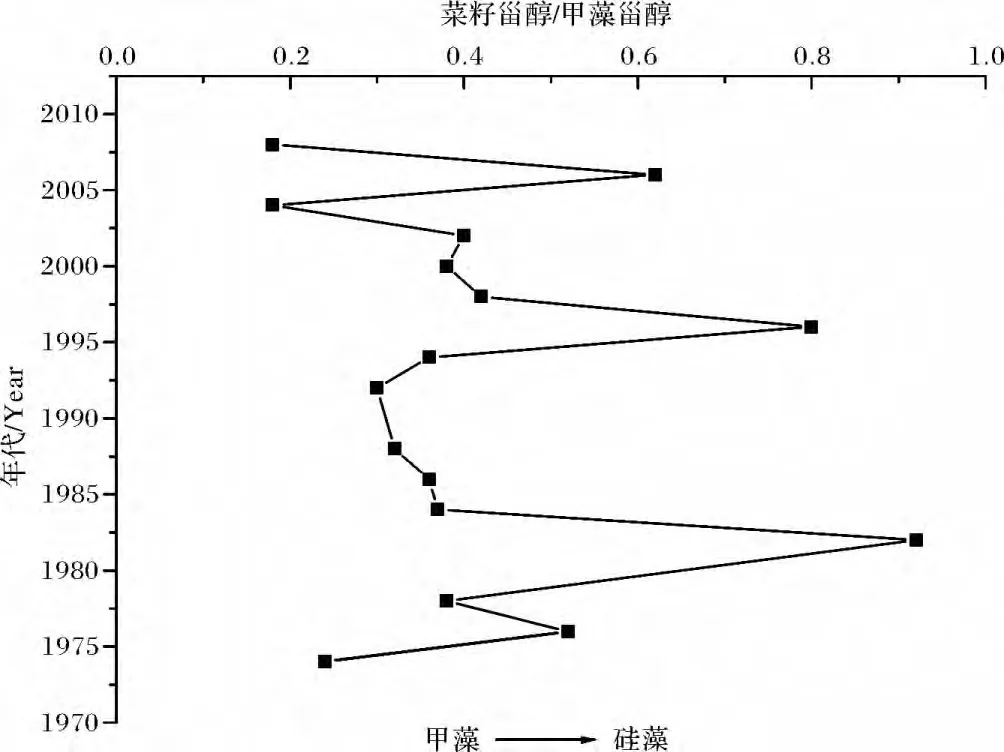
图8 za3站甲藻和硅藻比例的变化Fig.8 The changing proportion of diatoms and dinoflagellates in za3 station
3 结论
(1)东海赤潮高发区陆源有机碳的贡献率在50%~62%之间。随着埋藏深度的增加,海源输入的比例逐步降低。
(2)正构烷烃多以双峰群分布,前峰群短链烷烃(C14~C21)无明显的奇偶碳数优势,主要来源于海洋浮游藻类和细菌;后峰群长链烷烃(C25~C36)具有奇碳数优势,主要来源于陆地高等植物,且以草本植物为主。
(3)东海赤潮高发区沉积物中直链烷基醇主要来源于陆地高等植物。
(4)浮游植物生物标志物指示的硅藻与甲藻比例的变化说明由于水体富营养化的日益加重导致赤潮由简单的硅藻赤潮向硅藻甲藻赤潮转变。
References)
1 Liu J P,Li A C,Xu K H,et al.Sedimentary features of the Yangtze River-derived along-shelf clinoform deposit in the East China Sea[J].Continental Shelf Research,2006,26(17/18):2141-2156
2 张凌,陈繁荣,殷克东,等.珠江口和邻近海域沉积有机物的来源及其沉积通量的时空变化[J].环境科学研究,2009,22(8):75-88[Zhang Ling,Chen Fanrong,Yin Kedong,et al.Spatial and temporal variations of sedimentary organic matter origin and accumulation rate in the Pearl River Estuary and adjacent coastal waters of South China Sea[J].Research of Environmental Sciences,2009,22(8):75-88]
3 Yu F L,Zong Y Q,Lloyd J M,et al.Bulk organic δ13C and C/N as indicators for sediment sources in the Pearl River delta and estuary,southern China[J].Estuarine Coastal and Shelf Science,2010,87(4):618-630
4 张海龙,邢磊,赵美训,等.东海和黄海表层沉积物生物标志物的分布特征及古生态重建潜力[J].中国海洋大学报,2008,36(6):992-996[Zhang Hailong,Xing Lei,Zhao Meixun,et al.Distribution of biomarkers in surface sediments of the East China and Yellow Seas and its potential for paleoecology reconstruction[J].Periodical of Ocean University of China,2008,36(6):992-996]
5 Sikes E L,Uhle M E,Nodder S D,et al.Sources of organic matter in a coastal marine environment:Evidence from n-alkanes and their δ13C distributions in the Hauraki Gulf,New Zealand[J].Marine Chemistry,2009,113(3/4):149-163
6 Anna Gómez-Gutiérrez,Imma Tolosa.Origin and vetical dynamics of particulate organic matter in a salt-wedge estuary,the Ebro Delta,inferred from lipid molecular markers and compound-specific isotope carbon analysis[J].Marine Chemistry,2011,126(1/2/3/4):269-280
7 张龙军,宫萍,张向上.河口有机碳研究综述[J].中国海洋大学学报,2005,35(5):737-744[Zhang Longjun,Gong Ping,Zhang Xiangshang.A review of the study of estuarine organic carbon[J].Periodical of Ocean University of China,2005,35(5):737-744]
8 尹红珍,姚鹏,于志刚.边缘海环境中陆源有机质的化学生物标志物研究进展[J].海洋环境科学,2012,31(1):128-135[Yin Hongzhen,Yao Peng,Yu Zhigang.Study advances in chemical biomarkers of terrestrial organic matter in marine margins environment[J].Marine Environmental Science,2012,31(1):128-135]
9 卢龙飞,蔡进功,雷天柱.东海表层沉积物黏土粒级中多态脂肪酸组成与地球化学特征[J].地球化学,2011,40(2):188-198[Lu Longfei,Cai Jingong,Lei Tianzhu.Composition and geochemical characteristics of free and bound fatty acids in clay fraction of surface sediments,East China Sea[J].Geochimica,2011,40(2):188-198]
10 刘亚娟,王江涛,贺行良.东海赤潮高发区沉积物中脂肪酸的分布及物源指示意义[J].海洋环境学,2012,31(6):803-807[Liu Yajuan,Wang Jiangtao,He Xingliang.Distribution of fatty acid in sediments from red tide-frequent-occurrence area in East China Sea and their indications[J].Marine Environmental Science,2012,31(6):803-807]
11 赵美训,张玉琢,邢磊,等.南黄海表层沉积物中正构烷烃的组成特征、分布及其对沉积有机质来源的指示意义[J].中国海洋大学学报,2011,41(4):90-96[Zhao Meixun,Zhang Yuzhuo,Xing Lei,et al.The composition and distribution of n-alkanes in surface sediments from the South Yellow Sea and their potential as organic matter source indicators[J].Periodical of Ocean University of China,2011,41(4):90-96]
12 Silliman J E,Schelske C L.Saturated hydrocarbons in the sediments of Lake Apopka,Florida[J].Organic Geochemistry,2003,34(2):253-260
13 Wang Zheng,Liu Weiguo.Carbon chain length distribution in n-alkyl lipids:A process for evaluating source inputs to Lake Qinghai[J].Organic Geochemistry,2012,50:36-43
14 Zhang Zhaohui,Zhao Meixun Zhao,Geoffrey Eglinton,et al.Leaf wax lipids as paleovegetational and palaeoenvironmental proxies for the Chinese Loess Plateau over the last 170 kyr[J].Quaternary Science Reviews,2006,25(5/6):575-594
15 段毅.海洋和沼泽沉积有机地球化学[M].北京:科学出版社,2008:42-49[Duan Yi.Marine and Swamps Sedimentary Organic Geochemistry[M].Beijing:Science Press,2008:42-49]
16 鲁晓红,陈颖军,黄国培,等.黄渤海表层沉积物中正构烷烃和甾醇的分布及来源研究[J].生态环境学报,2011,20(6/7):1117-1122[Lu Xiaohong,Chen Yingjun,Huang Guopei,et al.Distribution and sources of lipid biomarkers in surface sediments of the Yellow Sea and Bohai Sea[J].Ecology and Environmental Sciences,2011,20(6/7):1117-1122]
17 张正斌.海洋化学[M].青岛:中国海洋大学出版社,2004:388-389[Zhang Zhengbin.Marine Chemsitry[M].Qingdao:Ocean University of China Press,2004:388-389]
18 申力,许惠平,吴萍.长江口及东海赤潮海洋环境特征综合探讨[J].海洋环境科学,2010,29(5):631-635[Shen Li,Xu Huiping,Wu Ping.Study on marine environmental character of Changjiang Estuary and adjacent East China Sea during algal blooms[J].Marine Environmental Science,2010,29(5):631-635]
