老年肿瘤临终患者并发心律失常的相关危险因素研究
2014-12-02王媛杨波余敏
王媛,杨波,余敏
通常将无治愈希望、预计生存期<6个月的患者称为临终患者;我国尚无统一标准,大多学者认为预计生存期为3~6个月[1,2]。据统计目前肿瘤仍占居民死因第一位[3],而临终患者中60%为恶性肿瘤[4]。因此,随着人口老龄化,恶性肿瘤发病率的增高,老年肿瘤临终患者数量也逐年增加。老年肿瘤临终患者常合并冠心病、慢性肺病、脑血管疾病及糖尿病等慢性疾病,住院时间较长,导致患者发生心律失常的风险增加。为寻找老年肿瘤临终患者并发心律失常的相关危险因素,本研究回顾分析了我院362例老年肿瘤临终患者的临床资料,报告如下。
1 资料与方法
1.1 研究对象和分组 选自2010年5月至2013年7月于北京老年医院心内科及临终关怀病房住院诊治的362例老年肿瘤临终患者,男性168例,女性194例,年龄61~103岁,平均年龄(73.91±9.74)岁。纳入标准:≥60岁且均经病理组织学和(或)细胞学检查确诊为恶性肿瘤,预计生存期<6个月。排除既往有心律失常病史者。心律失常的诊断标准参照《内科学》[5],包括频发房性早搏、心房颤动/扑动、室上性心动过速、频发室性早搏、室性心动过速、心室颤动、二度Ⅱ型及三度房室传导阻滞。根据是否发生心律失常分为2组,对照组(256例)和心律失常组(106例)。其中38例出现2种及以上类型的心律失常,频发房性早搏62例(37.58%),心房颤动/扑动44例(26.67%),频发室性早搏28例(16.97%),室上性心动过速23例(13.94%),二度Ⅱ型及三度房室传导阻滞3例(1.82%),室性心动过速3例(1.82%),心室颤动2例(1.21%)。
1.2 研究方法 收集所有患者基线资料,包括年龄、性别、住院天数(发生心律失常前)、体力状况评分(ECOG)、吸烟指数(吸烟支数×吸烟年数)、合并疾病、酸中毒(动脉血pH值<7.35)、肺部感染、血红蛋白(hemoglobin,HGB)、左心室射血分数(LVEF)。采集患者动脉血,使用血气分析仪检测动脉血pH值。采集患者静脉血,使用迈瑞五分类全自动血球仪测定血红蛋白,应用彩色多普勒超声诊断仪(philips)测定LVEF。
1.3 统计学处理 所有数据使用SPSS 18.0(PASW)处理。计数资料以例数(百分比)表示,组间比较采用χ2检验;计量资料以(±s)表示,组间比较采用t检验。老年肿瘤临终患者并发心律失常相关因素进行多因素Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者基线资料比较 2组患者性别比例、吸烟指数、合并高血压、合并糖尿病、合并脑血管疾病等方面差异无统计学意义(P均>0.05)。见表1。与对照组比较,心律失常组年龄较大,住院天数增加,ECOG升高,合并冠心病(39.1% vs. 59.4%)、慢性肺病伴低氧血症(40.2% vs. 58.5%)、酸中毒(37.9% vs.57.5%)、肺部感染(36.7% vs. 55.7%)比例升高,血红蛋白水平[(99.98±20.094)g/L vs.(80.17±14.514)g/L]和EF[(71.15±8.327)%vs. (52.31±13.449)%]下降,差异具有统计学意义(P均<0.05)。
2.2 老年肿瘤临终患者并发心律失常多因素分析将单因素分析中P<0.1的变量进一步纳入多因素非条件Logistic逐步回归分析。结果显示,老年肿瘤临终患者并发心律失常的危险因素(按OR值从高至低排序)是,肺部感染(OR:15.858,95%CI:2.294~109.624)、慢性肺病伴低氧血症(OR:10.786,95%CI:1.949~59.687)、冠心病(OR:10.306,95%CI:1.796~59.159)、酸中毒(OR:7.618,95%CI:1.431~40.550)、ECOG(OR:3.342,95%CI:1.810~6.174)、住院天数(OR:1.201,95%CI:1.114~1.295)、年龄(OR:1.108,95%CI:1.021~1.202)、血红蛋白(贫血)(OR:0.929,0.889~0.970)、低LVEF值(OR:0.873,0.817~0.933)。见表3。
3 讨论
人口老龄化以及恶性肿瘤发病率的增高,老年恶性肿瘤就诊人数逐年增多。患者呈慢性消耗及恶液质状态,机体器官功能衰退,骨髓再生能力减弱,且多合并一种或几种疾病,如糖尿病、心脑血管疾病、慢性呼吸道疾病等。其中,心律失常为严重并发症,影响预后及生活质量。

表1 老年肿瘤临终患者基线资料比较
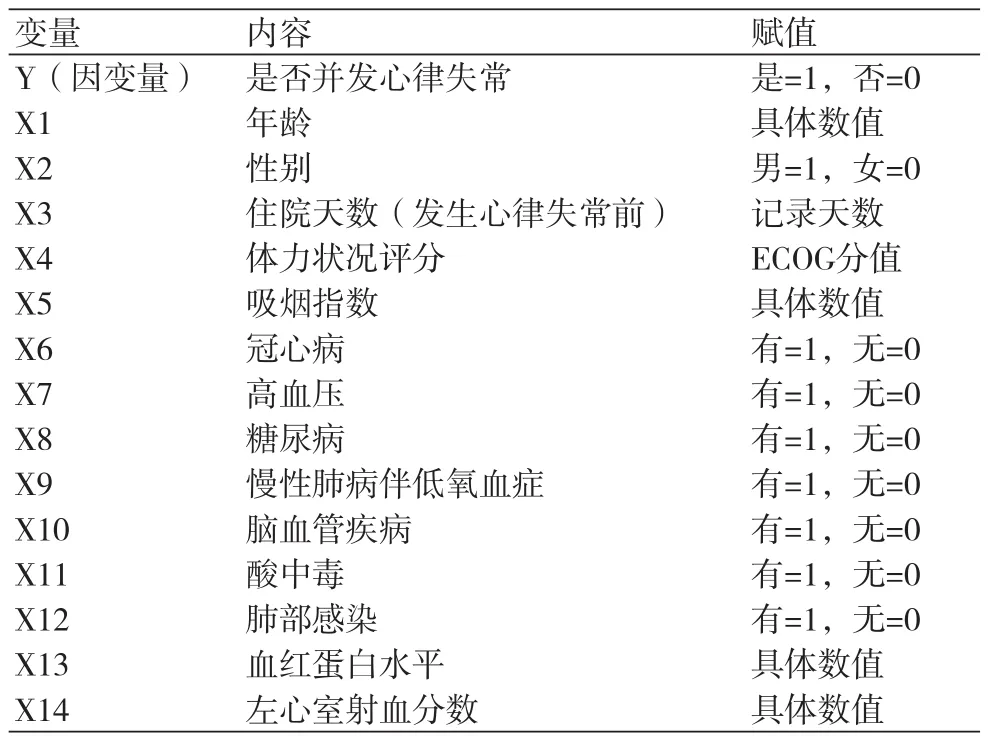
表2 各变量赋值表
本研究提示,肺部感染、慢性肺病伴低氧血症、冠心病、酸中毒、ECOG、住院天数、年龄、血红蛋白降低、LVEF值降低是老年肿瘤临终患者并发心律失常的危险因素。而性别、吸烟指数、高血压病、糖尿病、脑血管疾病与并发心律失常无明确的相关性。
肺部感染是老年肿瘤临终患者常见并发症,国外多项研究显示肺部炎症可明显增加住院患者心血管事件的发生,并导致死亡率增加[6]。肺部感染导致心律失常的机制较为复杂:(1)直接作用于心脏:炎症物质直接作用于心肌细胞及冠状动脉,白介素IL-6、肿瘤坏死因子等明显升高,导致心脏传导和收缩功能异常,促发心律失常[7-12]。(2)增加心脏负荷:肺部感染患者血液中内皮素-1、肾上腺髓质激素浓度增加,导致一过性血管内皮功能异常,进而增加外周血管阻力,增加左心室后负荷[13,14]。同时,炎症反应增加血管加压素分泌,水钠潴留,增加患者的容量负荷[15]。(3)加重心肌缺血:肺部感染导致血浆中炎症因子增多,激活交感神经,释放儿茶酚胺,激活冠状动脉粥样硬化斑块中的炎症反应,导致斑块不稳定及血栓形成,或刺激冠状动脉收缩,引起或加重心肌缺血[16,17]。
慢性阻塞性肺病(COPD)是导致老年患者低氧血症的主要疾病。低氧血症是引起心律失常的重要原因之一。老年慢性肺病伴低氧血症可刺激交感一肾上腺素系统,使儿茶酚胺分泌增多,作用于心肌β受体,造成心肌直接损害;低氧血症往往并发CO2潴留(酸中毒),这些因素可使心肌细胞钾离子减少,钠离子增多,静息膜电位降低,使窦房结、心房、希氏束和蒲氏纤维自律性和兴奋性增高而易发生窦性心动过速和异位心律失常,传导系统的水肿、出血、变性、坏死和纤维化等改变,可导致传导异常[18]。
ECOG(体力状况评分)主要综合考察患者肢体活动及生活自理情况[19],ECOG≤2分的患者生活自理能力较好,白天卧床时间<50%。而ECOG>2分的患者生活自理能力较差,白天卧床时间>50%,甚至长期卧床不起,ECOG评分增高,患者生活自理能力减弱、卧床时间增长,造成免疫力降低、机体功能衰退,易合并感染、营养不良等,致使心肌长期缺血缺氧,心脏电生理出现相应改变,增加心律失常的发生率。
另外,本研究结果还显示年龄、低血红蛋白及EF值降低与老年肿瘤临终患者并发心律失常相关。年龄不是一个独立的危险因素,随着年龄增加,机体各系统的生理功能减弱,免疫功能低下。另外,多种慢性病的发生与年龄均有密切关系,老年患者患慢性疾病较多、器官功能衰退、病程及治疗周期长,且易发生感染[20-22]。随着年龄增加,心房组织功能衰退,同时伴电生理的改变,如心房有效不应期缩短以及窦房结和房室结传导时间延长,增加了心律失常的发生[23]。老年临终患者易出现贫血,临床上常见是由慢性炎症、感染或肿瘤等引起的铁代谢异常的贫血。当血红蛋白低于正常时,血液输送氧气的能力下降,心肌氧供不足,导致心律失常。老年肿瘤临终患者LVEF降低导致心排出量、心肌氧供及收缩力明显降低,心律失常发生率增加。
综上所述,了解老年肿瘤临终患者并发心律失常的危险因素,加强相关因素的监控,控制感染、加强吸氧治疗、纠正贫血及酸中毒、改善冠脉血供、减少心脏负荷并提高心输出量,同时,及时诊断和处理心律失常,减少心律失常的发生,提高老年肿瘤临终患者的生活质量。
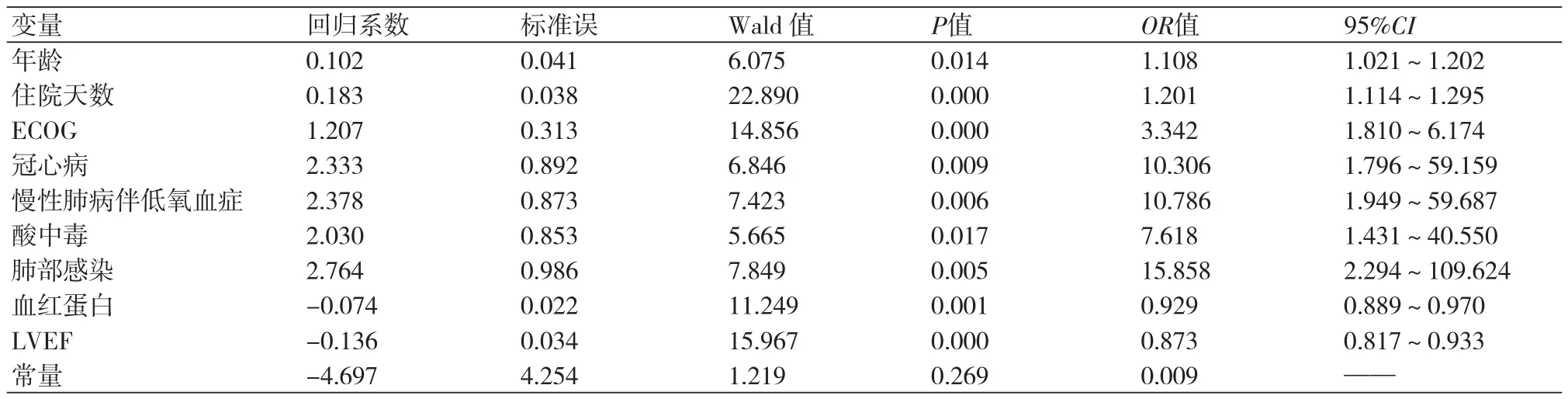
表3 多因素Logistic回归分析结果
[1] 顾竟春,施永兴. 临终关怀的研究和发展现状[J]. 世界肿瘤杂志,2004,3(2):207-10.
[2] 崔以泰. 临终关怀学[M]. 北京:中国医药科技出版社,1992:22-3.
[3] Siegel R,Naishadham D,Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin,2013, 63(1):11-30.
[4] 余悦,周绿林. 关于我国临终关怀发展策略的思考[J]. 医学与哲学,2006,27(1):65-6.
[5] 陆再英,钟南山. 内科学[M]. 第7版. 人民卫生出版社,2008:182-217.
[6] Corrales-Medina VF,Musher DM,Wells GA,et al. Cardiac complications in patients with community-acquired pneumonia:incidence, timing, risk factors, and association with short-term mortality[J]. Circulation,2012,125(6):773-81.
[7] Wasi F,Shuter J. Primary bacterial infection of the myocardium[J].Front Biosci,2003,8:228-31.
[8] Spagnoli LG,Pucci S,Bonanno E,et al. Persistent Chlamydia pneumonia infection of cardiomyocytes is correlated with fatal myocardial infarction[J]. Am J Pathol,2007,170(1):33-42.
[9] Morganroth J,Dimarco JP,Anzueto A,et al. A randomized trial comparing the cardiac rhythm safety of moxifloxacin vs levofloxacin in elderly patients hospitalized with community-acquired pneumonia[J]. Chest,2005,128(5):3398-406.
[10] Antunes G,Evans SA,Lordan JL,et al. Systemic cytokine levels in community-acquired pneumonia and their association with disease severity[J]. Eur Respir J,2002,20(4):990-5.
[11] Mendall MA,Patel P,Asante M,et al. Relation of serum cytokine concentrations to cardiovascular risk factors and coronary heart disease[J]. Heart,1997,78(3):273-7.
[12] Issac TT,Dokainish H,Lakkis NM. Role of inflammation in initiation and perpetuation of atrial fibrillation: a systematic review of the published data[J]. J Am Coll Cardiol,2007,50(21):2021-8.
[13] Schuetz P,Christ-Crain M,Zimmerli W,et al. Repeated measurements of endothelin-1 precursor peptides predict the outcome in community-acquired pneumonia[J]. Intensive Care Med,2011,37(6):970-80.
[14] Schuetz P,Wolbers M,Christ-Crain M,et al. Prohormones for prediction of adverse medical outcome in community-acquired pneumonia and lower respiratory tract infections[J]. Crit Care,2010,14(3):106.
[15] Dreyfuss D,Leviel F,Paillard M,et al. Acute infectious pneumonia is accompanied by a latent vasopressin-dependent impairment of renal water excretion[J]. Am Rev Respir Dis,1988,138(3):583-9.
[16] Corrales-Medina VF,Madjid M,Musher DM. Role of acute infection in triggering acute coronary syndromes[J]. Lancet Infect Dis,2010,10(2):83-92.
[17] Ramirez J,Aliberti S,Mirsaeidi M,et al. Acute myocardial infarction in hospitalized patients with community-acquired pneumonia[J]. Clin Infect Dis,2008,47(2):182-7.
[18] 王吉耀. 内科学[M]. 北京:人民卫生出版社,2005:42.
[19] 陈灏珠,林果为. 实用内科学[M]. 第13版. 北京:人民卫生出版社,2009:172,207.
[20] 李贤卓,阳丽华,蔡海波,等. 老年医院患者5865例院内感染调查分析[J]. 中国现代医学杂志,2004,14(22):111.
[21] 吕大力,张诚,邵文东. 320例脑血管疾病患者医院感染临床分析[J]. 中华医院感染学杂志,2004,14(3):272.
[22] 周素兰. 老年期痴呆患者医院感染危险因素分析及预防措施[J].中华医院感染学杂志,2007,17(4):403-5.
[23] Amar D,Zhang H,Leung DH,et al. Older age is the strongest predictor of postoperative atrial fibrillation[J]. Anesthesiology,2002,96(2):352-6.
