用水热法合成掺杂Pr3+的NiPrxFe2-xO4纳米颗粒及其表征
2014-12-01拜山沙德克BahatDuamet
拜山·沙德克,Bahat Duamet
(1.新疆大学 物理科学与技术学院,新疆 乌鲁木齐830046;2.Kazakh National Technical University Named after K.I.Satpayev,Almaty,Kazakhstan)
1 引 言
铁酸镍是完全反尖晶石结构的铁氧体,它的分子式可写为(Ni2+xFe3+1-x)[Ni2+xFe3+1-x]O4,其中()和[]分别表示A位和B位的金属阳离子,x依赖于加热时间和制备条件[1].NiFe2O4是性能优良的软磁材料,可用作磁头材料、巨磁材料和微波吸收材料[2],而且还是制备性能优良的磁电转换复合材料所选用的磁致伸缩材料[3-4],在电子工业上具有广阔的应用前景.因此,研究铁酸镍的制备及其基本磁性能,不仅具有理论意义,而且还具有实用意义.最近在NiFe2O4中Fe3+离子的位置用如Gd,Dy,Al,Zn和Ce等的阳离子替换的研究显示,制备出来的样品拥有与原NiFe2O4不同的性能[5-7].掺入少量稀土元素会产生铁氧体系统中4f-3d电子之间的耦合,从而改变铁氧体材料的磁性和导电特性.通过稀土元素掺杂各种磁性材料合成优异性能的磁性材料吸引了国内外研究者的关注[8-10].目前稀土元素离子掺杂铁酸镍的报告非常多,但是未见关于镨离子掺杂到铁酸镍的研究报道.本文采用稀土元素化合物Pr(NO3)3·6H2O为掺杂剂,通过水热法制备NiPrxFe2-xO4(x=0.0,0.01,0.025,0.05,0.075,0.1,0.15)纳米颗粒,并表征其磁学性能.
2 实验方法
2.1 实验药品
试剂:硝酸镍 Ni(NO3)2·6H2O(>99%)、硝酸铁 Fe(NO3)3·9H2O(>99.5%)、硝酸镨Pr(NO3)3·6H2O(>99.9%)、氢氧化钠 NaOH(>98%),均为分析纯,未作进一步纯化处理;实验用的溶剂为去离子水(15MΩ·cm).此过程中发生的化学反应方程可以写成为[11]:
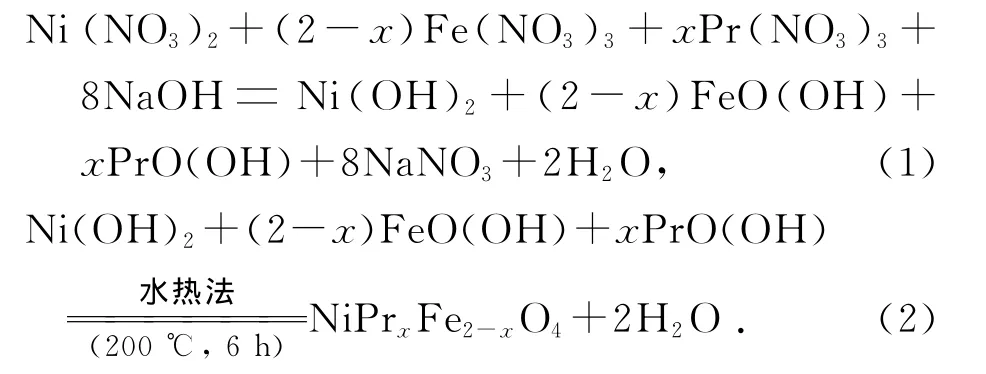
2.2 样品的制备
称取物质的量之比为2:1的Fe(NO3)3·9H2O,Ni(NO3)2·6H2O 粉末溶于45mL的去离子水中,溶解以后再放入Pr(NO3)3·6H2O.这些试剂溶解在50mL的聚四氟乙烯内衬中,最后将8g NaOH倒入已准备好的上述溶液里,剧烈搅拌15min.盖紧后置于钢套中,放在200℃烘箱里反应6h后取出,自然冷却至室温.所得样品用去离子水和无水乙醇清洗5~6次至清洗液pH值为中性,将所得粉末置于80℃的真空干燥箱中干燥6h,获得粉状样品.
2.3 测试条件
粉体样品的物相测试采用日本MAC SCIENCE18kW 转靶X射线衍射仪(XRD),Cu(Kα)靶(λ=0.154 056nm),管电压40kV,管流200mA,连续扫描范围10°~80°.样品的平均尺寸用Scherrer公式D=kλ/(βcosθ)估算,式中的D为纳米颗粒的粒径,k=0.89为Scherrer常量,λ=0.154 056nm为X射线的波长,θ为半衍射角,β为衍射峰的半峰全宽所对应的弧度.样品的成分分析采用JEM-2100的X射线能谱仪(EDS)(牛津INCA Energy)进行测试,利用德国BRUKER公司VERTEXT 70型傅里叶红外光谱仪对样品进行红外光谱分析,样品的形貌和尺寸采用透射电子显微镜(TEM)(日本,Hitachi H-600)进行观测,磁学性能采用振动样品磁强计(美国,Lake Shore VSM 7404)测试.
3 结果与讨论
3.1 物相分析
图1是反应温度为200℃、反应时间为6h的条件下制备出的 NiPrxFe2-xO4(x=0.0,0.01,0.025,0.05,0.075,0.1,0.15)粉 体 的 XRD 谱图.从图中可以看出(0<x≤0.1)时所得到样品的衍射峰的位置在18.364°,30.241°,35.624°,37.28°,43.304°,53.775°,57.26°,62.392°和74.904°处,它们对应的晶面分别为(111),(220),(311),(222),(400),(422),(511),(440)和(533)晶面,与立方相NiFe2O4的PDF标准卡片(JCPDS 10-0325)相符,没有其他杂峰.因此可以初步确认当掺杂量0<x≤0.1时,Pr3+离子成功地掺杂到NiFe2O4尖晶石晶格内.当掺杂量x>0.1(x=0.15)时出现杂峰,即掺杂量超过0.1时形成杂相Pr(OH)3.这可能是由于Pr3+的离子半径(0.101 3nm)比Fe3+离子半径(0.067nm)大得多,导致稀土阳离子Pr3+在NiFe2O4尖晶石晶格内的溶解度受到限制[12],也就是说Pr3+的掺杂量增多(x>0.1)时,无法掺入到NiFe2O4晶格内.从图1中还可以看出,随着掺杂量的增加,衍射峰宽度逐渐变宽,衍射强度逐步降低,这表明平均晶粒尺寸逐渐变小,结晶度变低.
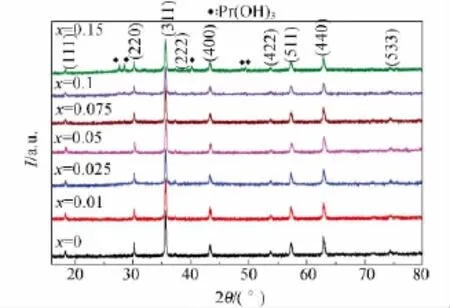
图1 NiPrxFe2-xO4粉体的XRD谱图
为了进一步确定稀土离子Pr3+的掺杂量是否与用XRD测得和估算的量相符,利用X射线能谱仪(EDS)进行测量,结果如表1所示.EDS图谱显示合成的样品有很好的化学均匀性,而且EDS测出来的掺杂量分别为0(x=0.0),0.011 5(x=0.01),0.026 55(x=0.025),0.044 8(x=0.05),0.073 0(x=0.075),0.093 5(x=0.1).图2是掺杂量为x=0.05时样品的EDS图,从图2可以看,样品只含有氧、铁、镍和镨元素.
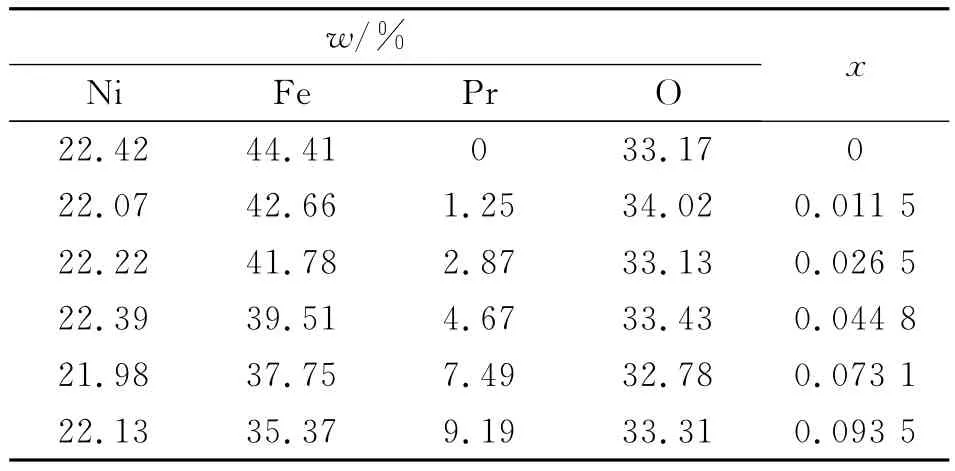
表1 NiPrxFe2-xO4粉体的EDS数据
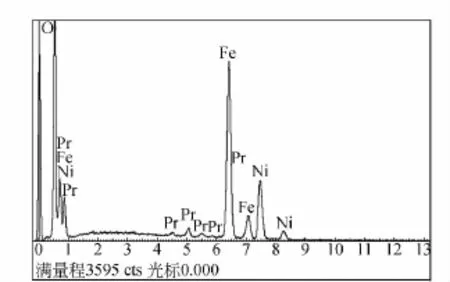
图2 样品 NiPr0.05Fe1.95O4 的 EDS图谱
3.2 红外光谱分析
红外光谱是研究分子动力学、分子的结构和分布非常有效的手段.物质的红外光谱是其分子结构的直接反映,图谱中的吸收峰与分子中各基团的振动形式相对应.反应温度为200℃、反应时间为6h的条件下制备出的NiPrxFe2-xO4(x=0.0,0.05和0.1)粉体的红外光谱图如图3所示.
从图3可以看出在1 340~1 690cm-1的范围内有吸收峰出现,这是尖晶石铁氧体的共同特点[13].较高频率的吸收峰(~ν1)出现在1 340~1 390cm-1的频率范围内,它是四面体金属复合体,这里所谓的四面体金属复合体是氧离子和四面体位置的金属离子之间的键(MTet—O)构成的化合体.而较低频率的吸收峰(~ν2)出现在590~610cm-1范围内,它是八面体金属复合体振动的表现,这里所谓的八面体金属复合体是氧离子和八面体位置的金属离子之间的键(MOct—O)构成的化合体[14].这些峰的位置与铁酸镍纳米晶体的标准红外吸收光谱峰的位置一致[15].吸收光谱峰的位置随着Pr3+离子替代Fe3+离子的位置而变化,也就是说峰位的变化是由 MTet—O和MOct—O键长度的变化引起的[16].
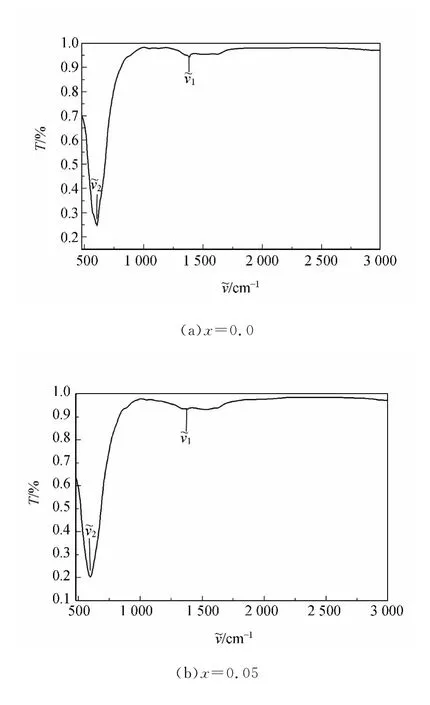
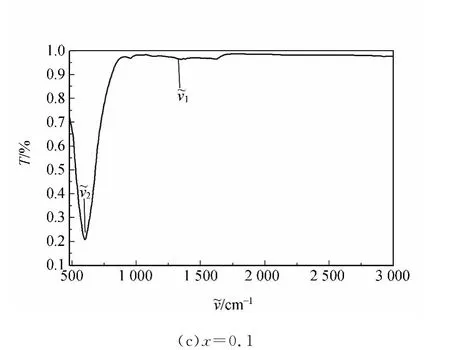
图3 200℃的条件制备出的NiPrxFe2-xO4粉体的红外光谱图
3.3 形貌表征
图4为200℃,6h的条件下制备出来的NiPrxFe2-xO4(x= 0.0,0.01,0.025,0.05,0.075,0.1)颗粒的TEM 图.从图4可以看出实验所得到的样品是纳米级的小颗粒.还可以发现掺杂Pr3+对样品的形貌没有显著的影响,但是对平均晶粒尺寸有较大的影响,即随着掺杂量的增加颗粒的平均尺寸逐渐变小,即47nm (x=0.0),41nm(x= 0.01),36nm (x=0.025),28nm (x=0.05),23nm (x = 0.075),18nm (x=0.1).另外用Scherrer公式估算的晶格尺寸与TEM图中所得到的数值一致.
这是因为Pr3+的离子半径(0.101 3nm)比Fe3+离子半径(0.067nm)大得多,当Pr3+离子替代Fe3+离子的位置时,由于Pr3+离子和Fe3+离子的未配对导致晶体的各向异性,这种各向异性在晶体内部将产生张力,因此系统的状态在晶体各向异性和晶体内张力的相互作用下保持稳定的平衡状态.此张力随着Pr3+离子浓度的增加而增大,所以为了降低晶粒张力,晶体的尺寸随Pr3+离子浓度的增加而减小.颗粒的大小基本上是均匀的.

图4 NiPrxFe2-xO4颗粒的TEM谱图
3.4 磁性分析
样品的磁学性能利用振动样品磁强计(VSM)进行测试.在室温下,外加磁场的最大值调制为7.96×105A/m.样品(NiPrxFe2-xO4)的磁滞回线如图5所示,饱和磁化强度和矫顽力与掺杂量(x)的变化关系如图6所示.
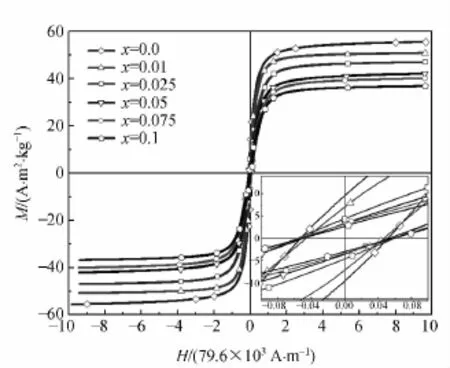
图5 NiPrxFe2-xO4粉体的磁滞回线
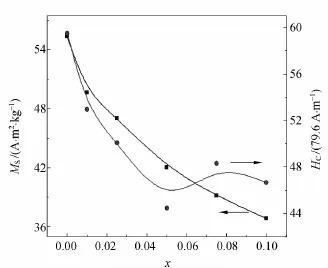
图6 NiPrxFe2-xO4粉体的饱和磁化强度和矫顽力与掺杂量的变化关系
从图6中可以看出当掺杂量x从0增加到0.1时,饱和磁化强度从55A·m2/kg单调减小至37A·m2/kg,矫顽力从4.7×103A/m减小到3.4×103A/m.由于稀土元素在低温(40K)下才能显示出磁性[17],因此饱和磁化强度减小的主要原因是稀土离子Pr3+掺杂到NiFe2O4晶格内的过程实际上是在室温下无磁性的Pr3+离子代替磁性Fe3+离子位置的过程[18].文献[19]提出,掺杂过程中纳米粒子表面的磁性离子间的非平衡交换产生表面上自旋的倾斜.因此铁酸镍纳米颗粒的表面就变成无磁性层或自旋的玻璃类型层,总非磁性层的比例随离子尺寸的增大而变大.所以饱和磁化强度随着掺杂量的增加而降低.
4 结 论
利用水热法在200℃、恒温6h的实验条件下合成出了掺杂Pr3+的 NiPrxFe2-xO4(x=0.0,0.01,0.025,0.05,0.075,0.1,0.15)纳米颗粒.XRD,EDS和IR图谱显示,当掺杂量0<x≤0.1时,Pr3+离子成功地掺杂到NiFe2O4晶格内,但掺杂量x>0.1(x=0.15)时出现杂峰,即随着Pr3+掺杂量的增多,样品中出现杂相.从TEM图中可得知,制备出来的样品的形貌为纳米级的立方体.还可以看出Pr3+掺杂对样品的形貌没有显著影响,但是对平均晶粒尺寸有较大影响,即随着掺杂量从0增加到0.1时,样品的平均晶粒尺寸从47nm减小到18nm.通过磁性分析可以得知,当掺杂量x从0增加到0.1时,饱和磁化强度从55A·m2/kg单调减小至37A·m2/kg,矫顽力从4.7×103A/m减小到3.4×103A/m.饱和磁化强度减小的主要原因是由于室温下无磁性的Pr3+代替NiFe2O4中的Fe3+造成的.
[1]Haneda K,Morrish A H.Noncollinear magnetic structure of CoFe2O4small particles[J].J.Appl.Phys.,1988,63(8):58-4263.
[2]Chen Lingyun,Dai Hong,Shen Yongming,et al.Size-controlled synthesis and magnetic properties of NiFe2O4hollownanospheres viaa gel-assistant hydrothermal route[J].Journal of Alloys and Compounds,2010,491(1/2):L33-L38.
[3]Zhang Dongen,Tong Zhiwei,Xu Gaoyang,et al.Templated fabrication of NiFe2O4nanorods:Characterization,magnetic and electrochemical properties[J].J.Solid State Sciences,2009,11(1):113-117.
[4]Xu Shihong,Shangguan Wenfeng,Yuan Jian,et al.Synthesis and performance of novel magnetically separable nanospheres of titanium dioxide photocatalyst with egg-like structure[J].J.Nanotechnology,2008,19(9):606.
[5]Dixit G,Singh J P,Srivastava R C,et al.Magnetic resonance study of Ce and Gd doped NiFe2O4nanoparticles[J].J.Magn.and Magn.Mater.,2012,324(4):479-483.
[6]Bharathi K K,Vemuri R S,Noor-A-Alam M,et al.Effect of annealing on the microstructure of NiFe1.925Dy0.075O4thin films[J].Thin Solid Films,2012,520(6):1794-1798.
[7]Hemeda D M,Tawfik A,Hemeda O M,et al.Effects of NiO addition on the structure and electric properties of Dy3-xNixFe5O12garnet ferrite [J].Solid State Sciences,2009,11(8):1350-1357.
[8]Mahmoud M H,Sattar A A.M¨ossbauer study of Cu-Zn ferrite substituted with rare earth ions[J].J.Magn.Magn.Mater.,2004,277(1/2):101-105.
[9]Chand J,Kumar G,Kumar P,et al.Effect of Gd3+doping on magnetic,electric and dielectric properties of MgGdxFe2-xO4ferrites processed by solid state reaction technique[J].Journal of Alloys and Compounds,2011,509(40):9638-9644.
[10]Hemeda D M,Tawfik A,Hemeda O M,et al.Effects of NiO addition on the structure and electric properties of Dy3-xNixFe5O12garnet ferrite[J].J.Solid State Sciences,2009,11(8):1350-1357.
[11]Yang Yanmin,Jiang Jing,Li Liangchao,et al.Synthesis and magnetic properties of nano-sized Zn0.6Cu0.4Cr0.5SmxFe1.5-xO4via soft chemistry route[J].J.Rare Earths,2007,25(2):228-231.
[12]Peng Jianhong,Hojamberdiev M.Hydrothermal synthesis and magnetic properties of gadoliniumdoped CoFe2O4nanoparticles [J].J. Magn.Magn.Mater.,2011,323:133-138.
[13]Zhao Lijun,Cui Yuming,Yang Hua,et al.The magnetic properties of Ni0.7Mn0.3GdxFe2-xO4ferrite[J].Mater.Lett.,2006,60(1):104-108.
[14]Waldron R D.Infrared spectra of ferrites [J].Phys.Rev.,1955,99(6):1727-1735.
[15]Ramankutty C G,Sugunam S.Surface properties and catalytic activity of ferrospinels of nickel,cobalt and copper prepared by soft chemical method[J].Appl.Catal.A,2001,218(1/2):39-51.
[16]Rana S,Philip J,Raj B.Micelle based synthesis of cobalt ferrite nanoparticles and its characterization using Fourier transform infrared transmission spectrometry and thermogravimetry[J].Mater.Chem.Phys.,2010,124(1):264-269.
[17]Kambale R C,Song K M,Koo Y S,et al.Low temperature synthesis of nanocrystalline Dy3+doped cobalt ferrite:structural and magnetic properties[J].Appl.Phys.,2011,110(5):053910.
[18]Hutlova A,Niznansky D,Rehspringer J L,et al.High coercive field for nanoparticles of CoFe2O4in amorphous silica sol-gel[J].Adv.Mater.,2003,15(19):1622-1625.
[19]Pillai V,Shah D O.Synthesis of high-coercivity cobalt ferrite particles using water-in-oil microemulsions[J].J.Magn.Magn.Mater.,1996,163(1/2):243-248.
