EDTA返滴定法测定铀钼合金中钼含量
2014-12-01王芸肖吉群
王芸 肖吉群
(中国工程物理研究院,四川 绵阳621900)
0 前言
相对于氧化物核燃料而言,金属型核燃料更易于乏燃料的后处理,并且具备更高的铀密度,使得反应堆能在更低的铀丰度下运行。然而由于金属铀易腐蚀、加工性能不佳、温度变化时金属铀的相稳定性不好,合金化是解决这些问题的主要手段,其中,U-Mo合金就是为此而设计的一种核燃料,近年来一直是核燃料领域的研究热点之一。U-Mo合金的γ相在较宽温度范围内具有良好的稳定性,并且在反应堆运行条件下,该合金也具有较小的辐照肿胀量。
钼含量的多少对U-Mo合金的性能影响显著,因此,在材料制备时必须加以严格控制,由此一来,铀钼合金中钼的准确测定显得尤为关键。对于钼含量的分析测定,通常采用重量法[1]、分光光度法[2]、容量法[3]等。其中技术较为成熟,并且应用较为广泛的是分光光度法,然而,在采用分光光度法分析高钼含量的样品时,方法的灵敏度很难达到预期要求。对于含钼量较高的样品,重量法更为适用,但该方法对于分析过程中的温度控制有较高的要求,且分析过程中钼的回收率也比较低,方法的准确度和精密度难以满足目标需要。众多研究显示,容量法较为适合用来测定高含量钼样品中的钼含量[4-7],实践证明,该方法不仅分析速度快,且重现性和准确性等均能满足要求。
本文采用王水溶解U-Mo合金样品,用磷酸三丁酯-氢化煤油溶液(1+4)萃取分离溶液中的铀离子,在弱酸性环境下,将溶液中的Mo6+用盐酸羟胺(100g/L)还原为 Mo5+,然后准确加入过量的乙二胺四乙酸(EDTA)标准溶液,使 Mo5+与EDTA生成1∶1的稳定络合物,再用二甲酚橙作指示剂,采用浓度为0.01mol/L的锌标准溶液返滴定未参加络合反应的EDTA,进而计算出样品中的钼含量。本文以铀、钼标准溶液配置的溶液为分析对象,详细研究样品用量、盐酸羟铵用量以及还原反应时间等因素对分析结果的影响,以此确定方法的优化条件。
1 实验部分
1.1 主要仪器和试剂
酸式滴定管。
过氧化氢、盐酸、硫酸、硝酸、氨水为分析纯,使用时用去离子水按体积比进行配制。
磷酸三丁酯-氢化煤油(1+4);二甲酚橙溶液(0.2%)。
盐酸羟胺(100g/L):准确秤取10.00g盐酸羟铵,溶解于去离子水中,并在100mL容量瓶中定容,摇匀。
溴甲酚绿乙醇溶液(0.1%):0.1g溴甲酚绿溶于100mL乙醇(20%)中,摇匀。
六次甲基四胺缓冲溶液:称取30g六次甲基四胺,溶解于100mL水中,摇匀。
钼标准溶液(0.01mol/L):准确称取0.250 0g金属钼,溶解于10mL硝酸(1+1)溶液中,并加入少量盐酸,将溶液转移至250mL容量瓶中,用去离子水定容并摇匀,备用。
锌标准溶液(0.01mol/L):准确称取分析纯氧化锌0.406 9g,置于200mL烧杯中,加入10mL盐酸(1+1)溶液,完全溶解后,将溶液加热煮沸5min左右,冷却后,将溶液转移至500mL容量瓶中,用去离子水定容并摇匀,备用。
EDTA标准溶液:准确称取3.723g乙二胺四乙酸二钠(EDTA),在烧杯中用去离子水加热溶解,溶解完全后,将溶液转移至1 000mL容量瓶中,用去离子水定容并摇匀,并用锌标准溶液(0.01mol/L)标定所配EDTA溶液的准确浓度(准确移取20.00mL EDTA标准溶液于250mL烧杯中,加入1滴二甲酚橙指示剂,调节溶液颜色为黄色,加入6mL六次甲基四胺缓冲溶液,用锌标准溶液滴定至溶液由黄色变为紫红色为终点)。
U3O8标准溶液(1mg/mL):准确称取0.250 0g U3O8粉末,采用10mL的 HNO3(1+1)将样品溶解,并在250mL容量瓶中定容摇匀,备用。
1.2 实验方法
称取试样0.025g(精确到0.000 1g)于50mL烧杯中,加入2mL王水和2滴过氧化氢溶解,近干时,加入适量的 HNO3(3mol/L),冷却后,转入萃取管中,并加入3mL TBP-氢化煤油萃取液(20%),振荡2min,离心分离1min,移去有机相,反复萃取三次,取萃取三次后水相液进行后续操作。

式中:C1—EDTA标准溶液的浓度,mol/L;
V1—加入EDTA标准溶液的体积,L;
C2—锌标准溶液的浓度,mol/L;
V2—所耗锌标准溶液的体积,L;
ms—样品质量,g;
95.95 —钼的摩尔质量,g/mol。
准确加入已知过量的EDTA标准溶液于水相中,加入1滴溴甲酚绿乙醇溶液,用氨水(1+1)将溶液调至蓝色,再用硫酸(1+1)将溶液调至黄色并过量3滴,加入过量盐酸羟胺,在低温电炉上加热煮沸使高价钼离子全部还原成 Mo5+,取下稍冷。加入6mL六次甲基四胺缓冲溶液,加入4滴二甲酚橙指示剂,用锌标准溶液(0.01mol/L)滴定,以溶液变为橙红色为滴定终点,按公式(1)计算样品中钼的质量百分含量ωMo。
2 结果与讨论
2.1 返滴定剂及滴定酸度的选择
实验中,过量的EDTA可用二甲酚橙或PAN作指示剂,用铋或锌标准溶液进行返滴定。虽然铋盐与EDTA的稳定常数较锌盐大[8],但在实际操作过程中发现,采用文献中[9]的铋标准溶液进行钼含量测定时,如不严格控制滴定液的pH值,会导致结果发生较大的偏差,且终点变色不明显。
实验表明,在pH值约为5的缓冲体系中,以二甲酚橙作指示剂,采用锌标准溶液进行返滴定,能取得满意的实验结果,因此,选择锌标准溶液作为返滴定剂,通过六次甲基四胺缓冲溶液控制pH=5。
2.2 样品用量选择
化学分析中,一般在不影响分析结果的前提下,取样量越少越好,特别是对于具有放射性的铀钼合金这种样品,化学分析中减少取样量,还有助于减少放射性废物的产生。
表1中列出了不同取样量时,测定钼质量分数约8%的铀钼合金的分析结果。由表1中数据可知,取样量越少,分析结果越接近目标值,造成这种现象的原因是在采用王水进行溶样时,溶液中的钼离子浓度过高时,发生了钼的聚合以致产生少许沉淀,从而影响了测定结果的准确性。由于分析对象主要是钼质量分数小于8%的样品,因此,实验中确定的最小取样量为25mg。当分析更高钼含量的样品时,在样品溶解过程中应充分重视有无钼的聚合沉淀,确保样品溶解完全。

表1 取样量对测定结果的影响Table 1 Effect of sampling amount on the determination results
2.3 盐酸羟胺用量
样品分析过程中,钼的化合价态是影响分析结果的又一重要因素,EDTA只对Mo5+发生1∶1络合反应,因此,样品分析时,采用盐酸羟胺将高价态的钼离子还原至Mo5+态。
图1列出了取样量为25mg时,固定其它试剂用量,在同等还原时间下,盐酸羟胺(100g/L)用量与锌标准溶液(0.01mol/L)用量的关系是锌标准溶液用量越大,说明溶液中的Mo5+离子越少,从而说明高价态的钼离子未被完全还原。由图1可见,当盐酸羟胺用量大于8mL时,锌标准溶液的用量趋于稳定,说明溶液中高价态的钼离子全部还原为Mo5+。为确保还原反应的彻底进行,实验选择盐酸羟胺用量为10mL。
2.4 还原时间
Mo6+离子能否完全被还原为Mo5+的另一个影响因素是反应条件(反应温度和反应时间),对于一般的化学反应,通常采用提高反应温度的方法来加快反应速率。本实验中,采用盐酸羟胺将 Mo6+还原成Mo5+时,也是通过提高反应温度来加快反应速率的,加温的方法是将溶液加热至沸腾并保持一

图1 盐酸羟胺用量与锌标准溶液用量关系图Figure 1 Relationship between the dosage of Zn standard solution and that of Hydroxylamine hydrochloride.
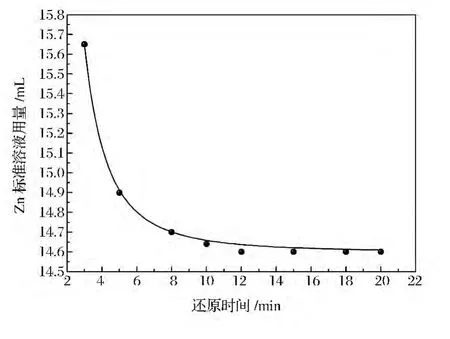
图2 还原时间与锌标准溶液用量关系图Figure 2 Relationship between the dosage of Zn standard solution and reduction reaction time.
通过实验条件优化,最终确定的分析流程为:称取试样0.02~0.05g于50mL烧杯中,加入2mL王水,待试样完全溶解后,加入2mL盐酸(1+1),将溶液转移至分液漏斗中,用20mL TBP-氢化煤油(1+4)将水相萃取三次。然后将水相转移至200mL烧杯中,准确加入10mL EDTA标准溶液、6mL盐酸羟胺(100g/L),并加入1滴溴甲酚绿乙醇溶液,用氨水(1+1)将溶液调至蓝色,再用 H2SO4(1+1)将溶液调至黄色并过量3滴,并用去离子水将溶液定时间。
图2给出了反应时间与锌标准溶液(0.01mol/L)用量的关系。由图2可见,随着反应时间的延长,锌标准溶液的用量逐渐减少,当反应时间大于12min时,逐渐趋于某一稳定值,此时说明Mo6+完全被还原为Mo5+。为了确保分析过程中的还原反应进行彻底,推荐选用的反应时间为15min。稀释至约100mL。将配制好的溶液加热至沸腾并保持15min,待溶液冷却后,用去离子水冲洗烧杯壁,将溶液转移至锥形瓶中,并加入4滴二甲酚橙指示剂,用锌标准溶液(0.01mol/L)滴定过量的EDTA至溶液由黄色变为橙红色。根据公式(1)计算样品中钼的质量百分含量ωMo。
2.5 准确度及精密度实验
准确移取5.00mL钼标准溶液(1.00mg/mL)6份,分别加入100mL U3O8标准溶液,按优化过的实验方法操作,钼的测定结果如表2所示。
表2中同时列出了将前三次和后三次作为平行样测试看待取均值而获得的均值误差,3平行样均值结果与实际加标量相符,优化过的方法的相对标准偏差(RSD)为1.4%。

表2 准确度实验结果Table 2 Results of accuracy tests
2.6 铀钼合金样品分析
将质量分数均为4%的铀、钼粉末采用粉末冶金方法制成铀钼合金,并在同一合金块体的不同位置取样,采用本文所优化的分析方法进行分析,每个样品作3个平行样分析,取平均值作为该样品的分析值,4个样品的测定结果列于表3。测定值与目标值基本一致。
表3 样品测定结果Table 3 The determination results of samples/%
3 结语
采用锌标准溶液(0.01mol/L)作为返滴定剂,详细研究了取样量、还原时间以及盐酸羟铵用量等因素对EDTA返滴定法测定铀钼合金中钼含量的影响,确定了该方法的稳定实验条件,方法的相对标准偏差(RSD)为1.4%。
[1]何美容,罗喜清,陈君 .钼铁中钼的快速分析方法[J].中国无机分析化学,2011,1(3):53-54.
[2]周志伟 .分光光度法测定合金钢中的钼[J].中国无机分析化学,2013,3(2):53-55.
[3]张文娟,梁云生 .铈量法快速测定镍钼矿硫酸介质加压浸出液中的钼[J].中国无机分析化学,2013,3(3):43-46.
[4]迟少婷,王淑敏.EDTA滴定法测定钼铁及其合金中钼[J].理化检验,2003,39(1):52-53.
[5]白小叶 .氧化还原滴定法测定矿石中的钼[J].有色矿冶,2007,23(6):58-61.
[6]孙爱新.EDTA络合滴定法测定钼铁中钼[J].河北冶金,1995(2):57-59.
[7]李广济 .沉淀滴定法快速测定钼酸铵中钼量[J].中国钼业,2006,30(5):31-32.
[8]周丽彬,孙立梅,郑蓉 .铀钼共存体系中低浓度铀和钼的测定[J].湿法冶金,2003,22(2):106-111.
[9]王美玲,王树安,候列奇 .铀钼合金中钼的测定-EDTA容量法[J].中国核科技报告,2005(1):94-99.
