RNA干扰下调HE4基因表达对人卵巢癌SK-OV-3细胞增殖和侵袭的影响
2014-11-30房青王在游嘉詹雪梅杨爱莲魏继红房昭
房青,王在,游嘉,詹雪梅,杨爱莲,魏继红,房昭
卵巢癌是妇科死亡率最高的恶性肿瘤,其发病隐匿,进展迅速,仅有不到 25% 的卵巢癌能在 I期病变局限于卵巢时诊断[1],大多数患者诊断时肿瘤已经扩散或转移,尽管进行了积极的手术和化疗,卵巢癌患者 5年生存率仍不足 30%[2]。人附睾蛋白 4(human epididymis protein 4,HE4),又名 WFDC2(WAP type four disulphide core protein 2),是近年来发现的一个新基因[3],它在正常卵巢组织中不表达,而在卵巢癌组织高表达[4-5],在卵巢癌患者血清中浓度显著增高[6],提示 HE4 可能在卵巢癌的发生发展中起重要作用,HE4 有可能成为卵巢癌辅助诊断和治疗的重要靶标,但是目前对HE4 功能的研究较少。本文利用 RNA 干扰(RNA interference,RNAi)技术,特异性抑制卵巢癌细胞系 SK-OV-3 中 HE4 基因表达,观察 HE4 基因表达下调对卵巢癌细胞增殖和侵袭能力的影响,为卵巢癌侵袭转移的防治提供新的研究线索。
1 材料与方法
1.1 材料
1.1.1 细胞系 人卵巢浆液性囊腺癌细胞系SK-OV-3 购自中国科学院上海细胞生物研究所细胞库。
1.1.2 siRNA 人 HE4 基因特异性小分子干扰RNA(HE4-siRNA)及非特异性序列 siRNA(阴性对照)购自美国 Santa Cruz 公司。HE4-siRNA 根据基因库 GenBank 中人 HE4 mRNA 序列(NM_006103.3,GI:56699494)设计,为 3 个 20 ~25 nt siRNA 双链的混合物,基因序列见表 1。阴性对照 siRNA(目录号 sc-37007),为 20~25 nt非特异序列 siRNA。

表1 人 HE4 基因小分子干扰 RNA(HE4-siRNA)序列Table1 Sequences of small interfering RNA targeted human HE4 (HE4-siRNA)
1.1.3 试剂 胎牛血清购自美国 Hyclone 公司;McCoy’s 5A 培养基和胰蛋白酶购自美国 Gibco公司;脂质体转染试剂 LipofectamineTM2000 和Opti-MEM 培养基为美国 Invitrogen 公司产品;细胞总 RNA 提取试剂盒 RNeasy Mini Kit 购自美国 Qiagen 公司;反转录试剂盒为美国 ABI 公司产品;SYBR Premix Ex Taq 购自日本 Takara 公司;羊抗人 HE4 蛋白多克隆抗体(sc-27570)、兔抗人 β-actin 多克隆抗体、辣根过氧化物酶(HRP)标记的抗羊/兔二抗 IgG 为美国 Santa Cruz 公司产品;增强化学发光试剂 ECL 购自美国 Pierce 公司;细胞计数试剂盒 CCK8 购自日本 Dojindo 公司;人工基底膜基质凝胶 Martrigel 和 Transwell小室(装有碳酸聚酯微孔膜,孔径 8 μm)购自德国 BD Biosciences 公司。
1.1.4 仪器 7700 型实时荧光定量 PCR 仪购自美国 ABI 公司;NanoDrop 2000 超微量分光光度计和 Heraeus Fresc 21 台式高速冷冻离心机为美国 Thermo Scientific公司产品。
1.2 方法
1.2.1 细胞培养 人卵巢癌细胞系 SK-OV-3 用含 10% 胎牛血清的 McCoy’s 5A 培养基,在 37 ℃、5% CO2、饱和湿度条件下培养,为上皮细胞型,贴壁生长。每 2~3 天 用 0.25% 胰酶和 0.02%EDTA 常规消化、1∶3~1∶6 传代培养。
1.2.2 siRNA 脂质体法转染 SK-OV-3 细胞 将对数生长期 SK-OV-3 细胞接种 6 孔板,5×105个细胞/孔,在 37 ℃、5% CO2、饱和湿度条件下培养24 h,细胞密度约 60% 汇合时应用 LipofectamineTM2000 脂质体转染 siRNA。分组如下:①HE4-siRNA组:转染 3 种人 HE4 序列特异性 siRNA 混合物;②阴性对照组:转染非特异性 siRNA;③正常对照组:正常培养 SK-OV-3,未做转染。具体步骤按说明书进行,即用 250 μl 的 Opti-MEM 培养液稀释 siRNA,终浓度为 40 nmol/L;同时取 250 μl的 Opti-MEM 培养液和 5 μl LipofectamineTM2000轻柔混匀,室温孵育 5 min;将以上两种溶液轻柔混匀,室温孵育 20 min。将配制的 siRNALipofectamineTM2000 转染混合液加入到 6 孔细胞培养板中,轻摇混匀,培养 6~8 h 后更换含10% 胎牛血清的 McCoy’s 5A 培养基,培养 48 h后收集细胞。
1.2.3 实时荧光定量 PCR 反应(RT-qPCR)检测HE4 mRNA 表达水平 siRNA 转染 SK-OV-3 细胞 48 h 后,按 RNA 提取试剂盒说明书提取SK-OV-3 细胞总 RNA,使用分光光度计测定RNA 纯度和浓度,取 1 μg 总 RNA 用反转录试剂盒合成 cDNA。采用 Primer 5.0 软件设计引物,HE4 引物序列:上游:5' ATAGCACCATGCCTGCT TGT 3',下游:5' GGGAGTGACACAGGACACCT 3';内参照磷酸甘油醛脱氢酶(GAPDH)引物序列:上游:5' CTGCACCACCAACTGCTTAG 3',下游:5' GAGCTTCCCGTTCAGCTCAG 3',均由上海英骏生物科技有限公司合成。使用实时荧光定量 PCR仪进行 PCR 反应。20 μl 反应体系中包括:SYBR Premix Ex Taq(2 ×)10 μl,上下游引物各 0.8 μl,ROX 参比染料(50 ×)0.4 μl,cDNA 模板 2 μl,无核酸酶水 6 μl。反应条件:95 ℃ 预变性 30 s,95 ℃ 变性 5 s、60 ℃ 退火延伸 30 s,40 个循环。每个样品设 2 个平行管,以 GAPDH 为内参照,记录各样本的循环阈值(cycle threshold,Ct),应用 2-△△Ct分析目的基因的表达量。其中 △Ct =CtHE4– CtGAPDH,△△Ct = △CtHE4-siRNA组或阴性对照组–△Ct空白对照组。
1.2.4 Western blot 检测 HE4 蛋白表达水平 siRNA 转染 SK-OV-3 细胞 48 h 后,Hanks液冲洗细胞 2 次,收集细胞,离心,去上清,细胞沉淀中加入适量的含蛋白酶抑制剂的蛋白裂解液,冰浴裂解 20 min,4 ℃ 条件下,离心半径8.7 cm,以 12000 r/min 离心 20 min,取上清用BCA 试剂盒(Bradforde 比色法)测定蛋白质浓度。行 10% SDS-PAGE 凝胶电泳分离蛋白,将凝胶上的蛋白质转移至 PVDF 膜上。加入含 5% 脱脂奶粉的封闭液室温封闭 2 h 后,分别与羊抗人 HE4一抗(1∶200)或 β-actin 一抗(1∶1000)4 ℃ 孵育过夜,用含 0.05% 吐温 20 的 TBS 缓冲液充分洗膜后,加入辣根过氧化物酶(HRP)标记的抗羊/兔 IgG(1∶10000),室温孵育 1 h,TBS 洗膜后采用增强化学发光显色试剂室温孵育 5 min,X光胶片曝光,拍照。
1.2.5 CCK8 检测细胞增殖活性 卵巢癌SK-OV-3 细胞 siRNA 转染 48 h 后,胰酶消化,制备细胞悬液,接种 96 孔板,3000 个/孔,37 ℃,5% CO2条件下培养不同时间,加入 10% CCK8试剂,继续培养 2 h,酶标仪测定 450 nm 处吸光度值,每组设 5 个平行样,绘制细胞生长曲线。
1.2.6 细胞侵袭性分析 将 Transwell 小室插入24 孔板内,Matrigel 用无血清的 4 ℃ McCoy’s 5A 培养基稀释至 8 μg/ml,取 60 μl 稀释胶加至 Transwell 上室,室温下干燥后,用无血清培养基轻洗凝胶 2 次备用。卵巢癌 SK-OV-3 细胞经 siRNA 转染 48 h 后,胰酶消化,制备浓度为 105/ml 细胞悬液,加入 Transwell 上室,每孔200 μl,培养液为含 0.1% BSA 的 McCoy’s 5A 培养液;Transwell 下室加入 600 μl 含 10% FBS 的McCoy’s 5A 培养液作为趋化因子,37 ℃,5% CO2培养箱中孵育 12 h。取出小室,用湿棉签轻轻擦去上室未穿过滤膜的细胞和 Matrigel 胶,剥下滤膜,常规 HE 染色。正置显微镜(200 ×)观察并拍照,每片膜随机计数 6 个视野内的穿膜细胞数,计算平均值。每组设 3 个平行样。以如下公式计算侵袭抑制率。
侵袭抑制率 =(正常对照组穿膜细胞数 –HE4-siRNA 组穿膜细胞数)/正常对照组穿膜细胞数×100%
1.3 统计学处理
应用 SPSS 13.0 统计软件进行分析。计量资料数据以表示,组间均数比较采用 t 检验,以 P < 0.05 为差异有统计学意义。
2 结果
2.1 HE4-siRNA 可下调人卵巢癌细胞系 SK-OV-3的 HE4 表达水平
实时荧光定量 PCR 结果显示,与未转染的空白对照组相比,HE4-siRNA 转染组SK-OV-3 细胞中 HE4 mRNA 水平明显降低,仅为空白对照组的12.7%(P < 0.01),而转染非特异序列 siRNA 的阴性对照组细胞中 HE4 mRNA 表达水平与空白对照组无显著性差异(P > 0.05)。Western blot 检测结果显示,HE4 蛋白表达水平变化与 mRNA 表达的变化一致(图 1),表明人卵巢癌细胞系 SK-OV-3的 HE4 表达被成功下调。
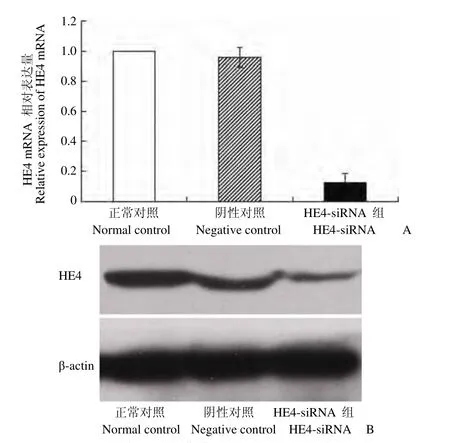
图1 siRNA 转染对卵巢癌 SK-OV-3 细胞中 HE4 表达的影响(A:实时定量检测 HE4 mRNA 表达;B:Western blot检测 HE4 蛋白表达)Figure1 Effect of siRNA transfection on HE4 expression in SK-OV-3 cells (A: The expression of HE4 mRNA detected by real-time quantitative PCR; B: The expression of HE4 protein detected by Western blot)
2.2 HE4-siRNA 下调人卵巢癌细胞系 SK-OV-3的 HE4 表达对细胞增殖的影响
采用 CCK8 试剂检测各组 SK-OV-3 细胞增殖情况,绘制细胞生长曲线,结果显示,与正常对照组相比,HE4-siRNA 转染组 SK-OV-3 细胞增殖被抑制,仅约为正常对照组的 60%,而阴性对照组细胞增殖无显著变化(图 2)。
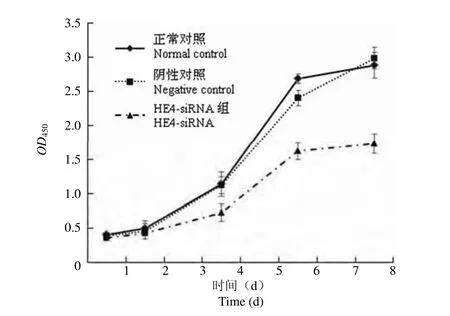
图2 人卵巢癌 SK-OV-3 细胞生长曲线Figure2 Growth curve of human ovarian cancer cell SK-OV-3

图3 Transwell 小室模型检测 siRNA 对卵巢癌 SK-OV-3 细胞侵袭的影响(200 ×)(A:正常对照组;B:阴性对照组;C:HE4-siRNA 组)Figure3 Effect of siRNA transfection on invasive ability of SK-OV-3 detected by Transwell chamber method (200 ×) (A: Normal control; B: Negative control; C: HE4-siRNA)
2.3 HE4-siRNA 下调人卵巢癌细胞系 SK-OV-3的 HE4 表达对细胞侵袭的影响
Transwell 小室体外侵袭实验显示,平均每视野中的穿膜细胞数,正常对照组为(187.4 ±11.17)个,阴性对照组为(177.8 ± 9.76)个,HE4-siRNA 组为(21.8 ± 2.86)个,与正常对照组相比,HE4-siRNA 组穿膜细胞数显著下降(P <0.01),计算侵袭抑制率为(88.3 ± 2.11)%,而阴性对照组和正常对照组两组之间差异无统计学意义(P > 0.05)(图 3,表 2)。

表2 HE4-siRNA 对卵巢癌 SK-OV-3 细胞侵袭的影响Table2 Effect of HE4-siRNA transfection on invasive ability of SK-OV-3 cells
3 讨论
卵巢癌是妇科死亡率最高的恶性肿瘤,美国2012年 22280 人被诊断为卵巢癌,15500 人死亡[2],主要原因是卵巢癌早期无症状,仅有不到25% 的卵巢癌能在 I 期病变局限于卵巢时诊断,大多数患者诊断时肿瘤已经扩散或转移。2003年,Hellström 等[6]发现了一个新的卵巢癌标记物——HE4(WFDC2),它在正常卵巢组织中不表达,而在卵巢癌组织和血清中浓度增高,诊断的灵敏度与CA125 类似,但是在与卵巢良性病变鉴别时特异度比 CA125 更高。
HE4 蛋白核心含有四个二硫键组成的 WAP结构域,含有该结构域的蛋白家族一般具有蛋白酶抑制剂的功能。HE4 最初在附睾上皮被发现,推测其功能可能与精子成熟有关[3]。继而 cDNA 杂交分析和基因表达序列分析(SAGE)显示与正常组织相比,HE4 在卵巢癌组织高表达,提出 HE4 可能是卵巢癌的潜在标记物[4-5]。Hellström 等[6]制备了抗 HE4 的单克隆抗体,建立了检测血清 HE4 的方法,发现卵巢癌患者血清 HE4 水平升高,提出HE4 是一个优秀的血清肿瘤标记物,有助于卵巢癌早期诊断和与卵巢良性病变的鉴别诊断。此后,HE4检测在卵巢癌临床诊治中的研究成为热点,大量研究表明,HE4 是一个优秀的鉴别卵巢良恶性病变的生物标记物[7],荟萃分析显示 HE4 鉴别诊断卵巢癌和良性病变混合灵敏度(pooled sensitivity)为0.74,混合特异度(pooled specificity)为 0.87[8]。因此,2009年,FDA 结合 CA125、HE4 检测和绝经情况提出了恶性肿瘤的风险算法(risk of malignancy algorithm,ROMA),用于盆腔肿物的良恶性鉴别,使用该算法,93.8% 的上皮性卵巢癌被正确鉴别诊断[9]。
近年来的研究发现,HE4 水平与卵巢癌 FIGO分期、分级相关,HE4 水平升高与卵巢癌侵袭性,预后不良和总生存率相关[10-12]。并且 HE4 可用于监测卵巢癌复发,Schummer 等[13]研究表明,晚期卵巢癌,经过手术和化疗,在复发前 4.5 个月即有HE4 升高。Plotti 等[14]的前瞻性病例对照研究显示,当截断值为 70 pmol/L 时,HE4 监测卵巢癌复发的灵敏度为 74%,特异度 100%。
以上对 HE4 的临床研究提示,HE4 可能参与卵巢癌的发生、发展、侵袭、转移、复发等多个环节,但对 HE4 基因功能的研究目前尚罕见。RNA干扰是近年来兴起的研究生物基因表达、调控与功能的一项新技术,小分子干扰 RNA(small interfering RNA,siRNA)是长度为 21~23 个核苷酸的短双链 RNA,能特异性结合、降解细胞内相应序列mRNA,从而阻止或降低 mRNA 的翻译。本研究中,用脂质体法将针对 HE4 基因设计的 siRNA转染人卵巢癌 SK-OV-3 细胞系,通过实时定量PCR 和 Western blot 方法分析细胞内 HE4 mRNA和蛋白表达水平,发现 HE4-siRNA 能有效地特异性下调卵巢癌细胞内 HE4 mRNA 和蛋白表达,进而可以研究 HE4 在卵巢癌发生发展、侵袭转移中的功能。
本研究结果表明,siRNA 特异性下调 HE4 表达后,可显著抑制人卵巢癌 SK-OV-3 细胞增殖,细胞的增殖活力下降约 40%。体外侵袭实验显示,40 nmol/L HE4-siRNA 转染卵巢癌 SK-OV-3 细胞48 h 后,穿膜细胞数由正常对照组的(187.4 ±11.17)个下降为(21.8 ± 2.86)个(P < 0.01),侵袭抑制率为(88.3 ± 2.11)%。而同时转染非特异序列的阴性对照组和正常对照组之间差异无统计学意义(P > 0.05)。以上结果表明,有效下调卵巢癌细胞 HE4 表达后,可显著抑制细胞增殖和侵袭,提示 HE4 可能在卵巢癌发生、发展和侵袭转移的多个环节起重要作用。以上细胞学研究结果与 HE4临床研究相符合。卵巢癌的侵袭和转移是多因素、多步骤协同作用的结果,HE4 在此过程中具体生物学作用和调控机制还有待进一步研究。
综上所述,卵巢癌细胞 HE4 被特异性抑制后,可有效降低人卵巢癌细胞的增殖和侵袭能力,提示HE4 有可能成为卵巢癌转移防治的潜在靶点。
[1] Das PM, Bast RC Jr.Early detection of ovarian cancer.Biomark Med,2008, 2(3):291-303.
[2] Siegel R, Naishadham D, Jemal A.Cancer statistics, 2013.CA Cancer J Clin, 2013, 63(1):11-30.
[3] Kirchhoff C, Habben I, Ivell R, et al.A major human epididymis-specific cDNA encodes a protein with sequence homology to extracellular proteinase inhibitors.Biol Reprod, 1991, 45(2):350-357.
[4] Schummer M, Ng WV, Bumgarner RE, et al.Comparative hybridization of an array of 21,500 ovarian cDNAs for the discovery of genes overexpressed in ovarian carcinomas.Gene, 1999, 238(2):375-385.
[5] Hough CD, Sherman-Baust CA, Pizer ES, et al.Large-scale serial analysis of gene expression reveals genes differentially expressed in ovarian cancer.Cancer Res, 2000, 60(22):6281-6287.
[6] Hellström I, Raycraft J, Hayden-Ledbetter M, et al.The HE4(WFDC2) protein is a biomarker for ovarian carcinoma.Cancer Res,2003, 63(13):3695-3700.
[7] Kondalsamy-Chennakesavan S, Hackethal A, Bowtell D, et al.Differentiating stage 1 epithelial ovarian cancer from benign ovarian tumours using a combination of tumour markers HE4, CA 125, and CEA and patient's age.Gynecol Oncol, 2013, 129(3):467-471.
[8] Lin J, Qin J, Sangvatanakul V.Human epididymis protein 4 for differential diagnosis between benign gynecologic disease and ovarian cancer: a systematic review and meta-analysis.Eur J Obstet Gynecol Reprod Biol, 2013, 167(1):81-85.
[9] Moore RG, McMeekin DS, Brown AK, et al.A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass.Gynecol Oncol, 2009, 112(1):40-46.
[10] Trudel D, Têtu B, Grégoire J, et al.Human epididymis protein 4 (HE4)and ovarian cancer prognosis.Gynecol Oncol, 2012, 127(3):511-515.
[11] Kalapotharakos G, Asciutto C, Henic E, et al.High preoperative blood levels of HE4 predicts poor prognosis in patients with ovarian cancer.J Ovarian Res, 2012, 5(1):20.
[12] Steffensen KD, Waldstrøm M, Brandslund I, et al.Prognostic impact of prechemotherapy serum levels of HER2, CA125, and HE4 in ovarian cancer patients.Int J Gynecol Cancer, 2011, 21(6):1040-1047.
[13] Schummer M, Drescher C, Forrest R, et al.Evaluation of ovarian cancer remission markers HE4, MMP7 and Mesothelin by comparison to the established marker CA125.Gynecol Oncol, 2012, 125(1):65-69.
[14] Plotti F, Capriglione S, Terranova C, et al.Does HE4 have a role as biomarker in the recurrence of ovarian cancer? Tumour Biol, 2012,33(6):2117-2123.
