靶向型辅助腺病毒的构建及其功能研究
2014-11-30杨月峰李泽良鲁茁壮王华肖凤君张群伟孙慧燕王立生
杨月峰,李泽良,鲁茁壮,王华,肖凤君,张群伟,孙慧燕,王立生
腺病毒载体具有宿主范围广、感染效率高、理化性质稳定、易制备高滴度病毒、不整合入细胞基因组等优点,已被广泛应用于肿瘤基因治疗的基础和临床研究[1-3]。但是,第一代重组腺病毒载体存在包装容量小(约 8 kb)、免疫源性强、目的基因表达持续时间短等缺陷,严重阻碍了其临床应用[4-5]。近年来,在第一代重组腺病毒的基础上,逐渐发展了第二代和第三代重组腺病毒载体。
第三代重组腺病毒载体,又称辅助病毒依赖性腺病毒载体(helper-dependent adenoviral vectors,HD-Ad),去除了所有病毒编码基因,仅保留了 5'和 3' 末端反向重复序列(inverted terminal repeat sequence,ITR)和包装信号(ψ)[6]。因此,HD-Ad载体的包装需要辅助病毒提供病毒复制、包装等功能,而且,HD-Ad 载体的血清型由辅助病毒决定,采用不同血清型辅助病毒,可以实现血清型转换[7]。本实验室前期研究表明,具有 Ad5 和 Ad11p 杂合纤维顶球的重组腺病毒 Ad5/F11p 可显著提高对造血细胞,包括 K562、U937、Jurkat 等细胞系以及 CD34+细胞的感染效率[8]。为实现 HD-Ad 对造血细胞的高效感染,本研究将以 Ad5/F11p 为基础,构建相应的辅助腺病毒,并采用该辅助腺病毒包装携带绿色荧光蛋白(green fluorescent protein,GFP)的第三代腺病毒 HD-Ad5/F11p-GFP;最后,在造血细胞中验证其高效感染能力。
1 材料和方法
1.1 材料
1.1.1 细胞、质粒和菌种 人胚肾 HEK293 细胞购自美国标准菌种保藏中心(ATCC),培养于含10% 胎牛血清(FBS)的 DMEM 培养基中;稳定表达 Cre 重组酶的 293 细胞 293Cre4,培养于含10% FBS 和 0.4 mg/ml G418 的 α-MEM 培养基中;人白血病细胞系 K562、U937 和 Jurkat 为本实验室保存,培养于含 10% FBS 的 RPMI 1640培养基中;分离得到的人脐带血 CD34+细胞培养于含 10% FBS 的 IMDM 培养基中。辅助腺病毒H14、重组质粒 pC4HSU-GFP 购自加拿大Microbix 公司;穿梭质粒 pShuttle、大肠杆菌BJ5183 为本实验室保存;重组质粒 pAd5/F11p 为本室构建并保存[8]。
1.1.2 工具酶及主要试剂 T4 DNA 连接酶、PCR 反应混合液、pMD-18T 载体、限制性内切酶Bsp1407 I 和 Bgl II 购自宝生物工程(大连)有限公司;限制性内切酶 Pme I 和 Pac I 购自美国NEB 公司;高保真 DNA 聚合酶 KOD-plus 购自日本 Toyobo 公司;感受态大肠杆菌 DH5α、胶回收试剂盒、质粒小量提取试剂盒、脂质体 2000 购自天根生化科技有限公司;质粒大量提取试剂盒购自德国 Qiagen 公司;磷酸钙转染试剂盒购自美国Promega 公司;FBS 购自美国 Hyclone 公司;α-MEM、IMDM、RPMI 1640、DMEM 培养基购自美国 Gibco 公司;引物合成与测序由北京奥科鼎盛生物科技有限公司完成。
1.2 方法

设计以下 8 条引物(表 1),使用重叠 PCR 方法[10]合成 DNA 序列。具体方法为:将 8 条引物等摩尔混合后,扩增 10 个循环,反应参数为 94 ℃3 min,94 ℃ 30 s,56 ℃ 30 s,68 ℃ 20 s,10 个循环;取出反应产物 2.0 μl 作为模板,采用引物SynES-P1 和 SynES-P2,扩增 25 个循环,反应参数为 94 ℃ 30 s,60 ℃ 30 s,68 ℃ 20 s,25 个循环后 68 ℃ 延伸 5 min,扩增片段长度为 241 bp,命名为 SynES。
1.2.2 含包装信号重组 pShuttle-SynES 质粒的构建和鉴定 将上述扩增获得的 SynES 片段加 A后克隆到 pMD-18T 载体,得到 pMD-SynES,并测序鉴定正确;使用 Bsp1407 I 和 Bgl II 双酶切pShuttle 和 pMD-SynES,分别回收 6600 bp 左右和 240 bp 左右的条带,T4 DNA 连接酶连接,转化 DH5α 感受态细胞,kana+LB 平板筛选获得pShuttle-SynES。以 SynES-P1 和 SynES-P6 为引物,进行 PCR 鉴定,选取正确克隆进行测序鉴定。
1.2.3 辅助腺病毒 Ad5/F11p-HV 的制备和鉴定 Pme I 线性化 pShuttle-SynES 后,与 pAd5/F11p质粒共转化大肠杆菌 BJ5183 感受态细胞,Kana+LB 平板筛选获得重组腺病毒质粒;Pac I 鉴定正确后,采用脂质体 2000 转染对数生长期HEK293 细胞,观察细胞病变情况;当细胞完全病变后,收集细胞和上清,反复冻融 3 次,离心得到病毒上清,即为原始病毒,命名为 Ad5/F11p-HV。
将病毒原液感染 293 细胞后,采用 Hirt 法提取病毒基因组 DNA,采用 SynES-P1 和 SynES-P6引物进行 PCR 鉴定;大量扩增获得病毒粗提液,按照 CsCl 密度梯度离心法纯化腺病毒;采用紫外分光光度法测定病毒颗粒滴度和纯度,采用TCID50法测定病毒的感染滴度。
最后,对纯化获得的重组腺病毒进行透射电镜观察。取纯化的病毒上清 10 μl 滴加到载网上,1 min后取出载网用滤纸吸干病毒液,加磷钨酸染色1 min,用滤纸吸干染色液,自然干燥,即可在电镜下观察。
1.2.4 辅助病毒依赖性重组腺病毒的制备 采用质粒大量提取试剂盒提取携 GFP 的骨架质粒pC4HSU-GFP;取 10 μg 的重组质粒,采用限制性内切酶 Pme I 将其线性化;取含 5 μg pC4HSU-GFP的酶切产物,采用磷酸钙转染试剂盒转染 6 cm 培养皿中 80% 左右融合度的 293Cre4 细胞,于 37 ℃,5% CO2的条件下孵育过夜;转染后第 2 天,更换新鲜、预热的完全培养基,并添加 5 MOI 的辅助腺病毒 Ad5/F11p-HV 或 H14;48 h 后,细胞出现病变现象,当完全病变后,收集细胞和上清,反复冻融 3 次后,离心去除细胞残渣,获得第一代病毒产物 HD-Ad5/F11p-GFP 或 HD-H14-GFP;取4 ml 的病毒产物和 1 MOI 的辅助病毒感染 15 cm培养皿中的 293Cre4 细胞,进一步扩增获得第二代病毒产物;依次扩增到第六代,收集病毒后,进行 CsCl 密度梯度离心,可出现两条带,根据分子量可以确定,HD-Ad5/F11p-GFP 位于下层,辅助病毒 Ad5/F11p-HV 位于上层。

表1 重叠 PCR 合成包装信号序列所需引物Table1 The primers for the synthesis of packaging signal sequences by using overlapping PCR
采用紫外分光光度法测定病毒颗粒滴度和纯度;将 HD-Ad5/F11p-GFP 或HD-H14-GFP 按照不同稀释倍数感染六孔板中的 293 细胞,于感染后48 h,流式细胞术检测 GFP 的表达率,以表达率在 3%~30% 之间的稀释度计算感染滴度,公式为:
感染滴度 =(感染时的细胞数×GFP 阳性率)/ 病毒体积×稀释倍数。
1.2.5 辅助病毒依赖性重组腺病毒对人白血病细胞的感染效率 将人白血病细胞 K562、U937 和Jurkat 以 2×105细胞/孔/0.5 ml 接种 24 孔板,分别加入 2 MOI 和 20 MOI 的重组腺病毒HD-Ad5/F11p-GFP 和 HD-H14-GFP;感染后 24 h,加入 0.5 ml 新鲜的完全培养基;感染后 48 h,流式细胞术检测 GFP 的表达效率。
1.2.6 辅助病毒依赖性重组腺病毒对人脐带血CD34+细胞的感染效率 将肝素抗凝的人脐带血、0.5% 甲基纤维素和 PBS 按照 1∶1∶3 混合后,沉降红细胞,收集上层液体,离心获取细胞;将细胞用 PBS 重悬后,采用 Ficoll 淋巴细胞分离液富集并分离单个核细胞;采用 CD34+细胞磁珠分离试剂盒分离 CD34+细胞。分离得到的 CD34+细胞于 10% FBS 的 IMDM 培养基中培养过夜,将其按照 2×105细胞/孔/0.5 ml 接种 48 孔板,分别加入不同 MOI 的 HD-Ad5/F11p-GFP 或 HD-H14-GFP;感染后 48 h,流式细胞术检测 GFP 的表达效率。
1.3 统计学处理
本实验设计类型为“成组设计定量资料”,统计方法采用 t 检验,以 P < 0.05 表示结果具有统计学差异,P < 0.01 表示具有显著的统计学差异。
2 结果
2.1 重组质粒 pShutt1e-SynES 质粒的构建
采用重叠 PCR 方法成功扩增出含有 A1-A4包装信号和 loxP 序列,长度为 241 bp 的 DNA片段 SynES(图 1A)。将其 3' 端加 A 后,回收相应的 DNA 片段,并与 pMD-18T 载体连接,成功获得重组质粒 pMD-SynES,并测序鉴定正确。Bsp1407 I 和 Bgl II 双酶切 pMD-SynES,获得SynES 片段;将其克隆到 pShuttle 载体的相应位点,经 PCR 鉴定正确(图 1B),表明重组质粒pShuttle-SynES 已成功构建。
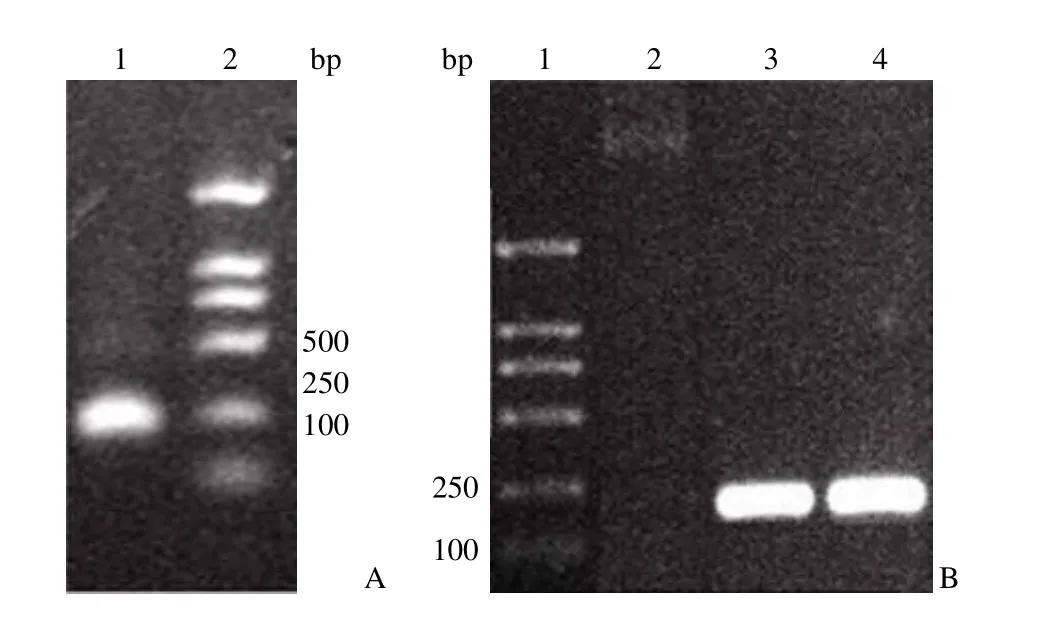
图1 重组质粒 pShuttle-SynES 的构建Figure1 Construction of recombinant plasmid pShuttle-SynES

图2 重组腺病毒 Ad5/F11p-HV 的鉴定Figure2 Identification of recombinant adenovirus Ad5/F11p-HV
2.2 重组辅助腺病毒 Ad5/F11p-HV 的制备
Pme I 线性化的重组质粒 pShuttle-SynES 和pAd5/F11p 共转化大肠杆菌 BJ5183,同源重组,成功获得重组腺病毒质粒 pAd5/F11p-HV,并经Pac I 酶切鉴定。将线性化的 pAd5/F11p-HV 采用脂质体介导的方式转染 293 细胞后,8 d 可见噬斑形成,11 d 出现完全病变,收集获得病毒原液,该病毒命名为 Ad5/F11p-HV。
提取病毒基因组 DNA 后,采用 PCR 方法鉴定病毒基因组 DNA,结果显示,已成功将目的基因克隆到病毒基因组 DNA中(图 2A)。经大量扩增和 CsCl 密度梯度离心后,得到纯化的病毒产物,经负染后电镜观察显示,病毒具有典型的二十面体立体对称,直径约为 80 nm,表面排列有整齐壳粒的腺病毒样离子(图 2B)。采用 TCID50检测,获得病毒的感染滴度为 1×1010IU/ml,感染滴度与颗粒滴度的比值大于 1/50。
2.3 辅助依赖性重组腺病毒的制备
携带 GFP 的骨架质粒载体 pC4HSU-GFP 转染 293Cre4 细胞后,在辅助腺病毒 Ad5/F11p-HV的协助下,制备获得辅助病毒和辅助依赖性腺病毒的混合病毒。将其感染 293 细胞后,荧光显微镜下可见 GFP 的表达,表明已经成功获得了辅助依赖性重组腺病毒 HD-Ad5/F11p-GFP(图 3A)。对其进行扩增后,采用 CsCl 密度梯度离心纯化病毒,可见明显的两条条带,根据分子量判断,下层为目的条带 HD-Ad5/F11p-GFP,上层为辅助病毒Ad5/F11p-HV 条带(图 3B)。
利用辅助病毒 H14 制备并纯化获得了对照病毒 HD-H14-GFP。进一步对其颗粒滴度、感染滴度和纯度进行了鉴定(表 2),结果表明,成功获得合格的病毒产物。由表 2 结果计算可得,扩增获得的HD-Ad5/F11p-GFP 总量为 5.17×1010IU/40 皿,而 HD-H14-GFP 的总量则为 4.32×1010IU/40 皿,表明 Ad5/F11p-HV 包装获得的第三代腺病毒产量更高。
2.4 HD-Ad5/F11p-GFP 对人白血病细胞系的感染效率
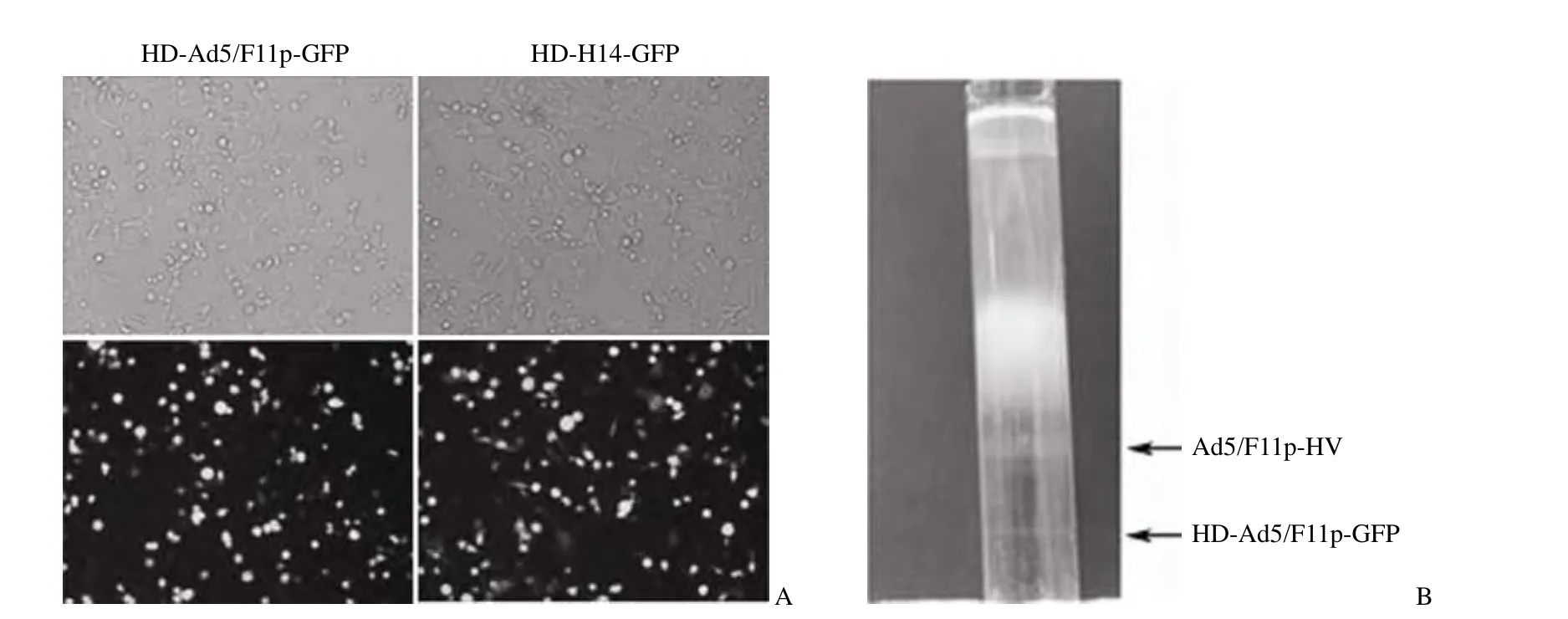
图3 辅助依赖性重组腺病毒的制备和鉴定Figure3 Preparation and identification of helper-dependent adenoviruses

表2 辅助依赖性重组腺病毒的滴度和纯度测定结果Table2 The purity and titers of helper-dependent adenoviruses

图4 流式细胞术检测人白血病细胞系中绿色荧光蛋白的表达Figure4 The expression of GFP, detected by flow cytometry, in cell lines derived from human leukemia
为明确 HD-Ad5/F11p-GFP 对人白血病细胞系的感染效率,将 HD-Ad5/F11p-GFP 和对照病毒HD-H14-GFP 分别以 2 MOI 和 20 MOI 的感染强度感染 K562、U937 和 Jurkat 细胞,结果显示,与 HD-H14-GFP 相比,HD-Ad5/F11p-GFP 可明显提高对人白血病细胞系的感染效率(图 4 和表 3)。
2.5 HD-Ad5/F11p-GFP 对脐带血来源 CD34+ 细胞的感染效率
为明确 HD-Ad5/F11p-GFP 对造血细胞的高效感染能力,以 200 MOI的感染强度感染脐带血来源的 CD34+细胞。48 h 后,流式细胞术检测 GFP的表达效率。共检测了两份标本,结果如图 5 所示,表明 HD-Ad5/F11p-GFP 对 CD34+细胞具有较高的感染效率。

表3 20 MOI 重组腺病毒 HD-Ad5/F11p-GFP或 HD-H14-GFP 感染后 48 h,流式细胞术检测绿色荧光蛋白的表达Table3 The expression of GFP, detected by flow cytometry 48 h post-infection of 20 MOI HD-Ad5/F11p-GFP or HD-H14-GFP, in cell lines derived from human leukemia
3 讨论
第三代重组腺病毒载体由于缺失病毒编码序列,载体的包装能力得到了极大的提高,可达到36~37.3 kb,可以同时表达多个基因、大分子蛋白,甚至可以添加多个基因表达的调控因子,从而进一步拓宽了重组腺病毒载体的应用范围[11-12]。但是,由于第三代腺病毒缺失除包装信号和两端的 ITRs以外的所有腺病毒基因组序列,其壳体的生成和包装均需细胞内的辅助病毒反向提供。由于辅助病毒和第三代腺病毒具有相同的壳体,所以在纯化前必须将两者分离,并尽量减少辅助病毒的包装效率。为此,本研究首先利用不完全包装信号和包装信号的突变减少辅助病毒包装序列;其次,通过Cre/loxP 系统,在辅助病毒包装信号的两侧引入loxP 序列,在包装细胞 293Cre4 中,可通过 Cre酶的表达剪切包装信号,从而减少辅助病毒的包装;第三,构建的辅助腺病毒 Ad5/F11p-HV 的基因组大小为 29444 bp,位于第三代腺病毒的上层,方便通过 CsCl 密度梯度离心分离。

图5 200 MOI 辅助依赖性重组腺病毒感染 CD34+ 细胞后,GFP 表达的流式细胞术检测结果Figure5 The expression of GFP, detected by flow cytometry, in CD34+ cells infected with 200 MOI HD-Ad5/F11p-GFP or HD-H14-GFP
目前已发现超过 50 种血清型的重组腺病毒,其中,5 型腺病毒在基因治疗中的应用最为广泛。5 型腺病毒可特异识别并结合靶细胞表面的柯萨奇病毒-腺病毒受体(coxsackie-adenovirus receptor,CAR),进而进入细胞。但是,造血细胞表面的 CAR表达较低,进而影响其感染效率。B 组腺病毒(包括 Ad3、Ad11p、Ad35 等)可通过识别 CD46 分子进入细胞,而造血细胞中 CD46 分子表达效率高。研究表明,具有 5 型腺病毒和 B 组腺病毒杂合纤维顶球的重组腺病毒 Ad5/F11p、Ad3/5 和Ad5/35 等,对造血细胞的感染效率明显提高[8,13-14]。本研究以 Ad5/F11p 为基础构建了辅助腺病毒Ad5/F11p-HV,包装获得的第三代腺病毒 HD-Ad5/F11p-GFP可明显提高对人白血病细胞系和脐带血CD34+细胞的感染效率。
综上所述,本研究成功构建了辅助腺病毒Ad5/F11p-HV,并采用该腺病毒包装获得具有造血细胞高效感染能力的第三代腺病毒,有望为第三代腺病毒在造血细胞基因治疗中的应用打下基础。
[1] Choi IK, Yun CO.Recent developments in oncolytic adenovirus-based immunotherapeutic agents for use against metastatic cancers.Cancer Gene Ther, 2013, 20(2):70-76.
[2] Raus S, Coin S, Monsurrò V.Adenovirus as a new agent for multiple myeloma therapies: Opportunities and restrictions.Korean J Hematol,2011, 46(4):229-238.
[3] Yao XL, Nakagawa S, Gao JQ.Current targeting strategies for adenovirus vectors in cancer gene therapy.Curr Cancer Drug Targets,2011, 11(7):810-825.
[4] Seregin SS, Amalfitano A.Improving adenovirus based gene transfer:strategies to accomplish immune evasion.Viruses, 2010, 2(9):2013-2036.
[5] Thaci B, Ulasov IV, Wainwright DA, et al.The challenge for gene therapy: innate immune response to adenoviruses.Oncotarget, 2011,2(3):113-121.
[6] Vetrini F, Ng P.Gene therapy with helper-dependent adenoviral vectors: current advances and future perspectives.Viruses, 2010,2(9):1886-1917.
[7] Parks R, Evelegh C, Graham F.Use of helper-dependent adenoviral vectors of alternative serotypes permits repeat vector administration.Gene Ther, 1999, 6(9):1565-1573.
[8] Lu ZZ, Ni F, Hu ZB, et al.Efficient gene transfer into hematopoietic cells by a retargeting adenoviral vector system with a chimeric fiber of adenovirus serotype 5 and 11p.Exp Hematol, 2006, 34(9):1171-1182.
[9] Sandig V, Youil R, Bett AJ, et al.Optimization of the helper-dependent adenovirus system for production and potency in vivo.Proc Natl Acad Sci U S A, 2000, 97(3):1002-1007.
[10] Xiong AS, Yao QH, Peng RH, et al.A simple, rapid, high-fidelity and cost-effective PCR-based two-step DNA synthesis method for long gene sequences.Nucleic Acids Res, 2004, 32(12):e98.
[11] Brunetti-Pierri N, Ng P.Helper-dependent adenoviral vectors for liver-directed gene therapy.Hum Mol Genet, 2011, 20(R1):R7-R13.
[12] Sargent KL, Ng P, Evelegh C, et al.Development of a size-restricted pIX-deleted helper virus for amplification of helper-dependent adenovirus vectors.Gene Ther, 2004, 11(6):504-511.
[13] Yotnda P, Zompeta C, Heslop HE, et al.Comparison of the efficiency of transduction of leukemic cells by fiber-modified adenoviruses.Hum Gene Ther, 2004, 15(12):1229-1242.
[14] Jin J, Liu H, Yang C, et al.Effective gene-viral therapy of leukemia by a new fiber chimeric oncolytic adenovirus expressing TRAIL: in vitro and in vivo evaluation.Mol Cancer Ther, 2009, 8(5):1387-1397.
