MDM2与端粒保护蛋白1的相互作用及其功能
2014-11-29王亚楠金蕊马世良黄君健
王亚楠,金蕊,马世良,黄君健
1.沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866;2.军事医学科学院 生物工程研究所,北京 100850
端粒保护蛋白(protection of telomeres,POT1)位于端粒末端,保护端粒的稳定性[1-2]。在人类细胞中,POT1、TPP1、RAP、TRF1、TRF2和TIN2 形成一个蛋白六聚体,定位于端粒末端,其中POT1 与端粒末端的单链序列TTAGGG 具有很强的结合力,且这种结合具有序列特异性[3-4]。POT1 与其他端粒蛋白一起保护端粒末端,使其区别于DNA 断端,防止被核酸酶分解,抑制ATR 依赖的DNA 损伤反应的发生,POT1 决定人类染色体末端的结构,保护染色体末端避免非同源重组[5]。实验发现,POT1 对端粒长度的调节具有双重作用,既可能延长端粒也可能缩短端粒,表明POT1在细胞中的表达水平对于细胞的生长代谢是非常重要的[6]。
在EBI 网站(http://www.ebi.ac.uk/)搜索,已通过酵母双杂交方法验证与POT1 有相互作用的蛋白很多,如KRT18、AVTN4、ZNF32、GRB、MDM2、MVP等,其中MDM2 是一个E3 泛素化连接酶,细胞水平上MDM2 与POT1 是否有相互作用及MDM2 对POT1是否具有调节功能仍是未知的。
鼠双微体2 同源体(mouse double minute 2 homolog,MDM2,也被称作E3 泛素化蛋白连接酶MDM2)是一个癌基因的编码产物[7-8],由491 个氨基酸残基构成,相对分子质量为56×103。它包含一些保守结构区域,包括N 端P53 结合位点、中心的酸性区域(230~300 残基)、锌指区域和C 端的RING 区域(430~480 残基)[9-10]。MDM2 对P53 肿瘤抑制因子起负调控的作用,一方面它抑制P53 的转录激活[11],同时也作为E3泛素化连接酶,主要通过蛋白酶体途径降解其自身和P53,它识别P53的N 端转录激活区域(TAD)使其降解[12]。研究发现,MDM2基因在人类的许多恶性肿瘤中高表达[13-14]。
探究MDM2与POT1的相互关系,对肿瘤的治疗研究具有一定的指导意义。
1 材料和方法
1.1 材料
HeLa细胞、稳定表达Flag-POT1的HeLa细胞由本实验室保存;蛋白酶体抑制剂MG132、辣根过氧化物酶标记的二抗购自Sigma 公司;LipofectAMINE 2000、LipofectAMINE RNAiMAX、MDM2 siRNA 均购自Invitrogen 公司;MDM2 抗体购自Santa Cruz Biotechnology 公司;Flag 抗体、Myc 抗体购自MBL 公司;GAPDH 抗体购自天津三箭生物技术有限公司;Western 印迹显色试剂盒购自Thermo 公司;核酸电泳系统、蛋白质电泳系统、半干转膜仪均购自Bio-Rad公司;其他试剂均为国产分析纯产品。
1.2 细胞培养
将HeLa 细胞及稳定表达外源Flag-POT1 的HeLa 细胞置于含10%胎牛血清、100 U/mL 青霉素、100μg/mL 链霉素的DMEM 培养液中,于37℃、5%CO2培养箱内培养,每隔2~3 d将细胞传代培养。
1.3 siRNA转染
从Invitrogen 公司购买3 条MDM2 siRNA(MDM2si1、MDM2si2、MDM2si3)及1 条对照siRNA(MDM2sicontrol),按照说明书稀释至5μmol/L;将HeLa 细胞用胰酶消化,用无血清的DMEM 吹打混匀,细胞计数,取约105细胞加入6 孔板的一个孔;分别取siRNA 各3μL 加入500μL 无抗生素无血清的DMEM 中,再分别加入3μL RNAiMAX,混匀,静置20 min,分别加入6 孔板中,混匀,37℃培养箱中培养48 h后收集细胞,Western印迹检测其抑制效果。
1.4 质粒转染
将HeLa 细胞铺6 孔板,当细胞铺板面的70%~80%时瞬转质粒Myc-MDM2 及Flag-POT1,转染程序按照LipofectAMINE 2000 说明书进行,培养48 h后收集细胞。
1.5 Western印迹检测siRNA的抑制效果
收集细胞后,用RAPI 裂解液裂解细胞,提取蛋白质进行SDS-PAGE,然后将蛋白条带转移到硝酸纤维素膜上,用含5%脱脂奶粉的TBST 溶液封闭1 h,一抗孵育2 h,用TBST清洗3次,每次5 min,二抗孵育1 h,用TBST 清洗3 次,每次5 min,按照Western 印迹显色试剂盒说明书显色1~2 min,暗室压片显影。
1.6 免疫共沉淀验证MDM2与POT1的相互作用
收集细胞后,加入中盐IP 缓冲液,冰上裂解30 min,12 000 r/min、4℃离心10 min,将上清转移至新的Ep 管中,取出20%冻存,其余上清备用;取琼脂糖珠Flag-beads(每个样品20μL),用中盐IP 缓冲液平衡,加入IP缓冲液500μL,3000 r/min、4℃离心1 min,弃上清,重复上述操作3 次;将Flag-beads 用IP缓冲液重悬,均分到待用上清液中,用裂解液补足500μL,4℃旋转过夜;用裂解液洗3 次,每次10 min,旋转清洗,3000 r/min、4℃离心2 min,留少量上清,加入5×上样缓冲液煮10 min,电泳上样,后续步骤同Western印迹。
2 结果
2.1 用MG132 处理稳定表达Flag-POT1 的HeLa 细胞
2 皿Flag-POT1 细胞,其中一皿不做处理,另一皿加10μmol/L MG132 处理6 h 后收集细胞,Western 印迹检测,结果(图1)表明Flag-POT1 的表达水平出现明显升高并且有拖尾现象,说明POT1是通过蛋白酶体-泛素化途径降解的。
2.2 MDM2 siRNA对MDM2蛋白的抑制效果
在HeLa 细胞中分别转染MDM2sicontrol、MDM2si1、MDM2si2和MDM2si3,48 h后收集细胞进行Western印迹,实验结果经PS5软件分析,发现3条siRNA 对MDM2 都有不同程度的抑制作用,抑制率分别为35%、40%和88%,MDM2si3 的抑制效果最好(图2)。表明MDM2si3 对MDM2 具有较好的沉默效果,后续实验将用MDM2si3来抑制MDM2的表达。

图1 MG132处理HeLa细胞后Flag-POT1的表达情况
2.3 Flag-POT1与Myc-MDM2的相互作用
3 皿HeLa 细胞,一皿转入Myc-MDM2 质粒,一皿转入Flag-POT1 质粒,一皿用Myc-MDM2 质粒和Flag-beads 质粒共转,48 h 后收集细胞进行免疫共沉淀实验,结果表明POT1与MDM2有较强的相互作用(图3)。
2.4 MDM2对Flag-POT1表达水平的影响
3 皿Flag-POT1 细胞,一皿不做处理,一皿转入Myc-MDM2 质粒,一皿转入MDM2si3,48 h 后收集细胞行Western 印迹,结果表明MDM2 对POT1 的表达水平没有明显的影响(图4)。说明MDM2 虽然与POT1 在细胞水平存在相互作用,但MDM2 不是POT1 的E3 泛素化连接酶,或者说不是主要的E3 泛素化连接酶。
3 讨论

图2 MDM2 siRNA对MDM2蛋白的抑制效果

图3 Flag-POT1与Myc-MDM2的相互作用
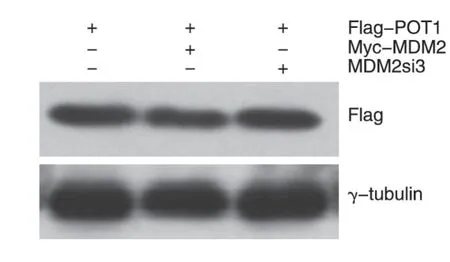
图4 MDM2对Flag-POT1表达水平的影响
POT1 是端粒复合体shelterin 的主要成员,主要与端粒3'端结合,保护端粒的完整性,在许多肿瘤细胞中表达发生异常或基因序列发生突变。与意义未定的单克隆丙种球蛋白病(MGUS)病人相比,多发性骨髓瘤(MM)病人中POT1 的基因表达明显升高,它可能参与MGUS 到MM 的转变过程[15]。胃癌晚期较胃癌早期POT1的表达水平显著升高,其成为恶性程度的标志[16]。在慢性淋巴细胞白血病(CLL)中,Tyr36、Lys90、Gln94 发生突变,使POT1 不能与端粒3'单链结合,导致端粒功能异常[17]。这些表明POT1在肿瘤的发生及发展中起重要作用,成为疾病前期诊断的依据,为设计新的治疗策略的可能分子靶标提供了证据。
研究发现,肿瘤中肿瘤抑制因子P53 发生了突变或表达降低,但仍有约50%的肿瘤表达野生型的P53,而MDM2 通过泛素化途径调节它的活性,使其发生降解,导致肿瘤的形成。抑制MDM2的表达,可以降低前列腺癌细胞的增殖,诱导细胞凋亡,说明MDM2 在前列腺癌生长方面有重要作用[18-19]。抑制MDM2 与P53 的相互作用,成为治疗肿瘤的新的策略。
在本实验中我们发现,POT1 经过蛋白酶体-泛素化途径降解,与E3 泛素化连接酶MDM2 在细胞水平具有相互作用,但无论是高表达MDM2 还是敲除MDM2,POT1 的表达量都没有明显的变化,表明MDM2 不是POT1 的E3 泛素化连接酶或者不是POT1 的主要E3 泛素化连接酶。POT1 与MDM2 在肿瘤的发生发展及诊断治疗中都具有重要的作用,MDM2 与POT1 有明显的相互作用,为研究POT1 与MDM2 其他的功能及肿瘤治疗新的策略提供了重要依据。
[1]Baumann P,Cech T R.POT1 the putative telomere endbinding protein in fission yeast and humans[J].Science,2001,292(5519):1171-1175.
[2]Palm W,de Lange T.How shelterin protects mammalian telomeres[J].Annu Rev Genet,2008,42:301-334.
[3]Lei M,Podell E R,Baumann P,et al.DNA self-recognition in the structure of Pot1 bound to telomeric single-stranded DNA[J].Nature,2003,426:198-203.
[4]Lei Ming,Podell E R.Structure of human POT1 bound to telomeric single-stranded DNA provides a model for chromosome end-protection[J].Nat Struct Mol Biol,2004,11:1223-1229.
[5]Hockemeyer D,Sfeir A J,Shay J W,et al.POT1 protects telomeres from a transient DNA damage response and determines how human chromosomes end[J].EMBO J,2005,24:2667-2678.
[6]Bunch J T,Bae N S,Leonardi J,et al.Distinct requirements for Pot1 in limiting telomere length and maintaining chromosome stability[J].Mol Cell Biol,2005,,25(13):5567-5578.
[7]Oliner J D,Kinzler K W,Meltzer P S,et al.Amplification of a gene encoding a p53-associated protein in human sarcomas[J].Nature,1992,358(6381):80-83.
[8]Wade M,Wong E T,Tang M,et al.Hdmx modulates the outcome of p53 activation in human tumor cells[J].J Biol Chem,2006,281(44):33036-33044.
[9]Kussie P H,Goruna S,Marechal V.Structure of the MDM2 oncoprotein bound to the p53 tumor suppressor transactivation domain[J].Science,1996,274(5289):948-953.
[10]Poyurovsky M V.The Mdm2 RING domain C-terminus is required for supramolecular assembly and ubiquitin ligase activity[J].EMBO J,2007,26:90-101.
[11]Momand J,Zambetti G P,Olson D C,et al.The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation[J].Cell,1992,69(7):1237-1245.
[12]Michael D,Oren M.The p53-Mdm2 module and the ubiquitin system[J].Cancer Biol,2003,13(1):49-58.
[13]Momand J,Jung D,Wilczynski S,et al.The MDM2 gene amplification database[J].Nucl Acids Res,1998,26(15):3453-3459.
[14]Freedman D,Levine A J.Functions of the MDM2 oncoprotein[J],Cell Mol Life Sci,1999,55(1):96-107.
[15]Panero J,Stanganelli C,Arbelbide J,et al.Expression profile of shelterin components in plasma cell disorders clinical signifi cance of POT1 overexpression[J].Blood Cell Mol Dis,2014,52(2-3):134-139.
[16]Kondo T,Oue N,Yoshida K,et al.Expression of POT1 is associated with tumor stage and telomere length in gastric carcinoma[J].Cancer Res,2004,64:523-529.
[17]Ramsay A J,Quesada V,Foronda M,et al.POT1 mutations cause telomere dysfunction in chronic lymphocytic leukemia[J].Nat Genet,2013,45(5):526-532.
[18]Vassilev L T.MDM2 inhibitors for cancer therapy[J].Trends Mol Med,2006,13(1):23-31.
[19]Zhang Zhuo,Li Mao,Wang Hui.Antisense therapy targeting MDM2 oncogene in prostate cancer:effects on proliferation,apoptosis,multiple gene expression and chemotherapy[J].Proc Acad Natl Sci USA,2003,100(20):11636-11641.
