不同浓度卡那霉素、潮霉素对楸树试管苗生长的影响
2014-11-29于永明王军辉麻文俊马建伟张宋智李平英韩云花
于永明 ,王军辉,麻文俊,马建伟,张宋智,李平英,韩云花
1.中国林业科学研究院 林业研究所,国家林业局 林木培育重点实验室,北京 100091;2.甘肃省小陇山林业科学研究所,甘肃 天水 741022
楸树(Catalpa bungeiC.A.Mey.)材质优良,树干挺拔,花色淡红素雅,观赏性高,是珍贵用材及绿化树种,在我国丰富的树木资源中,惟其“材”貌双全,自古素有“木王”之美称。近年来,在楸树生物学特性、开花结实习性、种质资源现状、良种选择、繁殖技术、造林技术等方面都有较为系统的研究。“十一五”期间,珍贵阔叶树种种质创新课题组对楸树种源和无性系选择、目标树选择和培育、立地选择、干形培育、混交林结构调整、密度控制和水肥调控等关键技术进行了深入研究,建立了珍贵用材林定向单株培育的科技创新平台,提高了我国珍贵用材林培育的技术创新能力[1-4]。在楸树组培研究领域,已有研究者对楸树器官的体细胞胚胎发生进行探讨,并取得一定的研究结论[5],但普遍以楸树嫩芽为材料。本珍贵阔叶树种种质创新课题组根据研究结果,已制定了《楸树无性系组培快繁技术规程》地方标准[6]。
抗生素是由微生物或高等动植物在生活过程中产生的具有抗病原体或其他活性的一类次级代谢产物,能干扰其他生活细胞的发育功能。卡那霉素是一种蛋白质生物合成抑制剂,通过与30S 核糖体结合而使mRNA 密码误读,若细菌产生一种破坏卡那霉素的酶,则该菌可变为抗性株,卡那霉素抗性质粒常被作为选择基因或标记基因用于分子克隆[7-8]。潮霉素是一种常用的抗性筛选药物,其抗性基因表达产物是一种蛋白激酶,通过磷酸化潮霉素使其丧失活性。由于在真核和原核生物中潮霉素筛选假阳性率低,重复性好,现在通过潮霉素对转基因生物进行筛选已被广泛应用[9-12]。卡那霉素和潮霉素是目前遗传转化体系广泛应用的2 种抗生素。我们进行了卡那霉素和潮霉素对楸树无性系试管苗生长的影响研究,以确定抗生素对楸树茎段分化和生根的敏感质量浓度,建立有效的遗传转化体系,为楸树特性良种的选育与转化提供重要理论和实践指导。
1 材料与方法
1.1 材料
河南洛阳楸树优良无性系2-8、1-4组培苗由本课题组筛选;卡那霉素与潮霉素均购自Sigma公司。
1.2 楸树无性系生长分化培养
选择生长一致的楸树组培苗,转接到增殖分化培养基上。增殖培养茎段带1 个腋芽,确保诱导分化在同一水平。继代增殖分化培养基为DKW+BA(苄氨基腺嘌呤)1.0 mg/L+IBA(吲哚丁酸)0.2 mg/L+蔗糖25 g/L+琼脂4.5 g/L(pH5.8),以楸树无性系2-8 组培继代瓶苗为材料,在培养基中分别加入0、25、50、100、150 mg/L 的卡那霉素,1、5、10 mg/L 的潮霉素,共8个处理质量浓度;以楸树无性系1-4、2-8 组培继代瓶苗为材料,在培养基中分别加入0、1、5、10 mg/L 的潮霉素,共4个处理质量浓度。每个处理设置3 个重复,每重复接种10 瓶,每瓶接种3 株。所有材料都置于组培室内,组培苗培养温度22~26℃,光照2000 lx,光照时间为14 h/d。
1.3 楸树试管苗生根培养
生根茎段长度为1.5 cm,确保插入培养基茎段部位没有腋芽,以免影响根系的诱导。生根培养基为1/2MS+IBA 0.1 mg/L+NAA(萘乙酸)0.01 mg/L+蔗糖10 g/L+琼脂5.0 g/L(pH5.8),以楸树无性系2-8 组培继代瓶苗为材料,在培养基中分别加入0、25、50、100、150 mg/L 的卡那霉素,1、5、10 mg/L的潮霉素,共8个处理质量浓度;以楸树无性系1-4、2-8 组培继代瓶苗为材料,在培养基中分别加入0、25、50、100、150 mg/L 的卡那霉素,共5 个处理质量浓度。每个处理设置3个重复,每重复接种10瓶,每瓶接种3 株。所有材料都置于组培室内,培养条件同上。
1.4 生长指标的测定
增殖培养40 d 后,统计增殖培养指标,包括增殖芽数、芽长、叶数、接入茎段愈伤组织横向及纵向膨大情况。增殖系数以各处理增殖芽数与芽长的积除以转接茎段长度(1 cm)而得。
生根培养30 d 后统计生根培养指标,包括接入茎段发根数、根长、发芽数、芽长、叶数。
2 结果
2.1 抗生素对楸树继代瓶苗生长的影响
2.1.1 抗生素对楸树无性系2-8 继代瓶苗生长的影响 方差分析显示,经不同质量浓度的抗生素处理,楸树无性系2-8 瓶苗的增殖芽数(P=0.008)、芽长(P=0.000)、愈伤组织横向膨大(P=0.000)、增殖系数(P=0.000)、叶数(P=0.000)、愈伤组织纵向膨大(P=0.000)的差异极显著。多重比较显示(表1),不同质量浓度的抗生素处理对各指标间的差异不同。在培养基中添加抗生素,楸树诱导增殖分化芽均低于对照(质量浓度为0 mg/L);随着质量浓度的增大,呈现出逐渐降低的变化趋势,与对照相比,变化呈负相关。卡那霉素与潮霉素的作用基本相同,随着添加质量浓度的增大都呈负相关。与对照相比,在培养基中添加低质量浓度的潮霉素(1 mg/L)对2-8 的分化指标增殖芽数、叶数及茎段基部愈伤组织的膨大有一定的促进作用,但对分化芽的生长有一定的抑制作用。添加卡那霉素质量浓度为50 mg/L 时叶片开始发黄;当浓度为100 mg/L 时叶片开始发白,叶尖开始干枯,茎段基部愈伤组织基本停止膨大,瓶苗生长缓慢;当浓度为150 mg/L 时叶片大多发白,叶片干枯,茎段基部无愈伤组织形成,瓶苗基本不生长。依此,楸树继代瓶苗的分化芽对卡那霉素的耐受范围为100~150 mg/L。添加潮霉素质量浓度为1 mg/L 时叶片开始发黄;当浓度为5 mg/L 时叶片开始发白,叶片小,茎段基部愈伤组织较小,瓶苗生长缓慢;当浓度为10 mg/L 时叶片开始干枯,茎段基部愈伤组织较小,瓶苗基本不生长。依此,楸树继代瓶苗的分化芽对潮霉素的耐受范围为10 mg/L左右。
2.1.2 潮霉素对楸树无性系1-4 继代瓶苗生长的影响 方差分析显示,经不同质量浓度的潮霉素处理,1-4 瓶苗的增殖芽数(P=0.009)、芽长(P=0.001)、愈伤组织横向膨大(P=0.005)、增殖系数(P=0.002)、叶数(P=0.000)、愈伤组织纵向膨大(P=0.009)的差异极显著。多重比较显示(表2),不同浓度处理对各指标间的差异不同。与对照相比,低质量浓度(1 mg/L)潮霉素对楸树无性系1-4 分化芽数有促进作用,而对其他指标有明显的抑制作用;随着潮霉素质量浓度(5、10 mg/L)的加大,对各指标出现明显的抑制,与对照相比,变化趋势呈负相关。在促进增殖分化芽数方面,潮霉素对无性系1-4 与2-8 的影响一致,说明低质量浓度(1 mg/L)的潮霉素对楸树无性系的继代分化芽数有一定的促进作用。
2.1.3 潮霉素对无性系1-4、2-8 分化差异的影响见表3,同一抗生素对不同无性系间继代分化指标的影响差异不显著,在同等培养条件下,无性系间分化指标的差异主要取决于无性系遗传因素的制约。
2.2 抗生素对楸树生根瓶苗生长的影响
2.2.1 抗生素对楸树无性系2-8 生根瓶苗生长的影响 方差分析显示,在楸树无性系2-8 生根培养基中添加不同浓度的抗生素,对楸树根系诱导有明显的抑制作用,各处理(卡那霉素25、50、100、150 mg/L,潮霉素1、5、10 mg/L)与对照相比,差异极显著(P发根数=0.000、P根长=0.000、P发芽数=-、P芽长=0.000、P叶数=0.000、P生根率=0.000)。随卡那霉素与潮霉素质量浓度的升高,生根率及其他指标生长呈下降趋势。潮霉素质量浓度达5 mg/L 时,生根苗已出现不良生长状况,少部分茎段干枯;浓度为10 mg/L 时,大部分茎段干枯,少部分为绿,茎段未出现芽的分化与根的萌发现象。依此,楸树组培瓶苗生根苗对潮霉素的耐受范围为5~10 mg/L。卡那霉素质量浓度达50 mg/L 时,生根苗已出现不良生长状况,生根诱导率基本是对照的一半;浓度为100 mg/L 时,大部分茎段干枯,少部分为绿但未分化芽与根;浓度为150 mg/L 时,大部分茎段干枯,极少部分上部为绿,基部干枯,但未分化芽与根。依此,楸树组培瓶苗生根苗对卡那霉素的耐受范围为100~150 mg/L。
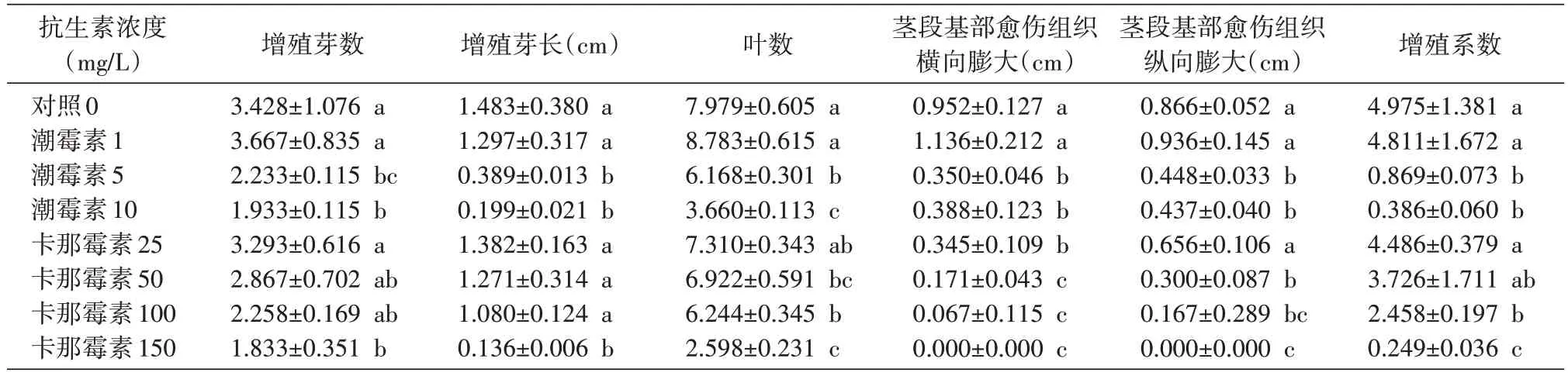
表1 不同质量浓度的潮霉素和卡那霉素对2-8组培苗继代分化的影响
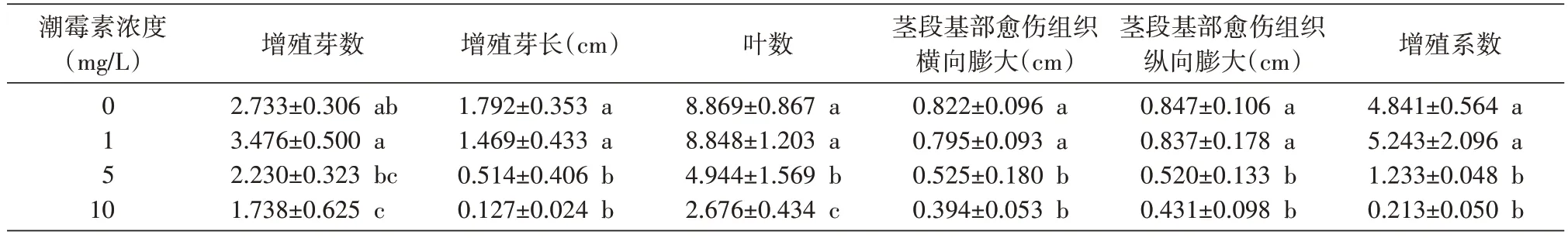
表2 不同质量浓度的潮霉素对1-4组培苗继代分化的影响

表3 不同质量浓度的潮霉素对楸树无性系2-8、1-4生根苗培养性状的影响方差分析(P值)
2.2.2 卡那霉素对楸树无性系1-4 生根瓶苗生长的影响 在楸树无性系1-4 生根培养基中添加卡那霉素25、50、100、150 mg/L,与对照相比,差异极显著(P发根数=0.000、P根长=0.000、P发芽数=-、P芽长=0.000、P叶数=0.000、P生根率=0.000),影响趋势与2-8 类似,随抗生素质量浓度的升高,各生长指标受到明显抑制。当卡那霉素浓度达100 mg/L 时,茎段部分为绿,部分干枯,茎段无发根发芽情况;浓度为150 mg/L 时,茎段基本全部干枯,仅极少数为绿,但未分化芽与根。
2.2.3 卡那霉素对无性系1-4、2-8 生根差异的影响 由表6 可知,不同质量浓度的卡那霉素对楸树无性系2-8、1-4 生根苗培养性状的影响相同,不同无性系间并无差异,说明在楸树无性系生根培养基中添加卡那霉素对生根培养性状的抑制有普适性。
3 讨论
生物体对周围环境都有一定的适应性,当环境处于逆境时,生物体会对逆境产生一定的抗性,逆境强度决定了生物体能否生存。抗生素与盐胁迫、低温胁迫、病害等的发生类似,也是一种逆境胁迫。在植物遗传转化体系中,不同植物、不同材料对抗生素的敏感性不同。因此,进行选择性抗生素的抗性试验并筛选出适宜浓度,是转基因进行的前提[13]。在抗生素的选择上,卡那霉素与潮霉素较为常用,卡那霉素的应用更为普及。
本试验结果表明,卡那霉素对楸树组培苗生长有明显的抑制作用,且与作用浓度呈负相关。潮霉素与卡那霉素对楸树瓶苗的影响基本类似,但低质量浓度(1 mg/L)的潮霉素对继代芽的分化有促进作用,抗生素对植物组培材料的分化有促进作用还未见报道。潮霉素对楸树无性系2-8、1-4组培继代分化各生长指标影响相同,说明试验结论并非偶然,楸树无性系继代培养过程中,培养前期主要为茎段基部的愈伤组织膨大,随着愈伤组织的形成与膨大,其他指标也开始迅速增长,当愈伤组织膨大到一定程度(一般在培养30~40 d)时开始褐化干枯,潮霉素可能阻止了愈伤组织释放的酚类物质的氧化,延缓楸树茎段基部愈伤组织的褐化干枯,提高芽的分化,其内在机理还有待深入研究。楸树供试无性系对卡那霉素与潮霉素的耐受浓度一致,同等质量浓度的抗生素对2 种无性系的作用无显著差异,敏感浓度相同,在杨树[14]研究中涉及了不同树种,表明耐受浓度不同,无性间还未见有其他研究报道。
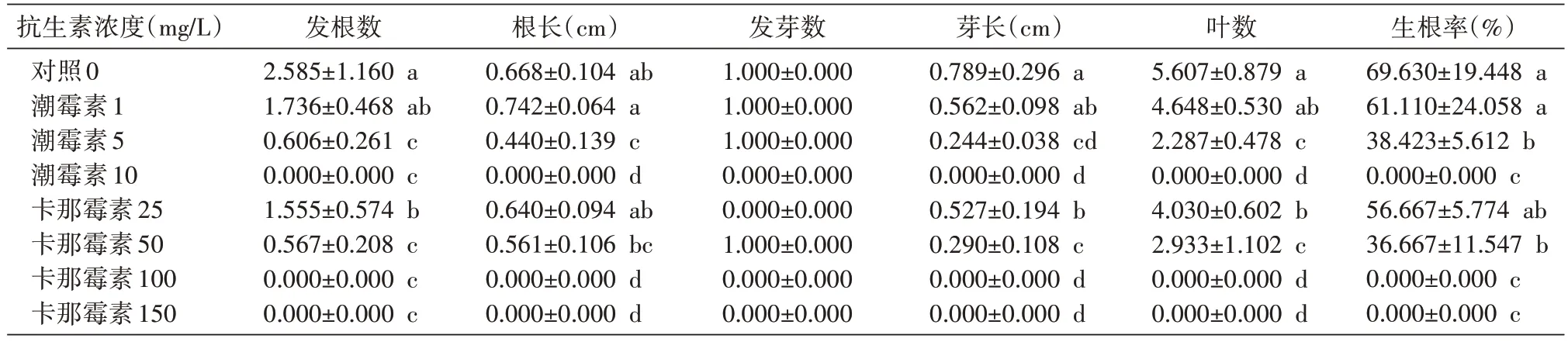
表4 不同质量浓度的潮霉素和卡那霉素对楸树无性系2-8生根苗培养性状的影响
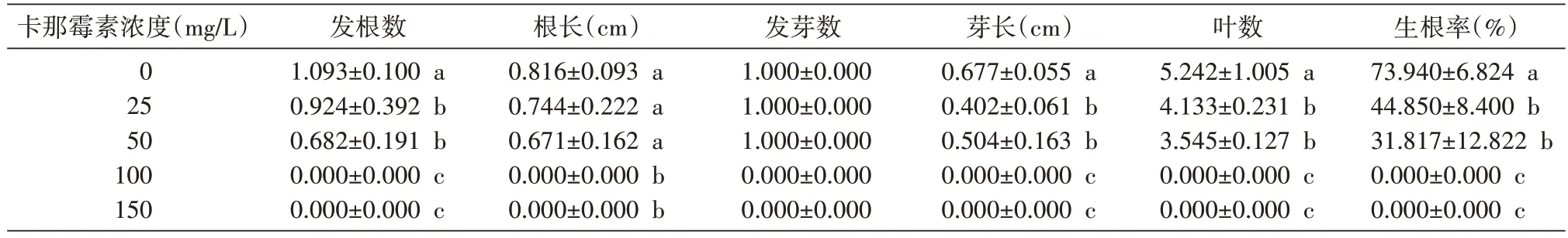
表5 不同质量浓度的卡那霉素对楸树无性系1-4生根苗培养性状的影响
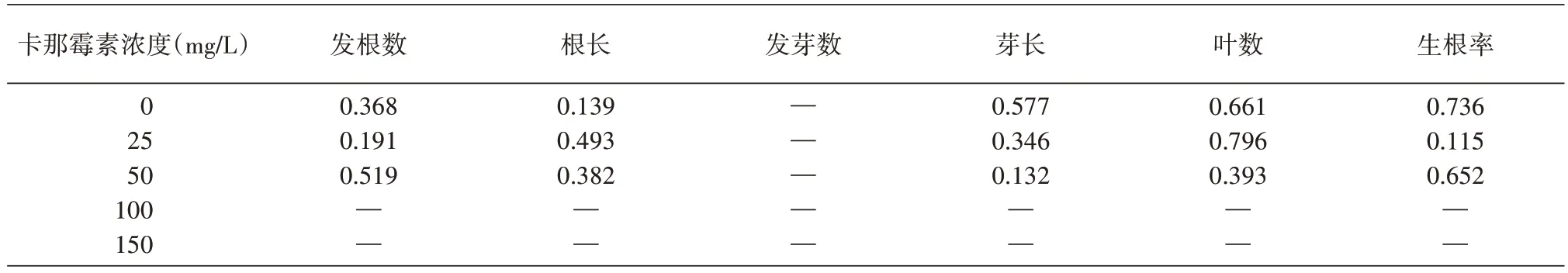
表6 不同质量浓度的卡那霉素对楸树无性系2-8、1-4生根苗培养性状的影响方差分析(P值)
近年来,关于植物抗生素耐受性研究应用取得了一定的进展,以组培手段选择抗生素耐受浓度在菊花、烟草、杨树、川芎、黄瓜、大豆、苹果[13-22]等植物中有研究报道,选择的抗生素主要为卡那霉素与潮霉素。研究表明,抗生素对植物组培生长有明显的抑制作用,本试验结果与之吻合。不同植物、不同材料、不同培养阶段的耐受浓度不同,大多植物材料对卡那霉素的敏感浓度为5.0~100 mg/L。30 mg/L 卡那霉素能够明显抑制菊花茎段的分化,10 mg/L 能够抑制生根[15];卡那霉素与潮霉素对烟草叶片的分化抑制浓度均为30 mg/L[16];杨树叶片、茎段对潮霉素的敏感浓度为1.0~6.0 mg/L[14,17],叶片对卡那霉素素的敏感浓度为20~40 mg/L[14,17-18];川芎的根、茎、叶对卡那霉素的耐受浓度为20~40 mg/L[13];以黄瓜种子为供试材料,魏爱民等研究认为,200 mg/L 的卡那霉素能够抑制黄瓜幼苗的生长。本试验研究材料为楸树茎段,研究结论与大多研究报道基本一致。综合来看,种子与茎段对抗生素的耐受性质量浓度稍高,叶片较低;植物对卡那霉素的耐受浓度高于潮霉素,这也说明潮霉素对楸树组培苗的毒性较大。卡那霉素是目前应用较为广泛的选择抗生素,在植物组培应用筛选技术基本成熟的同时,也逐渐应用于田间转基因植株的筛选,这在苜蓿、棉花、大豆、番茄、水稻、小麦等作物中有研究报道[19]。
蒋卫东[13]等认为,遗传转化体系中的筛选剂必须是植物细胞的抑制剂,但不可杀死细胞,转化体系过程中低毒性化合物的选择效果优于高毒性化合物,当选择剂对植物细胞具有强毒害时,细胞将快速死亡,死亡或将死细胞对邻近的细胞将产生抑制作用,使邻近转化细胞也受到抑制[20]。依此机理,作为选择性抗生素,卡那霉素的毒性远远低于潮霉素,王丹[14]等对杨树的研究也得到同样结论,这也与本试验结论一致。不同植物对抗生素的敏感性不同,这只是在少部分植物研究中有结论,大部分研究报道在抗生素选择上局限于同一抗生素不同浓度的筛选,很少有不同抗生素针对同一植物的选择研究。有必要拓展相关研究领域,为植物遗传转化体系奠定扎实的理论基础与实践经验。
[1]于永明,王军辉,马建伟,等.LaCl3对楸树无性系试管苗生长的影响[J].东北林业大学学报,2011,39(1):31-33.
[2]于永明,王军辉,张宋智,等.二次回归正交设计在楸树离体生根培养中的应用[J].南京林业大学学报(自然科学版),2011,35(4):47-50.
[3]于永明,王军辉,马建伟,等.楸树无性系离体培养特性差异研究[J].西北植物学报,2012,32(1):199-204.
[4]于永明,王军辉,麻文俊,等.同一离体培养下梓树属不同种的反应差异[J].东北林业大学学报,2013,41(12):17-20.
[5]江荣翠,彭方仁,谭鹏鹏,等.楸树体细胞胚胎发生的研究[J].南京林业大学学报(自然科学版),2010,34(2):15-18.
[6]甘肃省质量技术监督局.楸树无性系组培快繁技术规程[S].DB62/T 2013-2011,2011-01-11.
[7]王坤波,张香娣,刘方,等.子叶期卡那霉素快速鉴定转基因棉花[J].中国棉花,2001,(2):20-21.
[8]王紫萱,易自力.卡那霉素在植物转基因中的应用及其抗性基因的生物安全性评价[J].中国生物工程杂志,2003,23(6):9-13.
[9]Pettinger R C,Wolfe R N,Hoehn M M,et al.Preliminary studies on the production and biological activity of a new antibiotic[J].Antibiot Chemother,1953,3:1268-1278.
[10]Gritz L,Davies J.Plasmid-encoded hygromycin B resistance:the sequence of hygromycin B phosphotransferase gene and its expression in Escherichia coli and Saccharomyces cerevisiae[J].Gene,1983,25(2-3):179-188.
[11]Kaster K R,Burgett S G,Rao R N,et al.Analysis of a bacterial hygromycin B resistance gene by transcriptional and translational fusions and by DNA sequencing[J]Nucleic Acids Res,1983,11(19):6895-6911.
[12]Rao R N,Allen N E,Hobbs J N Jr,et al.Genetic and enzymatic basis of hygromycin B resistance in Escherichia coli[J].Antimicrobial Agents Chemother,1983,24(5):689-695.
[13]蒋卫东,唐琳,杨苍劲,等.卡那霉素对川芎愈伤组织诱导和生长的影响[J].河南农业科学,2007,(11):85-87.
[14]王丹,邹莉,王义,等.杨树对潮霉素的敏感性研究[J].吉林农业大学学报,2010,32(1):47-50.
[15]王沛,周洲,尹新明,等.不同质量浓度抗生素对菊花‘绿鹦哥’茎段组织培养的影响[J].河南农业大学学报,2010,44(1):96-99.
[16]李胜彬,胡根海,王清连.烟草叶片直接再生植株及抗生素耐受性研究[J].种子,2010,29(4):38-39.
[17]邹莉,王丹,赵光洁,等.单倍体小黑杨对潮霉素的敏感性研究[J].林业科技,2008,33(4):7-9.
[18]程贵兰,蔡智军.卡那霉素对小黑杨花粉植株叶片分化及试管苗生根的影响[J].辽宁农业职业技术学院学报,2010,12(2):3-4.
[19]燕丽萍,夏阳,梁慧敏,等.卡那霉素叶片涂抹法田间筛选转基因苜蓿的研究[J].中国农学通报,2009,25(14):22-26.
[20]魏爱民,张文珠,杜胜利,等.黄瓜花粉管通道法抗虫基因导入及卡那霉素抗性筛选[J].华北农学报,2008,23(6):54-57.
[21]袁鹰,刘德璞,王玉民,等.卡那霉素对大豆生长的抑制及筛选试验研究[J].大豆科学,2003,22(4):261-263.
[22]梁海永,姚伟明,杜鸿云,等.苹果叶片再生体系建立研究[J].河北林果研究,2005,20(3):247-249.
