DNA甲基转移酶1、3A和3B在低氧预适应小鼠大脑中的表达
2014-11-28周成江姜树原黄丽华吕国蔚张颜波吉训明
周成江,张 姝,姜树原,黄丽华,吕国蔚,张颜波,吉训明,邵 国,,*
(1.包头医学院 生物医学研究中心 基础医学部, 内蒙古 包头 014010;2.首都医科大学低氧医学研究所,北京 100069; 3.泰山医学院 附属医院 神经内科, 山东 泰安 217000; 4.首都医科大学附属宣武医学院 低氧医学研究所, 北京 100053)
研究论文
DNA甲基转移酶1、3A和3B在低氧预适应小鼠大脑中的表达
周成江1#,张 姝1#,姜树原1,黄丽华1,吕国蔚2,张颜波3,吉训明4,邵 国1,2,4*
(1.包头医学院 生物医学研究中心 基础医学部, 内蒙古 包头 014010;2.首都医科大学低氧医学研究所,北京 100069; 3.泰山医学院 附属医院 神经内科, 山东 泰安 217000; 4.首都医科大学附属宣武医学院 低氧医学研究所, 北京 100053)
目的研究DNA甲基转移酶(DNMT)1、3A和3B在低氧预适应小鼠大脑中的变化,探讨低氧预适应形成过程中DNMTs的变化与脑保护作用的关系。方法小鼠随机分成常氧组(H0)、低氧1次组(H1)或4次组(H4),取大脑皮质组织,应用实时定量PCR 技术、免疫印迹技术和DNA甲基转移酶活性检测DNMT1、DNMT3A和DNMT3B mRNA和蛋白质及DNMT活性。结果H1组和H4组DNMT3A和DNMT3B的mRNA和蛋白质水平较H0组显著降低(Plt;0.05),H4组DNMT活性较H0组降低(Plt;0.05)。结论DNMT3A和3B水平及DNMT活力的变化可能与低氧预适应小鼠获得脑保护的关系密切。
低氧预适应;大脑;DNA甲基转移酶;小鼠
低氧预适应的细胞组织机制的理论于上世纪60年代被提出[1],这种组织和细胞机制是在极端条件下,细胞面临生死抉择时的基因表达的变化,而调控这些基因变化很可能涉及表观遗传学。表观遗传学指基因在不改变序列情况下如何与环境相互作用产生特定的表型[2]。低氧耐受的内源性机制很可能是组织细胞在低氧特定环境下基因表达的变化。DNA甲基化是表观遗传修饰的一种重要方式,催化该反应的酶为DNA(胞嘧啶-C5)甲基转移酶(DNMT)。研究显示DNMT1的蛋白水平降低可以保护神经元的缺血损伤[3]。因此DNMTs很可能是极端条件下细胞面临生死抉择时调节基因表达的重要分子。本研究利用急性重复低氧小鼠模型,研究成年小鼠大脑皮质组织DNMTs的变化,探讨其与神经细胞保护的关系。
1 材料与方法
1.1 动物及试剂
清洁级18~22 g雄性昆明小鼠(6~8周)内蒙古大学实验动物中心,合格证号:SCXK(蒙)2002;trizol,superscript Ⅲ(Invitrogen 公司);2× real-time PCR Mix(Roche公司);兔源DNMT、DNMT3A和DNMT3B多克隆抗体(Santa Cruze公司);鼠源β-actin单克隆抗体(Sigma公司);辣根过氧化物酶标记羊抗兔二抗和驴抗鼠二抗(北京博奥森生物技术有限公司);BCA 试剂(Pierce公司);EpiQuik Nuclear Extraction Kit和EpiQuik DNMT activity/inhibition assay Ultra kit(Epigentek公司);其余试剂为国产试剂。
1.2 动物模型复制
将小鼠随机分为3组: 对照组(H0), 低氧1次组(H1)和 低氧4次组(H4)。低氧4次组的低氧耐受时间为(78.7±7.9)min,显示成功复制了急性重复低氧小鼠模型。低氧结束后立即断头取大脑皮质组织,-70 ℃冻存备用。
1.3 RNA提取及实时定量PCR
按照说明书方法提取小鼠大脑皮质总RNA,紫外分光光度计检测RNA纯度和含量。取2 μg RNA按照反转录反应试剂盒进行反转录PCR,得到20 μL cDNA产物-20 ℃保存。使用ABI的96孔板进行PCR反应,每孔依次加入2×real-time PCR Mix 12.5 μL,cDNA 1 μL,上游和下游引物各1 μL(引物序列见下表),加双蒸水至25 μL,在ABI 7900 real-time PCR反应仪上反应,每个样本设3个复孔。反应参数:94 ℃预变性3 min,再进行92 ℃,30 s;54.5 ℃,35 s;72 ℃,30 s(40 cycles),最后72 ℃延伸5 min停止反应。实时定量PCR结果以ΔΔCT法计算,用均数±标准差表示数值。
1.4 免疫印记
使用RIAP缓冲液裂解皮质组织, 用BCA试剂测定蛋白含量, 通过电泳缓冲液调整各组含量为4 μg/μL,每个样本上样量为80 μg, 在10% 聚丙烯酰胺凝胶(SDS-PAGE)进行电泳后转移至聚偏二氟乙烯膜(PVDF膜), 预染蛋白标准分子质量确定蛋白分子质量标准位置。 用含10%脱脂奶粉Tris Tween盐缓冲液(TTBS)液封闭, TTBS洗10 min×3;加入1抗,4 ℃振荡孵育过夜,TTBS洗10 min×3;1比10 000加入辣根过氧化物酶标记相应的二抗,37 ℃振荡孵育1 h, TTBS洗10 min×3;按Pierce公司的ECL试剂盒进行荧光显色反应。暗室中曝光,显影,定影。用分析软件bandscan分析每个条带的吸光度值,以目的蛋白丰度/β-actin蛋白吸光度比值的均数±标准差来表示。
1.5 DNMT活力实验
按照试剂盒说明提取核蛋白及检测小鼠大脑皮质组织DNMT活力。
1.6 统计学分析
结果以均数±标准差表示,用SPSS10.0数据统计软件ANOVA和Tukey对组间数据进行处理和分析。
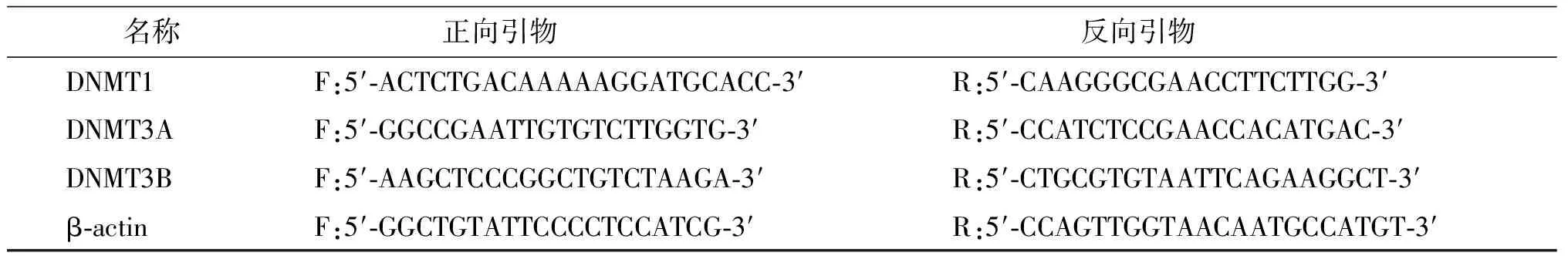
名称正向引物反向引物DNMT1F:5′⁃ACTCTGACAAAAAGGATGCACC⁃3′R:5′⁃CAAGGGCGAACCTTCTTGG⁃3′DNMT3AF:5′⁃GGCCGAATTGTGTCTTGGTG⁃3′R:5′⁃CCATCTCCGAACCACATGAC⁃3′DNMT3BF:5′⁃AAGCTCCCGGCTGTCTAAGA⁃3′R:5′⁃CTGCGTGTAATTCAGAAGGCT⁃3′β⁃actinF:5′⁃GGCTGTATTCCCCTCCATCG⁃3′R:5′⁃CCAGTTGGTAACAATGCCATGT⁃3′
2 结果
2.1 mRNA的检测
各组间未见DNMT1 mRNA有差异,H0组DNMT3A 和DNMT3B mRNA高于H1和H4组(表1)。
2.2 DNMT蛋白的检测
各组间未见DNMT1 蛋白表达有差异。H1组和H4组较H0组DNMT3A和DNMT3B显著性降低 (Plt;0.05)(图1)。
2.3 DNMT活性的检查
H0组、H1组和H4组大脑皮质组织中DNMT的活性,H0组的活性为0.33±0.018, H1组的活性为0.31±0.023,H4组的活性为0.29±0.010(Plt;0.05, H4vsH0,n=6),急性重复低氧预适应使DNMT的活性降低(图2)。
3 讨论
急性重复低氧预适应小鼠的显著特征是低氧耐受时间呈线性增加[4-7],同时伴有大量基因表达的改变[6]。研究发现还低氧预适应可以使小鼠空间学习记忆能力增加[7]。表观遗传学机制在正常的大脑功能和异常的神经现象中的作用已有报道[8],研究报道DNMTS/1小鼠对温和的缺血损伤有耐受[9],DNMT1的蛋白水平降低可以保护神经元的缺血损伤[3]。DNMT变化意味着其在低氧环境下维持大脑功能方面有重要作用。
*Plt;0.05 compared with H0.

*Plt;0.05 compared with H0图1 免疫印迹分析DNMT1、DNMT3A 和DNMT3B在小鼠大脑皮质中的表达

*Plt;0.05 compared with H0图2 H0、H1和H4组小鼠大脑皮层中DNMT活性Fig 2 DNMT activity in the cerebral cortex of the mice in H0、H1 and H4(n=6)
研究显示蒙古沙鼠经短暂全脑缺血处理后6、12和24 h神经元DNMT1不发生变化,缺血处理后2、4、5和7 d神经元DNMT1降低[10]。因此DNMT在缺血/低氧耐受中必定扮演了重要角色。虽然本研究中DNMT1的mRNA和蛋白质在H0、H1和H4组小鼠之间没有显著差异。根据研究报道可以推论DNMT1在低氧条件下的变化可能有时间依赖性[10],由于本研究的H1组和H4组与的低氧暴露时间均低于24 h,所以DNMT1在急性重复低氧耐受中的作用可能不是主要的。本研究显示急性重复低氧使DNMT3A和DNMT3B在mRNA和蛋白水平表达均降低,DNMT活性也发生了降低。DNMT活性的变化从另一个侧面验证了低氧预适应过程中DNMT3A和DNMT3B的变化。DNMT3A和DNMT3B的功能是DNA甲基化的重头合成,DNMT3A和DNMT3B在急性重复低氧下的变化可能意味着新的DNA甲基化模式的建立。根据“好的基因对抗坏的基因”理论[9],新的DNA甲基化模式使“好的基因”表达增加并提高了神经细胞对缺血/低氧的耐受。
急性重复低氧预适应的细胞组织分子机制可能是使脑保护基因“好的基因”表达上调并使脑损伤基因“坏的基因”表达下调[6],而DNMT在脑保护作用中的可能是通过调节脑保护基因“好的基因”和脑损伤基因“坏的基因”实现的。本研究中急性重复低氧预适应小鼠海马中DNMT3A和DNMT3B表达降低及DNMT活性降低可能是急性重复低氧预适应脑保护获得的重要步骤。DNMT抑制剂5-Aza-dC处理后发现神经细胞可以提高对缺血的耐受[11]和DNMT1的蛋白水平降低可以保护神经元的缺血损伤显示DNMT在神经细胞缺血/低氧耐受中具有重要作用[3]。而要明确DNMT1、DNMT3A和DNMT3B在脑保护中的作用则需要更深入的研究。
[1] Lu GW. Tissue-cell Adaptation to hypoxia [J]. Adv Pathophy, 1963, 1:197-239.
[2] Mimura I, Tanaka T, Wada Y,etal. Pathophysiological response to hypoxia-from the molecular mechanisms of malady to drug discovery: epigenetic regulation of the hypoxic response via hypoxia-inducible factor and histone modifying enzymes [J]. J Pharmacol Sci, 2011, 115:453-458.
[3] Endres M, Fan G, Meisel A,etal. Effects of cerebral ischemia in mice lacking DNA methyltransferase 1 in post-mitotic neurons [J]. Neuroreport, 2001, 12:3763-3766.
[4] Shao G, Gao CY, Lu GW. Alterations of hypoxia-inducible factor-1 alpha in the hippocampus of mice acutely and repeatedly exposed to hypoxia [J]. Neurosignals, 2005, 14:255-261.
[5] Shao G, Gong KR, Li J,etal. Antihypoxic effects of neuroglobin in hypoxia-preconditioned mice and SH-SY5Y cells [J]. Neurosignals, 2009, 17:196-202.
[6] Shao G, Lu GW. Hypoxic preconditioning in an autohypoxic animal model [J]. Neurosci Bull, 2012, 28:316-320.
[7] Shao G, Zhang R, Wang ZL,etal. Hypoxic preconditioning improves spatial cognitive ability in mice [J]. Neurosignals, 2006, 15:314-321.
[8] Rana G, Donizetti A, Virelli G,etal. Cortical spreading depression differentially affects lysine methylation of H3 histone at neuroprotective genes and retrotransposon sequences [J]. Brain Res, 2012, 1467:113-119.
[9] Endres M, Meisel A, Biniszkiewicz D,etal. DNA methyltransferase contributes to delayed ischemic brain injury [J]. J Neurosci, 2000, 20:3175-3181.
[10] Lee JC, Park JH, Yan BC,etal. Effects of Transient Cerebral Ischemia on the Expression of DNA Methyltransferase 1 in the Gerbil Hippocampal CA1 Region [J]. Neurochem Res, 2013, 38:74-81.
[11] Liu PK, Hsu CY, Dizdaroglu M,etal. Damage, repair, and mutagenesis in nuclear genes after mouse forebrain ischemia-reperfusion [J]. J Neurosci, 1996, 16:6795-6806.
The expression of DNA methyltransferases 1, 3A and 3B in the brain of hypoxic preconditioned mice
ZHOU Cheng-jiang1#, ZHANG Shu1#, JIANG Shu-yuan1, HUANG Li-hua1, LÜ Guo-wei2,ZHANG Yan-bo3, JI Xun-ming4, SHAO Guo1,2,4*
(1.Biomedicine Research Center and Basic Medical Department, BaoTou Medical College, Baotou 014010; 2.Institute for Hypoxia Medicine,Capital Medical University, Beijing 100069; 3.Dept. of Neurology, Affiliated Hospital of Taishan Medical College, Tai’an 271000;4.Institute for Hypoxia Medicine, Xuanwu Hospital, Capital Medical University, Beijing 100053,China)
ObjectiveTo study the changes of DNA methyltransferases (DNMT) in the brain of mouse with acute hypoxia.MethodsMice were randomly divided into control group (H0), hypoxia group (H1) and hypoxia for 4 runs group (H4). Real-time PCR, Western blot and methyltransferase activity assay were used to detect the changes of three kinds of DNMTs.ResultsmRNA and protein levels of DNMT3A and DNMT3B were found to be decreased in H1 and H4 (Plt;0.05). The activity of DNA methyltransferase was decreased in H4(Plt;0.05).ConclusionsThe changes of DNA methyltransferase may be closely related to protection of the brain in hypoxic preconditioned mice.
hypoxic preconditioning; brain; DNA methyltransferase; mouse
2013-04-02
2013-08-17
国家自然科学基金(81060212,81160244,81360316);内蒙古自然科学基金(2010BS1104);中国博士后基金(20080430851);内蒙古自治区高等学校科研项目(NJZY12221,NJZY12225);内蒙古自治区高等学校青年科技英才支持计划资助(NJYT-13-A10);教育部留学回国人员科研启动基金(46批)
*通信作者:shao_guo_china@163.com
#对本文有相同贡献
1001-6325(2014)02-0151-04
R339.5
A
