黏着斑激酶在机械压力诱导的人气道上皮细胞黏液分泌中的作用
2014-11-27尤列皮尔曼维克多科罗索夫周向东
李 娜,李 琪,尤列·皮尔曼,维克多·科罗索夫,周向东*
(1.重庆医科大学 附属第二医院 呼吸内科, 重庆 400010; 2.俄罗斯医学科学院 远东呼吸生理与病理中心, 俄罗斯 布拉戈维申斯克 675000)
研究论文
黏着斑激酶在机械压力诱导的人气道上皮细胞黏液分泌中的作用
李 娜1,李 琪1,尤列·皮尔曼2,维克多·科罗索夫2,周向东1*
(1.重庆医科大学 附属第二医院 呼吸内科, 重庆 400010; 2.俄罗斯医学科学院 远东呼吸生理与病理中心, 俄罗斯 布拉戈维申斯克 675000)
目的探讨黏着斑激酶(FAK)在机械压力诱导的人气道黏蛋白(MUC)5AC分泌中的作用。方法气液相界面培养人支气管上皮NHBE细胞,用Transwell压力实验装置间断性施压于NHBE细胞,黏着斑激酶(FAK)siRNA转染NHBE细胞,Western blot法检测FAK和p-ERK1/2蛋白含量,实时荧光定量PCR检测MUC5AC mRNA表达,ELISA法检测MUC5AC蛋白相对含量。结果与空白对照组相比,机械压力能显著升高MUC5AC mRNA及蛋白含量及p-ERK1/2蛋白相对表达水平(均Plt;0.01)。FAK siRNA可显著降低机械压力所诱导的MUC5AC mRNA及蛋白含量的升高及p-ERK1/2蛋白表达(Plt;0.01),但与转染FAK siRNA对照组相比,机械压力+转染FAK siRNA组细胞表达MUC5AC mRNA及蛋白水平和p-ERK1/2蛋白相对水平仍然是增加的(Plt;0.05),PD98059能显著抑制机械压力所诱导的MUC5AC mRNA及蛋白表达水平的升高(Plt;0.01)。FAK siRNA联合AG1478作用于NHBE细胞则可显著抑制机械压力诱导的MUC5AC mRNA和蛋白表达(Plt;0.01)。AG1478单独作用能有效降低由机械压力所诱导的上述指标的升高(Plt;0.05),但与AG1478对照组相比差异仍具有显著性。结论机械压力诱导的MUC5AC高表达的信号传导通路为ERK依赖的,FAK为ERK的上游信号分子。
黏着斑激酶;机械压力;黏蛋白类;细胞外信号调节激酶
临床中多种慢性气道炎性反应疾病(如COPD、哮喘等)往往伴有支气管收缩及重塑产生的气道狭窄,由此引发气道内压力增高,气道壁上皮细胞受压增加[1]。而黏液高分泌作为这类疾病的突出病理表现,是疾病发生、发展及预后的重要影响因素。黏蛋白5AC(MUC5AC)是气道上皮尤其是病理状态下的主要黏蛋白表型,在气道黏液高分泌疾病中最具代表性[2]。黏着斑激酶(focal adhesion kinase,FAK)能介导机械牵拉所导致的ERK1/2活化[3]。而ERK1/2是已知的多种刺激因素诱导MUC5AC表达和杯状细胞化生的关键性酪氨酸激酶[4-5]。那么,FAK是否在机械压力诱导的气道黏液分泌的信号传导通路中起作用呢?该研究中以FAK为切入点,研究机械压力作用于气道上皮细胞所产生的对气道黏液分泌的调控作用及信号传导机制,以期探明机械压力在气道黏液高分泌调控机制中作用及其分子机制,为控制疾病状态下气道收缩狭窄状态提供新的思路。
1 材料与方法
1.1 主要试剂及材料
正常人气道上皮NHBE细胞和BEBM培养基(均Clonetics公司);DMEM培养基(Mediatech公司);Transwell培养板(Corning公司);RPMI培养基、胎牛血清、TRIzol试剂和抗β-肌动蛋白的单克隆抗体(Sigma公司);脂质体Oligofectamine(Invitrogen公司);鼠抗MUC5AC 45M1单克隆抗体(Neomarker公司);鼠抗FAK单克隆、鼠抗FAK磷酸化位点多克隆(抗FAK Tyr397)抗体、鼠抗磷酸化细胞外信号调节激酶1/2(p-ERK1/2)单克隆抗体、表皮生长因子受体(EGFR)阻断剂AG1478、p-ERK1/2抑制剂PD98059(Cell Signaling公司);PrimeScript RT试剂盒(大连宝生物公司);FastStart Universal SYBR Green Master(Rox)(德国罗氏公司);引物由(上海生工公司合成);FAK siRNA和对照siRNA(Dharmacon公司),FAK siRNA序列为:FAK1, NNGCAUGUGGCCUGCUAUGGA; FAK2, UUUGGCG GUUGCAAUUAAATT。
1.2 方法
1.2.1 细胞培养:NHBE细胞接种于组织培养瓶中,加入支气管上皮细胞培养液[6],置于37 ℃、5% CO2、饱和湿度培养箱孵育,常规换液培养,当细胞汇合达70% ~ 80%时传代,将培养好的2代或3代细胞接种到Transwell培养板中的多微孔聚碳酸酯膜上。Transwell培养板插入配套6孔板中,形成上、下室,加入1:1混合的支气管上皮细胞培养液/达尔伯克必需基本培养基混合培养液继续培养,上、下室培养液相同[6]。每2天更换培养液至细胞长满纤维膜并融合,去掉上室培养液,建立气液相界面供试验使用,继续每2天更换下室培养液。
1.2.2 压力实验装置及分组:参照文献[7-8]。Transwell培养板上室加上带进气口的硅胶塞形成密闭小室,进气口连接气泵,通过向上室内输送湿化的37 ℃、5% CO2的空气,控制上室气压,而下室仍处于大气压,从而使得多微孔聚碳酸酯膜上的NHBE细胞受到跨细胞压力。参照文献[1,8],气液相界面培养14 d开始,采用30 cm H2O压力作用于NHBE细胞,每天1 h,连续7 d,模拟慢性气道炎性性疾病中气道收缩时气道上皮细胞受到的慢性机械压力。
1.2.3 细胞分组:将形成气液相界面的NHBE细胞分组处理:1)空白对照组:无血清培养基继续培养,不予任何刺激;2)机械压力组:细胞每天予以30 cm H2O压力作用1 h,连续7 d;3)转染FAK siRNA对照组;4)机械压力+转染FAK siRNA组。
在探讨ERK1/2在机械压力诱导的MUC5AC mRNA及蛋白表达中的作用实验中,采用ERK1/2特异性抑制剂PD98059作为干预因素,将细胞分为以下4组:空白对照组、机械压力组、PD98059对照组和PD98059+机械压力组。
在探讨FAK siRNA联合EGFR特异性抑制剂AG1478对机械压力诱导的MUC5AC mRNA和蛋白表达的影响的实验中,将细胞分为以下6组:空白对照组、机械压力组、AG1478对照组、AG1478+机械压力组、FAK siRNA+AG1478对照组和FAK siRNA+AG1478+机械压力组。
1.2.4 FAK siRNA、对照siRNA转染:在转染前1天将处于指数增长期的NHBE细胞按(1~2)×106个/mL的浓度在无血清条件下接种到培养板中,待细胞融合至40% ~ 50%时进行转染。操作步骤按照脂质体Oligofectamine说明书进行。参照文献[9],将FAK siRNA与Plus Reagent在Opti-MEM培养液中结合。用Opti-MEM培养液稀释的脂质体以10 μg/mL的浓度进行转染。转染6~ 8 h后,将0.5倍容积的含20%血清的RPMI培养液加入到细胞中继续转染48 h。转染后24~ 48 h于荧光显微镜下观察荧光,以此鉴定转染是否成功及转染效率。
1.2.5 实时荧光定量PCR检测MUC5AC mRNA的表达:细胞总RNA提取及浓度、纯度鉴定按参考文献[10]方法进行。cDNA反转录按照PrimeScript反转录试剂盒说明书进行。人MUC5AC(AF015521)引物序列为:上游5′-CTGGACATGACCTGTTACAGC-3′,下游5′-AGCTGGCCTTCTTGTGCACGC-3′。人GAPDH(NM_002046)引物序列为:上游5′-TGT TCGTCATGGGTGTGAACC-3′,下游5′-CATGAGTCC TTCCACGATACC-3′。按照试剂盒说明建立10 μL PCR反应体系,反应参数为95 ℃变性10 min,95 ℃变性15 s, 55 ℃退火30 s,40个循环。采用2-ΔΔCt的方法分析目的基因mRNA的相对表达量。Ct是达到荧光阈值所需的循环数,ΔΔCt=实验组(Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因)。
1.2.6 ELISA法检测细胞分泌的MUC5AC蛋白含量:按参考文献[11]方法进行。
1.2.7 Western blot检测FAK、p-ERK1/2蛋白表达:步骤按参考文献[11]方法进行(鼠抗FAK单克隆、鼠抗FAK磷酸化位点多克隆(抗FAK Tyr397)抗体、鼠抗p-ERK1/2单克隆抗体终浓度均为1∶1 000)。
1.3 统计学分析

2 结果
2.1FAKsiRNA转染对NHBE细胞合成FAK蛋白的干扰效率
FAK1和FAK2 siRNA转染组细胞表达FAK蛋白相对含量分别为(0.28±0.03)和(0.32±0.04),均显著低于对照siRNA组的(0.68±0.06)(Plt;0.01)和未转染对照组的(0.74±0.07)(Plt;0.01)(图1)。由于FAK1 siRNA和FAK2 siRNA均有显著干扰效率,故在后续实验中采用两者结合的一个siRNA来进行RNA干扰。

1.control group; 2.control siRNA transfected group; 3.FAK1 siRNA transfected group; 4.FAK2 siRNA transfected group图1 Western blot检测各组FAK蛋白的相对含量Fig 1 Relative contents of FAK protein in different groups tested by Western blot
2.2 机械压力对FAK磷酸化的影响
机械压力组细胞表达FAK磷酸化位点Tyr397蛋白相对含量(0.39±0.03)较空白对照组的(0.25±0.02)有显著提高(Plt;0.05)(图2)。
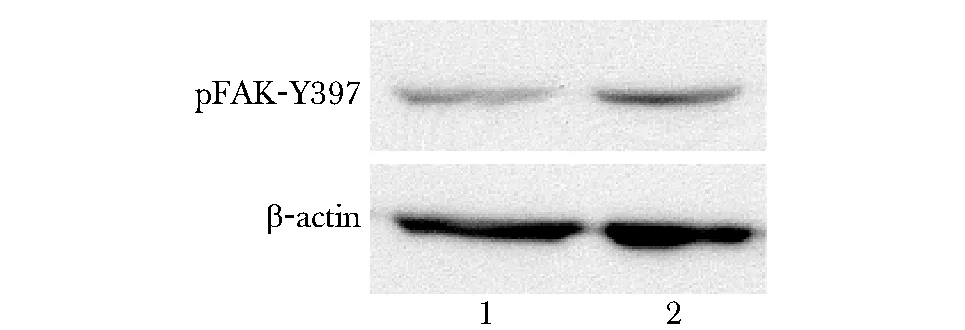
1.control group; 2.stress group图2 机械压力对FAK磷酸化的影响Fig 2 The effect of mechanical stress on phosphoryl- ation of FAK
2.3FAK在机械压力诱导的MUC5ACmRNA及蛋白表达的影响
与空白对照组相比,机械压力能显著升高MUC5AC mRNA及蛋白含量(Plt;0.01);FAK siRNA转染则可显著降低由机械压力所诱导的上述指标的升高(Plt;0.05);但是,机械压力+转染FAK siRNA组细胞表达MUC5AC mRNA及蛋白水平较转染FAK siRNA组仍然是增加的(Plt;0.05)(表1)。
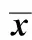
表1 各组细胞MUC5AC mRNA相对值及蛋白含量
*Plt;0.05 compared with stress;**Plt;0.01 compared with control;#Plt;0.05 compared with FAK siRNA transfected control.
2.4FAK在机械压力诱导的ERK1/2磷酸化中的作用
与空白对照组的(0.43±0.07)相比,机械压力组细胞p-ERK1/2蛋白表达相对含量(0.79±0.05)显著增加(Plt;0.01);与机械压力组相比,机械压力+转染FAK siRNA组细胞表达p-ERK1/2蛋白相对含量(0.60±0.04)显著减少(Plt;0.05);但是,与转染FAK siRNA对照组的(0.41±0.02)相比,机械压力+转染FAK siRNA组细胞表达p-ERK1/2蛋白相对水平仍然是增加的(Plt;0.05)(图3)。
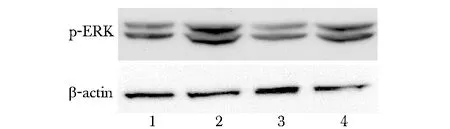
1.control group; 2.stress group; 3.FAK siRNA transfected control group; 4.stress+FAK siRNA transfected group图3 FAK在机械压力诱导的ERK1/2磷酸化中的作用Fig 3 The effect of FAK in mechanical stress-induced ERK1/2 phosphorylation
2.5ERK1/2在机械压力诱导的MUC5ACmRNA及蛋白表达中的作用
PD98059+机械压力组细胞MUC5AC mRNA及蛋白相对表达水平与机械压力组相比显著降低(Plt;0.01)(表2)。
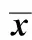
表2 各组细胞MUC5AC mRNA相对值及蛋白含量
*Plt;0.01 compared with control;#Plt;0.01 compared with stress.
2.6FAKsiRNA联合EGFR特异性抑制剂AG1478对机械压力诱导的MUC5ACmRNA和蛋白表达的影响
FAK siRNA联合AG1478能够显著抑制单纯机械压力诱导的MUC5AC mRNA和蛋白表达(Plt;0.01);AG1478单独作用可显著降低由机械压力所诱导的上述指标的升高(Plt;0.05),但与AG1478对照组相比差异仍具有显著性(Plt;0.05)(表3)。
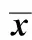
表3 各组细胞MUC5AC mRNA相对值及蛋白含量
*Plt;0.05 compared with stress;**Plt;0.01 compared with control;#Plt;0.05 compared with AG1478 control.
3 讨论
FAK在机械牵拉所导致的ERK1/2活化中起重要介导作用[12]。而ERK1/2是已知的多种刺激因素诱导MUC5AC表达和杯状细胞化生的关键性酪氨酸激酶[4-5]。因此,FAK可能在机械压力诱导的气道上皮细胞MUC5AC表达中起信号传导作用。
该研究发现,机械压力能够诱导人支气管上皮细胞FAK最重要的自身磷酸化位点-酪氨酸位点Tyr397的磷酸化水平增高。小干扰RNA(small interfering RNA,siRNA),可以序列特异性与靶mRNA序列结合,导致特异性mRNA的降解,从而稳定持续地维持较长时间的基因沉默[13]。该研究中所采用的FAK siRNA质粒在实验中被证实可特异性地成功下调NHBE细胞FAK蛋白的表达。研究同时发现,机械压力能够诱导NHBE细胞MUC5AC mRNA和蛋白及磷酸化ERK1/2蛋白的表达显著增加,FAK siRNA则能够有效降低但却不能完全抑制机械压力诱导的上述效应,而ERK1/2特异性抑制剂PD98059却能显著并完全抑制机械压力诱导的MUC5AC mRNA和蛋白的表达,提示机械压力诱导的MUC5AC高表达的信号传导通路为ERK依赖的,FAK为ERK的上游信号分子,但可能存在其他非FAK依赖的ERK激活信号通路。
支气管收缩产生的气道压力增加可经表皮生长因子受体(epidermal growth factor receptor, EGFR)信号通路完成细胞外机械信号向细胞内化学信号传导[14],并参与调节丝分裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路[7]。因此,EGFR可能是诱导ERK活化并最终导致MUC5AC表达增加的另一上游机械传导通路。在后续的实验中发现,EGFR特异性抑制剂AG1478与FAK siRNA一样单独作用于NHBE细胞时能够显著降低但却不能完全抑制机械压力诱导的MUC5AC mRNA及蛋白的表达,而将两者联合作用于NHBE细胞则能完全抑制机械压力诱导的MUC5AC的高表达,同时,ERK传导通路上游部分的EGFR的活化在各种因素诱导的气道黏液高分泌信号传导通路中居中心地位[15],因此,EGFR为另一重要的机械压力诱导的ERK激活及MUC5AC表达的上游信号通路。
研究结果初步证实了FAK、EGFR所介导的机械压力促人支气管上皮细胞MUC5AC表达效应,并进一步阐明了ERK信号传导通路在其中所起的作用,从而加深了对气道黏液高分泌的机械传导机制的了解,为慢性气道炎症性疾病防控提供一个新的研究思路。
[1] Wiggs BR,Hrousis CA,Drazen JM,etal. On the mechanism of mucosal folding in normal and asthmatic airways [J]. J Appl Physiol,1997,83:1814-1821.
[2] 李琪,周向东.TNF-α与香烟烟雾在诱导气道上皮细胞系黏蛋白表达的相互作用[J].基础医学与临床,2009,29:1139-1143.
[3] Chaturvedi LS,Marsh HM,Basson MD. Src and focal adhesion kinase mediate mechanical strain-induced proliferation and ERK1/2 phosphorylation in human H441 pulmonary epithelial cells[J]. Am J Phyiol Cell Physiol,2007,292: 1701-1713.
[4] Hewson CA,Edbrooke MR,Johnston SL. PMA induces the MUC5AC respiratory mucin in human bronchial epithelial cells,via PKC,EGF/TGF-alpha,Ras/Raf,MEK,ERK and Sp1-dependent mechanisms[J]. J Mol Biol,2003,344:683-695.
[5] Song JS,Cho KS,Yoon HK,etal. Neutrophil elastase causes MUC5AC mucin synthesis via EGF receptor,ERK and NF-kB pathways in A549 cells[J]. Korean J Intern Med,2005,20:275-283.
[6] Park JA,Tschumperlin DJ. Chronic intermittent mechanical stress increases MUC5AC protein expression[J]. Am J Respir Cell Mol Biol,2009, 41:459-466.
[7] Tschumperlin DJ,Shively JD,Swartz MA,etal. Bronchial epithelial compression regulates MAP kinase signaling and HB-EGF-like growth factor expression[J]. Am J Physiol Lung Cell Mol Physiol,2002,282: 904-911.
[8] Ressler B,Lee RT,Randell SH,etal. Molecular responses of rat tracheal epithelial cells to transmembrane pressure[J]. Am J Physiol Lung Cell Mol Physiol 2000,278:1264-1272.
[9] Thamilselvan V,Basson MD. Pressure activates colon cancer cell adhesion by inside-out focal adhesion complex and actin cytoskeletal signaling[J]. Gastroenterology,2004,126:8-18.
[10] 钟甜,尤列·皮尔曼,维克多·科罗索夫,等.张力敏感性阳离子通道在机械牵张引起气道黏液分泌中的作用[J].中华医学杂志,2010,90:2328-2333.
[11] 邬海桥,李琪,周向东.茶黄素和表皮生长因子受体对气道黏液分泌的影响[J].中华结核和呼吸杂志,2009,32:27-32.
[12] Wang JG,Miyazu M,Xiang P,etal.Stretch-induced cell proliferation is mediated by FAK-MAPK pathway[J].Life Sci,2005,76:2817-2825.
[13] Hammond SM,Candy AA,Harmon GJ. Post-transcriptional gene silencing by double-standard RNA[J]. Nat Rew Genet,2001,2:110-119.
[14] Tschumperlin DJ,Dai G, Maly IV,etal. Mechanotransduction through growth-factor shedding into the extracellular space[J]. Nature,2004,429: 83-86.
[15] Kim S,Schein AJ,Nadel JA. E-cadherin promotes EGFR-mediated cell differentiation and MUC5AC mucin expression in cultured human airway epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol,2005,289: 1049-1060.
Effects of focal adhesion kinase on mechanicalstress-induced airway mucin hypersecretion by human bronchial epithelial cells
LI Na1, LI Qi1, Juliy M. PERELMAN2, Victor P. KOLOSOV2, ZHOU Xiang-dong1*
(1.Dept. of Respiratory Medicine, the Second Affiliated Hospital, Chongqing Medical University, Chongqing 400010, China;2.Far Eastern Scientific Center of Physiology and Pathology of Respiration, Blagoveschensk 675000, Russia)
ObjectiveTo explore effects of focal adhesion kinase on mucin(MUC)5AC hypersecretion induced by mechanical stress.MethodsNormal human bronchial epithelial (NHBE) cells were cultured at an air-liquid interface and exposed to chronic intermittent compressive mechanical stress via Transwell mechanical stress apparatus. Cells were treated with FAK siRNA. Western blot was performed to determine FAK and phosphorylation of ERK1/2 protein contents. Real-time PCR and ELISA were underwent to test MUC5AC mRNA and protein contents respectively.ResultsThe expression level of phosphorylation of FAK at Tyr397 (p-FAK-Y397) in mechanical
group was significantly higher than those in control group. Compared with the control group, mechanical stress significantly increased expressions of MUC5AC mRNA and protein contents and also the protein expression of p-ERK1/2(Plt;0.01). FAK siRNA significantly attenuated the stress-induced increase in MUC5AC mRNA and protein expression and also the protein expression of p-ERK1/2(Plt;0.01). But expression of MUC5AC mRNA and protein and p-ERK1/2 protein in mechanical + FAK siRNA group was still higher than those in FAK siRNA control group(Plt;0.05). PD98059 significantly decreased the stress-induced increase in MUC5AC mRNA and protein expression(Plt;0.01). Combination of FAK siRNA and AG1478 could significantly inhibit the stress-induced increase in MUC5AC mRNA and protein expression(Plt;0.01). AG1478 alone effectively decreased stress-induced MUC5AC mRNA and protein expression(Plt;0.05),but when compared with AG1478 control group,the differences were still significant.ConclusionsThe signal transduction pathway of stress-induced overexpression of MUC5AC is ERK-dependent,FAK is one of the upstream signal molecules of ERK.
focal adhesion kinase;mechanical stress;mucins;extracellular signal-regulated kinase
2013-08-29
2013-11-22
国家自然科学基金(31201059,31171346);国家自然科学基金中俄国际合作项目(31211120168);重庆市卫生局面上项目(2012-2-077)
*通信作者(correspondingauthor): zxd999@263.net
1001-6325(2014)05-0589-06
R 363
A
