烟草内生细菌分离方法的优化研究
2014-11-27陈泽斌代方平寸林江陈艳芳许石剑方飞黄杨
陈泽斌,代方平,寸林江,李,陈艳芳,许石剑,方飞,黄杨
1昆明学院农学院,云南省高校都市型现代农业工程研究中心,昆明 650214;
2 云南省烟草农业科学研究院,云南 玉溪 653100;
3黔西州烟草公司兴仁县分公司,贵州 兴仁 562300;
4德宏州环境保护局,云南 芒市678400;
5无锡园林建设工程管理处,江苏 无锡 214072
烟草内生细菌分离方法的优化研究
陈泽斌1,2,代方平1,寸林江1,李1,陈艳芳1,许石剑3,方飞4,黄杨5
1昆明学院农学院,云南省高校都市型现代农业工程研究中心,昆明 650214;
2 云南省烟草农业科学研究院,云南 玉溪 653100;
3黔西州烟草公司兴仁县分公司,贵州 兴仁 562300;
4德宏州环境保护局,云南 芒市678400;
5无锡园林建设工程管理处,江苏 无锡 214072
用研磨组织稀释分离法与表面消毒有效性评价相结合的方法确定了适宜烟草组织的表面消毒方法以及内生细菌分离培养基。采用1%次氯酸钠浸泡5 min,再用75%酒精浸泡2分钟能够100%去除表面附生菌,并且分离得到更多的内生细菌。研究比较了TSA、NA、PDA、LB 四种常用的细菌分离培养基在分离烟草内生细菌中的差异,其中TSA和NA培养基分离得到的内生细菌数量较高,TSA培养基从烟草根、茎、叶中分离出的内生细菌数量分别为5.18 log cfu/g.fw、2.17 log cfu/g.fw、4.69 log cfu/g.fw;NA培养基分别为5.01 log cfu/g.fw、1.81 log cfu/g.fw、4.93 log cfu/g.fw。对分离得到的127株内生细菌进行16S rDNA序列测定表明,TSA和NA培养基分离得到的内生细菌种类最多,其中TSA培养基分别从根、茎、叶中分离到9、7、13种内生细菌;其次是NA培养基,分别从根、茎、叶中分离到8、6、10种内生细菌。结果表明,采用TSA和NA培养基分离烟草内生细菌,可以达到较为理想的分离效果。
烟草;内生细菌;分离;优化
植物内生菌(Endophyte)是在其生活史的一定阶段或全部阶段生活于健康植物各种组织和器官内部的微生物,属于植物组织内的正常菌群[1]。世界上大约有30万种植物,目前人们仅仅研究了几百种植物的内生细菌,在已经研究的植物当中,几乎每种植物都具有丰富的内生细菌存在。人们从中不仅分离鉴定出多种细菌新种,还获得了一大批具有防病,促生或内生固氮等生物学功能的内生细菌,显示出了良好的研究和应用前景[2-5],内生细菌已成为植物学、微生物学、植物保护学及植物育种学等多学科的研究热点。
在植物内生细菌的研究中,不同学者针对不同的植物样品采用不同的分离培养方法。由于培养基营养物质成分、离子浓度以及酸碱度等条件不同,导致不同培养基对于微生物具有不同选择性[6-7],而且不同的稀释梯度、消毒剂的选择及其消毒时间对微生物分离数量也有影响。本文通过不同消毒剂、消毒时间、培养基的优化组合,探讨适宜其内生细菌分离条件,建立和完善烟草内生细菌分离体系和培养方法。为后续的内生细菌多样性研究奠定基础。
1 材料与方法
1.1 样品采集
2012年8月下旬,取云南玉溪世界烟草品种园烟草品种K326成熟期的根、茎、叶为试验材料,选择生长良好、无病害健康植株。取样后立即放入样品袋中,低温保鲜,在24 h之内进行内生细菌的分离。
1.2 培养基及主要试剂
培养基配方见表1,细菌基因组DNA提取试剂盒、16S rDNA片段扩增所用的各种酶、Marker、dNTPs、Buffer等试剂为宝生物工程(大连)产品;其余试剂均为国产分析纯。
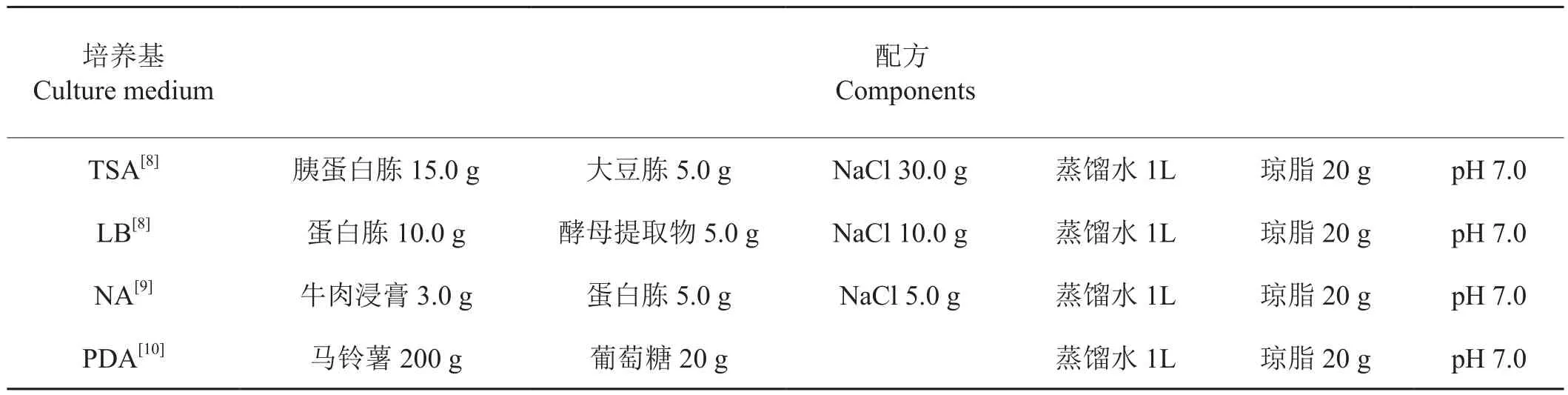
表1 培养基配方Tab.1 Culture medium components
1.3 分离培养条件的选择
1.3.1 消毒剂及消毒时间的选择
用0.1% SDS浸泡根、茎和叶片样品10 min,再用自来水冲洗表面,滤纸吸去水分,随机取3种样品各0.4 g,无菌条件下分别采用6种方法消毒处理(见表2)。分别取最后一次无菌水冲洗液200 μL涂布NA固体培养基,每处理3次重复,28 ℃条件下培养3 d,并设无菌水冲洗组织做对照,记录各处理菌落数量,计算表面除菌率。表面除菌率=(未经消毒剂处理的材料表面细菌数-消毒剂处理后的材料表面细菌数)/ 未经消毒剂处理的材料表面细菌数×100%[11]。

表2 三种消毒剂及其不同的消毒处理方式Tab.2 Different treatments of three chemical reagents
1.3.2 培养基种类的选择
按1.3.1中处理5的方法将烟草的根、茎、叶各0.4 g消毒处理后用无菌水冲洗4次,无菌滤纸吸去表面水分后,分别与一大一小灭菌钢珠一并放入2mL灭菌离心管,加入600 μL无菌水,用QIAGEN高通量组织研磨器研磨3 min,频率为30 r/s。研磨后的汁液用无菌水梯度稀释至10-4,取10-2,10-3,10-4三个稀释度的菌悬液各200 μL分别涂布于TSA、NA、PDA、LB平板上;同时取最后一次植物组织冲洗液200 μL分别涂布TSA、NA、PDA、LB平板上为对照,每浓度涂3个平板。将平板倒置于28 ℃恒温培养箱培养3 d,观察不同培养基及不同稀释度下菌落生长情况,根据菌落的形态和数量确定适宜的培养基种类。
1.4 菌落计数
选取合适的浓度(每皿30-300个菌落)计数菌落,计算每克植株鲜重所含的活菌数cfu/g.fw =(菌落数×稀释倍数×分离用水量)/(涂板用水量×分离组织重量)。并转换成对数值log cfu/g.fw(Colony-Forming Units Per Gram Fresh Weight)。
1.5 内生细菌的分离和保存
按1.3.1中处理5的方法进行表面消毒,以TSA、NA、PDA、LB作为分离培养基,分离培养烟草根、茎、叶内生细菌,每处理重复3次。28 ℃黑暗培养3 d后取出,用记号笔从背面标出形态相异的菌落,编号并统计。挑取单菌落于NA斜面28 ℃培养3 d后4 ℃冰箱保存备用。
1.6 内生细菌的鉴定
按文献[12]的方法。
1.7 数据统计与分析
采用WPS Of fice 2012个人版软件和DPS7.5软件对数据进行统计分析。
2 结果与分析
2.1 消毒剂及消毒时间的选择
不同消毒处理对烟草不同组织的表面除菌效果不同(表3)。三种消毒剂除菌能力的大小依次为:0.1%升汞 > 1%次氯酸钠 > 75%酒精。处理3中,0.1%的升汞不需要与1%次氯酸钠配合使用除菌率就能达到100%;在处理6中,只用75%酒精单独处理,未用0.1%升汞与1% NaClO浸泡,表面除菌效果相比其它五种处理较差,对烟草各组织表面的除菌率为55% -100%,这可能与烟草各器官的组织致密性及所处生长环境有关。试验结果表明处理1、2、3、4、5均能彻底灭活植物组织表面的微生物。从不同消毒处理后内生细菌的数量来看(表4),处理5从根、茎、叶分离到的内生细菌数量均比处理1、2、3、4要多。可能是因为处理1、2、3、4用0.1%升汞或1%NaClO消毒浸泡的时间均比处理5时间长,消毒剂渗入植物组织杀死了部分内生细菌,鉴于此,在保证表面消毒效果的前提下,为了分离得到更多的内生菌,选择处理5的消毒剂组合和消毒时间进行后续试验。

表3 各组织不同表面消毒时间的除菌率Tab.3 Sterilization rate of different tissue samples by different disinfectants

表4 不同消毒处理后内生细菌分离数量Tab.4 Numbers of endophytic bacteria after different sterilization treatments
2.2 不同培养基对烟草内生细菌分离数量的影响
采用处理5方法表面消毒后,研磨各无菌材料,梯度稀释后涂布于4种培养基上(图1),培养3 d后对菌落进行计数,不同培养基的内生细菌分离数见表5。分离数由多到少依次为:TSA > NA > LB >PDA。其中TSA和NA培养基分离得到的内生细菌数量最高,与其它培养基分离得到的内生细菌数量相比差异显著(α=0.05)。TSA培养基从烟草根、茎、叶中分离出的内生细菌数量分别为5.18 log cfu/g.fw、2.17 log cfu/g.fw、4.69 log cfu/g.fw;NA培养基从烟草根、茎、叶中分离出的内生细菌数量分别为5.01 log cfu/g.fw、1.81 log cfu/g.fw、4.93 log cfu/g.fw。结果表明,利用TSA培养基和NA培养基能够分离出更多的烟草内生细菌。同时还发现,上述4种培养基对烟草根、茎、叶内生细菌分离的菌落数量由多到少依次为:根 > 叶 > 茎,暗示烟草根、茎、叶内生细菌的数量存在差异。
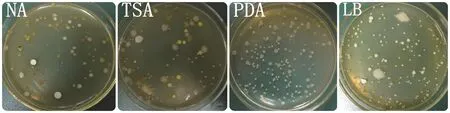
图1 不同培养基对烟草叶片内生细菌分离的效果(10-3)Fig.1 Separationeffect of endophytic bacteria isolated from tobacco leaves using different medium (10-3)

表5 不同培养基对烟草内生细菌分离数量的影响Table 5 Numbers of endophytic bacteria isolated from tobacco using different medium
2.3 不同培养基对烟草内生细菌分离种类的影响
PCR扩增得到不同培养基上分离得到的127株内生细菌的16S rDNA片段,委托上海英骏生物技术公司对16S rDNA片段进行序列测定,通过BLAST寻找与目的序列同源性最高的已知分类地位菌种的16S rDNA序列进行比较鉴定,结果见表6,不同培养基分离得到内生细菌种类数由多到少依次为TSA >NA > LB > PDA,其中TSA培养基分离得到的细菌种类最多,分别从根、茎、叶分离到9、7、13种细菌;其次是NA培养基,分别从根、茎、叶分离到8、6、10种细菌。LB和PDA培养基上虽然也可以分离出大量的内生细菌,但分离出来的菌落较单一(图1),而TSA和NA平板则可以分离出较多的具有不同菌落形态和颜色的内生细菌;利用LB和PDA培养基分离到的菌株,通过TSA和NA培养基大部分都能够分离到(表6),表明TSA和NA培养基为分离烟草内生细菌的最适宜培养基。同时还发现,4种培养基对烟草根、茎、叶内生细菌分离的种类数量由多到少依次为:叶 > 根 > 茎,说明烟草不同器官中内生细菌的种类存在差异。
3 讨论
内生细菌的分离程序中,表面消毒是关键步骤,选择合适的消毒剂和消毒时间在内生细菌的前期研究中是非常重要的,既要保证能除掉表面的附生菌,又要能最大限度的不对组织造成破坏从而影响内生细菌的长出[13]。鉴于此,本研究综合考虑表面灭菌效果以及各消毒处理后分离出的内生细菌数量,选择处理5的消毒剂组合和消毒时间进行后续试验。
在培养基选择方面,本研究利用目前普遍采用的4种细菌培养基分离烟草内生细菌,发现TSA和NA培养基分离出的烟草内生细菌无论从数量上还是种类上都显著优于其它培养基的分离效果;可以认为TSA和NA培养基是分离烟草内生细菌的最适宜培养基。同时发现,不同烟草器官中的内生细菌的数量和种类存在一定的差异,暗示内生细菌在烟草植株中分布不均匀,且寄生程度不同,不同器官和内生细菌之间可能有相互选择的关系。己有的研究发现内生细菌的种群密度取决于植物品种、植物的基因型、植物组织、植物生长期和环境条件[14-15],本研究也体现了这一特点。
本研究表明烟草根、茎、叶内均存在大量的内生细菌,其中以根中最多,其次为叶,茎中最少。文献报道的黄瓜、豆类等大多数植物内生细菌的数量分布规律总体为[16-17]:地下组织高于地上组织,根中最多,其次是茎和叶片,这与本研究得出的结果一致。
此外,不同培养基分离得到的内生细菌的种群数量存在一定差异。在分离得到的全部种类的菌株中,发现个别种类的菌株只在一种或者几种培养基上被分离得到,例如从根部分离得到的海水芽孢杆菌,只在TSA培养基上被分离到;木胶节杆菌只在LB培养基上被分离到;嗜硼芽孢杆菌只在NA培养基上被分离到;肠杆菌只在PDA培养基上被分离到。T abacchioni等[18]在关于玉米根际微生物遗传多样性的报道中也指出,利用不同分离培养基得到的根际微生物的种群数量存在一定差异。孙晓棠等[19]的研究也证实不同培养基分离得到番茄根际细菌的种群数量存在一定差异。胡元森等[20]在利用DGGE方法研究不同培养基分离土壤细菌的研究中也曾报道,在分离土壤细菌的7种培养基上均可培养的细菌只占6.25%,其他可培养细菌只在几种甚至一种培养基中分离得到。这与本研究得出的结果一致。这可能是因为不同培养基对不同种类菌株的选择压力不同所造成的,有待进一步研究。
利用TSA和NA培养基能分离到较多数量和种类的内生细菌,然而其它培养基又能分离到TSA和NA培养基分离不到的种类的细菌。说明在分离植物内生细菌的过程中,应尽可能采用多种具有不同选择性的分离培养基,这样才能得到较为丰富的植物内生细菌资源。
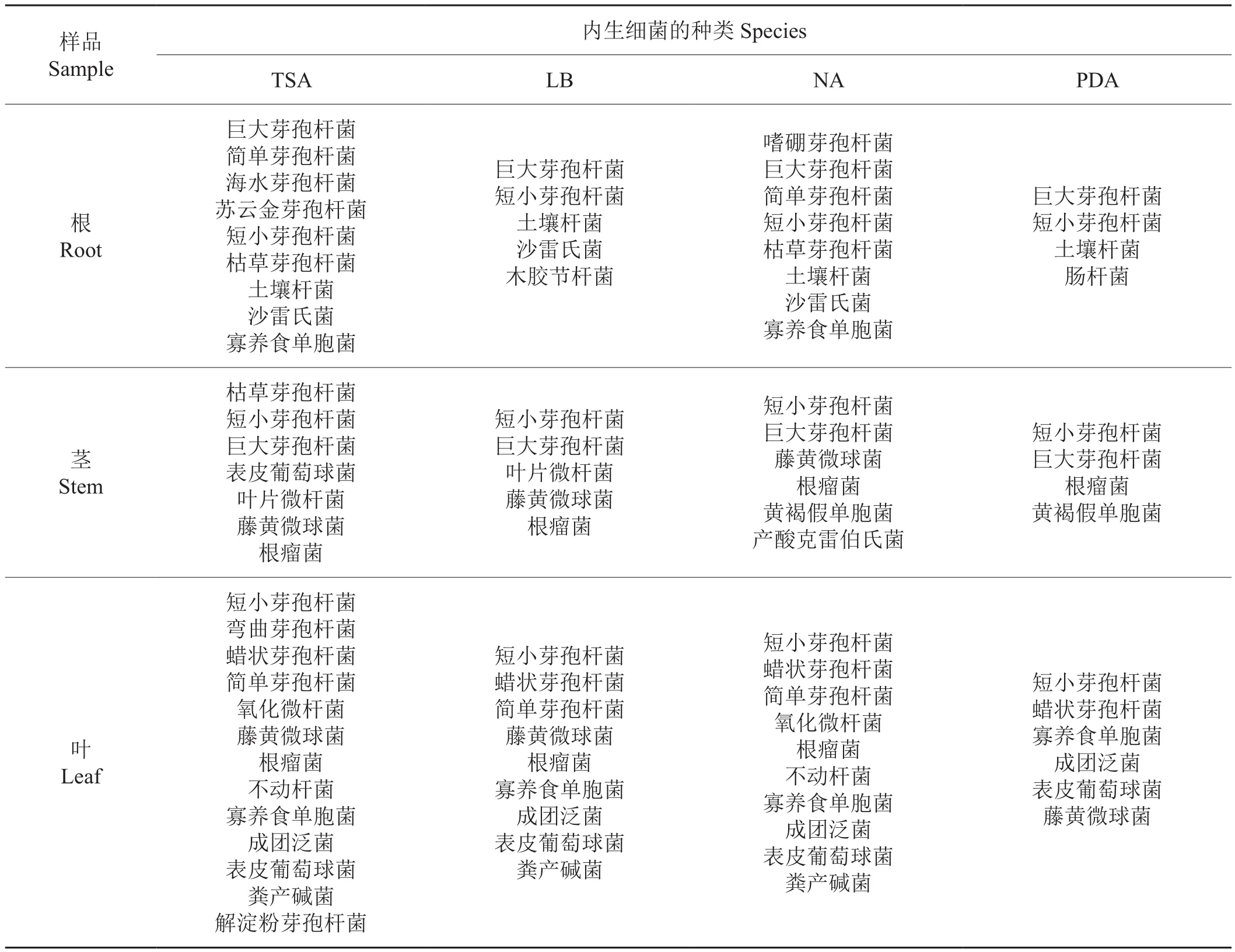
表6 不同培养基对烟草内生细菌分离种类的影响Tab.6 Species of endophytic bacteria isolated from tobacco using different medium
[1]Sturz A,Christie B,Nowak J.Bacterial endophytes potential role in developing sustainable systems of crop production[J].Critical Reviews in Plant Sciences,2000,19(1):1-30.
[2]邹文欣,谭仁祥.植物内生菌研究新进展[J].植物学报,2001,43(9):881-892.
[3]何红,邱思鑫,胡方平,等.植物内生细菌生物学作用研究进展[J].微生物学杂志,2004,24(3):40-44.
[4]潘学武,董妍玲,邹笑笑.喜树内生真菌的研究进展[J].安徽农业科学,2013,41(1):90-91.
[5]黄丽,张荣易,谭志琼,等.海南五指山野生美花兰根部内生真菌研究[J].西南农业学报,2012,25(2):657-660.
[6]张萍,宋希强.兰科植物内生细菌物种多样性及其促生机理研究进展[J].热带亚热带植物学报,2012,20(1):92-98.
[7]张则君,张晓宇,刘宏,等.植物内生细菌分离鉴定方法概述[J].农业技术与装备,2012,11(250):75-77.
[][]
[8]王刚,李志强.小麦内生细菌的分离及其对小麦纹枯菌的拮抗作用[J].微生物学通报,2005,32(2):20-24.
[9]易龙,肖崇刚,马冠华,等.防治烟草赤星病有益内生细菌的筛选及抑菌作用[J].微生物学报,2004,44(1):19-22.
[10]乔宏萍,黄丽丽,康振生.小麦内生细菌及其对根茎部主要病原真菌的抑制作用[J].应用生态学报,2004,17(4):690-694.
[11]路国兵,冀宪领,张瑶,等.桑树内生细菌的分离及生防益菌的筛选[J].蚕业科学,2007,33(3):350-354.
[12]陈泽斌,夏振远,雷丽萍,等.烟草可培养内生细菌的分离及多样性分析[J].微生物学通报,2011,38(9):1347-1354.
[13]Barraquio W L,Revilla L,Ladha J K.Isolation of endophytic bacteria from wetland rice[J].Plant and Soil,1997,194:15-24.
[14]Schulz B,Rommert A K,Dammann U,et al.The endophyte-host interaction:a balanced antagonism? [J].Mycol Res,1999,103:1275-1283.
[15]Pamela D,Adams,Joheph W,et al.Effect of host genotype on indigenous bacterial endophytes of cotton (Gossypium hirsutum L.)[J].Plant and soil,2002,240(1):181-189.
[16]何红,蔡学清,洪永聪,等.辣椒内生菌BS-2在白菜体内的定殖、促生和防炭疽病作用[J].植物保护学报,2004,31(4):347-352.
[17]方扬,张小平,陈露遥,等.天府花生内生细菌种群多样性研究[J].西南农业学报,2008,21(2):353-358.
[18]Tabacchioni S,Chiarini L,Bevivino A,et al.Bias caused by using different isolation media for assessing the genetic diversity of a natural microbial populations[J].Microbial Ecology,2000,40(3):169-176.
[19]孙晓棠,姚青,刘琼光,等.利用DGGE评价不同培养基回收番茄根际细菌类群的能力[J].微生物学报,2006,46(3):482-486.
[20]胡元森,李翠香,孙富林,等.不同培养基组合提高土壤细菌可培养性的研究[J].微生物学报,2007,47(5):882-887.
Research on separation optimization of endophytic bacteria in tobacco
CHEN Zebin1,2,DAI Fangping1,CUN Linjiang1,LI Qi1,CHEN Yanfang1,XU Shijian3,FANG Fei4,HUANG Yang5
1 Engineering Research Center for Urban Modern Agriculture of Higher Education in Yunnan Province,Agriculture School,Kunming University,Kunming 650214,China;
2 Yunnan Academy of Tobacco Agricultural Sciences,Yuxi 653100,Yunnan,China;
3 Xingren Branch of Qianxinan Municipal Tobacco Campany,Xingren 562300,Guizhou,China;
4 Environmental Protection Bureau of Dehong District,Mangshi 678400,Yunnan,China;
5 Wuxi Park Construction and Engineering Management Department,Wuxi 214072,Jiangsu,China
The best surface sterilization method and isolation medium of endophytic bacteria in tobacco were determined by grinding separation and surface sterilization ef ficacy check.Results showed that isolation and disinfection effect of soaking by 1% NaClO (5 min) +75% alcohol (2 min) was better in that surface epiphytic bacteria can be 100% eliminated and more bacteria can be separated.Four isolating media including Nutrient Agar (NA),Tryptic Soy Agar (TSA),Potato Dextrose Agar (PDA),Luria - Bertani medium (LB) were utlized to isolate endophytic bacteria from tobacco,aiming at comparing difference of isolation effect between them.Results showed that the isolation effect of TSA and NA was better than that of other media,while LB and PDA showed the lowest isolation effect.The amount of bacteria isolated from root,stem,leaf by TSA medium were 5.18 log cfu/g.fw,2.17 log cfu/g.fw,4.69 log cfu/g.fw respectively.The amount of bacteria isolated from root,stem,leaf by NA medium are 5.01 log cfu/g.fw,1.81 log cfu/g.fw,4.93 log cfu/g.fw respectively.The 16S rDNA of 127 endophytic strains were sequenced.Nine,seven and 13 different kinds of bacteria were isolated from root,stem,leaf by TSA medium respectively while only 8,6 and 10 different kinds of bacteria isolated from root,stem,leaf by NA medium.These results indicated that TSA and NA medium were suitable for isolating endophytic bacteria in tobacco by which ideal separating effect can be obtained.
tobacco;endophytic bacteria;separation;optimization
10.3969/j.issn.1004-5708.2014.01.017
TS414
A
1004-5708(2014)01-0090-06
由云南省烟草公司科技项目(2012YN06)、昆明学院大学生科学研究项目(XJDNX010)、国家自然科学基金项目(30860017)
陈泽斌(1985—),博士,讲师。主要研究方向:烟草内生细菌多样性,Email:zbchenkmu@163.com
2013-06-04
