时间分辨荧光免疫分析法检测心肌肌钙蛋白Ⅰ方法学的建立及临床应用①
2014-11-27卢玲玲潘晓夫邹立林高基民
张 洁 卢玲玲 潘晓夫 邹立林 高基民
(温州医科大学检验医学院生命科学学院,温州 325035)
在中国,每年大约新发500万例急性心肌梗死(Acute myocardial infarction,AMI),并呈快速增长的趋势。AMI起病急,病死率高,随着现代医学手段的进步,AMI的致死率已从30%下降到10%,但仍大约有54万的AMI患者在发病的第一周死亡[1]。因此寻找一个早期快速准确诊断AMI的心肌标志物刻不容缓。cTnI(cardiactroponin I,cTnI)是目前WHO推荐的急性心肌梗死早期诊断、疾病监测和预后评价的心肌标志物。肌钙蛋白I(cTnI)是组成心肌肌钙蛋白复合物的亚单位之一,具有高度的心肌特异性。快速、灵敏、准确测定人血中的cTnI对于诊断急性心肌梗死、急性冠状动脉综合征的危险分层、监测各种因素所导致的心肌损伤以及心脏事件的判断预后等有着重要的意义[2]。
目前,检测cTnI的方法有酶联免疫吸附法。胶体金法。质谱法以及微粒子化学发光法等等。由于检测方法的多样性,因此尚未统一建立一个标准化的检测系统,造成了不同医院和实验室之间的参考范围不一致,结果不统一,延误AMI的诊断和治疗。建立一个统一的cTnI参考范围以及标准化检测系统是刻不容缓的。
时间分辨荧光免疫分析技术(Time resolved fluorescence immunoassay,TRFIA)是继放射免疫技术、酶联免疫吸附技术、免疫荧光技术和化学发光免疫技术之后的新一代免疫学诊断技术,它以镧系元素稀土离子标记为特征,具有反应迅速、灵敏度高、信噪比低及无放射性污染等优势,具有更宽的检测线性范围及更好的检测性能。标准化的TRFIA检测系统已经在白喉的毒素中和试验以及风疹的疾病监控中作为标准方法[3-5]。
本文中,我们创建的时间分辨荧光免疫分析结合双抗体夹心技术快速准确检测血清中的cTnI,通过优化这一新型的TFRIA检测系统并将其运用于临床后,与心肌损伤的其他传统诊断方法相比,具有操作简单、灵敏度高和无放射性污染等优势。
1 材料与方法
1.1 实验标本 采集532份无抗凝剂的空腹血,37℃孵育15~30 min,凝固后3 000 r/min离心5 min,分离上清,保存至-80℃,待用。所有标本采集于2013年3月~7月瑞安市人民医院和瑞安市中医院,所有病人均告知《受试者知情同意书》。
1.2 实验方法
1.2.1 试剂和仪器 牛血清白蛋白(BSA),叠氮钠(NaN3)及吐温-20购自 Sigma-Aldrich.(St.Louis,MO,USA);鼠源的单克隆 cTnI抗体(catalog H86465M以及K31341G)以及cTnI标准品购自Meridian(Life Science,Inc.);SephadexG-50 购自 Pharmacia公司Eu3+标记试剂盒、Eu3+荧光增强液及PE2030型时间分辨荧光免疫检测系统均购自Perkin Elmer公司产品;带有滤膜的离心管购自Millipore公司。
1.2.2 固相包被抗体的制备 用碳酸盐缓冲液抗cTnI单克隆抗体 H86465M 稀释成 3 μg/ml,每孔100 μl加入到96孔板中,4℃孵育过夜。第二天从4℃ 冰箱中取出昨天包被的96孔板,倾去包被液,拍干;加入含有2%BSA的封闭液,每孔150 μl,室温封闭2 h,倾去封闭液,拍干,铝箔袋真空包装,-20℃冷冻保存。
1.2.3 Eu3+标记抗体的制备和纯化 标记前抗cT-nI单克隆抗体K31341G(1 mg,5.56 mg/ml)进行标记前纯化处理,以除去磷酸盐、叠氮钠等干扰标记反应的物质,将螯合试剂加入到盛有待标记抗体K31341G的EP管中,混合均匀。置于冷库环境中的摇床上孵育,4℃ 过夜(孵育时间至少14 h)。用Sephadex-50对样品进行洗脱,蛋白检测仪显示出现蛋白峰时(约5 min),开始收集样品。根据280 nm蛋白的吸光度的高低选择吸光度高的几管合并,并用0.22 μm滤膜对目的产物进行过滤除菌。标记抗体的长期保存方法:将高纯度的BSA加入到标记抗体溶液中,BSA终浓度为0.1%,4℃ 或-20℃ 保存。
1.3 分析性能评价
1.3.1 标记抗体稳定性 标记抗体分别在37℃保存7 d以及在4℃保存半年和一年。将cTnI标准蛋白稀释成 6 个浓度(0、0.24、1.2、6.0、30.0、150 μg/L)来验证标记抗体的稳定性。
1.3.2 标准曲线绘制 将cTnI标准蛋白稀释成0 μg/L(A),0.5 μg/L(B),2.5 μg/L(C),12.5 μg/L(D),62.5 μg/L(E)以及312.5 μg/L(F)六个点,每个点测试5次,并由PE2030自带软件绘制成标准曲线。
1.3.3 空白及最低检测限 空白及最低检测限严格按照国际临床化学标准委员会(NCCLS)的EP17-A程序进行检测。空白检测限使用的是无cTnI蛋白的血清标本;最低检测限采用无AMI的患者血清,稀释5倍后检测。空白及最低检测限检测标本均分为两个批次,检测6次,连续5 d。
1.3.4 分析精密度 根据国际临床化学标准委员会(NCCLS)的EP5-A2方案,分别用三个批次(标记为20121110、20130512和20131117)的试剂检测血清中 cTnI高、中、低三个浓度(0.75 μg/L、3.75 μg/L和 187.5 μg/L)各3次/d,连续20 d,分别计算批内及批间的变异系数。
1.3.5 正常参考范围 检测300份无明显临床疾病的正常体检血清标本(男∶女 =162∶138,年龄38.63±15.98岁,无X光,心电图及血糖血脂的改变),确定TRFIA法检测cTnI的正常参考范围。
1.3.6 方法学比较 将86份标本同时进行CLIA(微粒子电化学发光法chemiluminescent immun-oassay,CLIA,仪器 Architect I2000,试剂批号 Architect cTnI kit code 41059UN13)和TRFIA(时间分辨免疫检测法)检测,检测结果进行线性回归计算其相关系数。
1.3.7 临床应用 通过对临床上的cTnT,CK-MB(由CLIA法检测)和心电图以及治疗前后cTnI(由TRFIA法检测)的比较,验证TRFIA法检测cTnI的诊断及疾病监测效能。
1.4 统计学方法 所有的统计结果由SPSS18.0计算得到,P<0.05认为具有统计学差异。
2 结果
2.1 Eu3+标记抗体的稳定性 试剂在37℃ 7 d以及在4℃半年或一年均保持稳定,见表1。

表1 标记抗体的稳定性Tab.1 Stability of antibody
2.2 空白及最低检测限 所有的数据呈正态分布,空白检测限(LoB)为 0.028 μg/L;最低检测限(LoD)为 0.052 μg/L(计算公式:LoB:0.002 0 ±0.013 0,LoB=average+2SD;LoD:0.005 2 ±0.011 9,LoD=LoB+2SD)。
2.3 标准曲线及线性范围 标准曲线:Y=7 485.878+1 400.924X,Y代表荧光值,X为cTnI浓度,相关系数为0.999,线性范围为0.0~312.5 μg/L,见图1。
2.4 精密度 高中低三个血清cTnI浓度的变异系数(CV)分别为:批号20121110为9.1%、9.2%和4.4%;批号20130512为7.1%、4.5%和3.6%;批号20131117为4.2%、6.2%和7.2%。批间变异系数分别为9.4%、8.8%和10%。批内以及批间的变异系数均符合中国体外诊断试剂的标准[6]。见表2、3。
2.5 参考范围 检测300例健康体检病人得到的cTnI结果符合正态分布,其平均值为0.03 μg/L,标准差为0.055,得出TRFIA法检测血清cTnI的95%可信区间为 <0.14 μg/L。将血清中 cTnI值大于0.14 μg/L的患者认定为cTnI阳性。见图2。
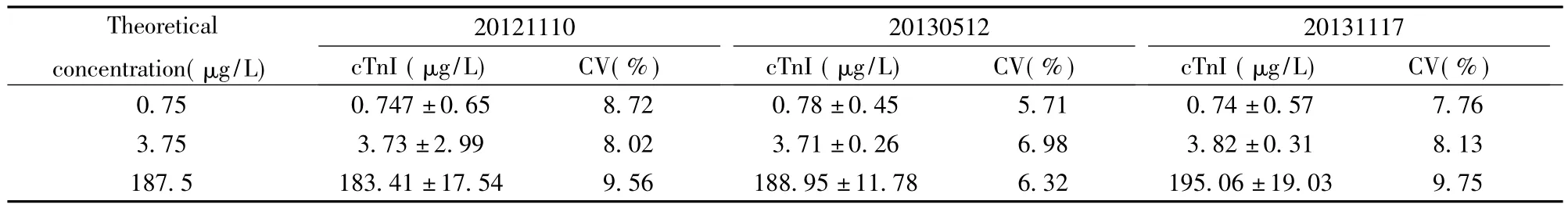
表2 批内精密度Tab.2 Results of intra-assay precision

表3 批间的精密度(n=3×8)Tab.3 Results of inter-assay precision(n=3 ×8)

表4 TRFIA方法的敏感性和特异性Tab.4 Sensitivity and specificity of TRFIA
2.6 ROC工作曲线 为了绘制TRFIA检测血清cTnI的ROC工作曲线,收集232份疑似AMI患者血清(男∶女 =118∶114,年龄18~86 岁,平均53.61 ±13.00岁)。结合临床,共有197名患者确诊为AMI。TRFIA的敏感性为96.45%,特异性为91.43%,准确度为95.69%,阳性预示值为98.45%,阴性预示值为82.05%。ROC的曲线下面积(AUC)为0.971。见表4、图 3。
2.7 方法学比较 为了进一步验证TRFIA法的临床应用效能,收集86份患者血清,用TRFIA法以及临床在用的CLIA法同时进行检测。线性回归结果显示,两者具有良好的相关,回归方程为Y=0.727X+0.338(Y为CLIA法结果,X为TRFIA法结果),相关系数为0.993。该结果显示,我们新创的TFRIA法可用于临床血清标本中cTnI的检测,见图4。
2.8 临床的应用 与传统用于诊断AMI的心电图(Electrocardiography,ECG)[22],肌酸激酶同工酶 MB(creatine kinase-MB,CK-MB)和 cTnT(cardiac-troponin T,cTnT)对比后显示:TRFIA检测的血清cTnI与上述三种指标没有显著差异,其P值分别为0.258、0.848和0.828。

图1 TRFIA方法的标准曲线Fig.1 Standard curve of TRFIA method
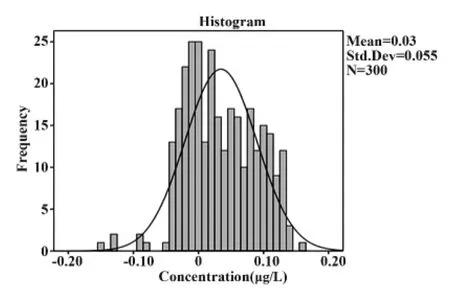
图2 参考范围的正态分布图Fig.2 Gaussian curve of reference values

图3 TRFIA的ROC工作曲线Fig.3 ROC curve of TRFIA

图4 CLIA和TRFIA方法比较的线性回归图Fig.4 Comparison between CLIA and TRFIA

表5 cTnI和ECG的比较Tab.5 Comparison between results of cTnI and ECG
为了验证cTnI在监测疾病进程中的作用,我们收集了81例临床确诊的AMI患者的第1天及治疗后第7天的血清标本,结果显示:第1天患者血清中cTnI浓度为(111.76±57.03)μg/L,第7天的血清浓度为(1.81±1.31)μg/L,该结果具有显著的统计学差异,提示TRFIA方法检测的血清cTnI具有较好的疾病检测作用。见表5。
3 讨论
目前已有多种实验室诊断方法应用于急性心肌梗死的临床诊断。从检测原理方面来看,基本上可分为荧光免疫分析法、放射免疫分析法、酶免疫分析法、化学发光免疫分析法和时间分辨荧光免疫分析法等。酶免疫分析法及化学发光免疫分析法现已应用于急性心肌梗死的临床诊断。时间分辨荧光免疫分析法较目前使用的ELISA、化学发光免疫分析、胶体金分析等,具有更高的灵敏度和更宽的线性范围,定量准确快速,从而对急性心肌梗死、轻微心肌缺血性损伤、不稳定性心绞痛和心肌炎等疾病做出更为准确的诊断,具有广阔的产业化前景。
在本研究中,我们成功构建时间分辨荧光免疫分析法(TRFIA)检测肌钙蛋白I(cTnI)。该检测方法的标准曲线方程为Y=7 485.878+1 400.924X,剂量-反应线性相关系数为0.999,标准曲线检测范围是0.0~312.5 μg/L,检测体系最低检测量为0.052 μg/ml,稳定性试验表明三批不同保存时间和条件的检测用试剂相应的标准曲线未发生明显偏移。TRFIA方法检测cTnI标准品的批内精密度和批间精密度均<10%,符合2010版《中国药典》中有关体外诊断试剂的应用要求[6]。
通过对300例健康体检人员血清标本的检测结果确定TRFIA方法检测cTnI的参考范围,确立TRFIA方法检测血清标本中cTnI阳性确认值为0.14 μg/ml。该阳性确认值比2003年魏景艳[7]采用酶联免疫分析法(Enzyme-linked immuno sorbent assay,ELISA)检测血清标本中cTnI浓度方法略低(其阳性确认值为0.8 μg/ml),说明TRFIA方法具有较高的灵敏度。
通过TRFIA方法检测健康体检人员血清标本和急性心肌梗死患者血清标本,得出TRFIA方法的敏感性为96.45%,特异性为91.43%,准确度为95.69%;阳性预示值为98.45%,阴性预示值为82.05%。ROC的曲线下面积(AUC)为0.971,该数据较为理想,结果特异可靠,能应用于临床,作为心肌损伤的特异性标记物。
通过比较81位急性心肌梗死治疗前后的两组血清标本,TRFIA方法检测结果的差异明显,P<0.001,具有较好的AMI疾病监测价值。
目前检测cTnI较好的方法是采用电化学发光免疫分析,灵敏度较高而且能较为准确地进行定量分析,但需要昂贵的仪器和试剂。时间分辨荧光免疫分析作为最灵敏的免疫学检测方法,在许多免疫指标的检测中较其他方法更具优势:如更高的灵敏度、更宽的线性范围,定量更精确等等。本试验成功的构建了时间分辨检测心肌肌钙蛋白I方法并应用于临床。
[1]Doug WJ,An J,Xing J,et al.Structural transition of the inhibitory region of troponin I within the regulated cardiac thin filament[J].J Arch Biochem Biophys,2006,456(2):135-142.
[2]Thygesen K,Alpert JS,Jeffe AS,et al.Third universal definition of myocardial infarction[J].JAm CollCardiol,2012,60:1581-1598.
[3]MaplePA,Efstratiou A,George RC,et al.Diphtheria immunity in UK blood donors[J].Lancet,1995,345:963-965.
[4]Maple PAC,Jones CS.Time-resolved fluorometric immunoassay for rubella antibody-a useful method for serosurveillance studies[J].Vaccine,2002,20:1378-1382.
[5]Maple PAC,Gray J,Breuer J,et al.Performance of a time-resolved fluorescence immunoassay for measuring Varicella-Zoster virus immunoglobulin G levels in adults and comparison with commercial enzyme immunoassays and Merck glycoprotein enzyme immu-noassay[J].Clin Vaccine Immunol,2006,13:214-218.
[6]中国药物化学委员会.《中国药典》体外诊断试剂规程2010版[M].北京:中国医药科技出版社:2010:237-248.
[7]魏景艳,卜丽莎,童玉军,等.心肌肌钙蛋白I单克隆抗体制备及酶免疫法的建立[J].中华检验医学杂志,2003,26(6):368-370.