流式细胞术检测小鼠腹腔巨噬细胞吞噬能力的方法学探讨①
2014-11-27陈东亚陆罗定杨明晶
陈东亚 陆罗定 俞 萍 卞 倩 徐 军 杨明晶
(江苏省疾病预防控制中心,毒理与功能评价所,南京 210009)
巨噬细胞是固有免疫系统的重要成员,具有吞噬、清除及呈递抗原异物的生物学功能,是维持机体的正常生理状态所必需的[1]。传统的显微镜镜检记数法检测巨噬细胞吞噬能力存在主观性强、重复性差及耗时长等缺点,影响实验结果的客观性与准确性。流式细胞仪技术用于巨噬细胞的吞噬率检测可以轻易地将观察细胞数从几百上升至几千,而且具有分析速度快、重复性好和特异性强等优点。荧光微球被细胞吞噬后,其荧光信号可迅速被流式细胞仪检测,具有荧光信号的巨噬细胞即视为出现吞噬现象,可快速、准确地测定巨噬细胞的吞噬率[2-5]。《保健食品检验与评价技术规范增强免疫力功能评价方法(征求意见稿)》中要求用小鼠腹腔巨噬细胞吞噬荧光微球试验替代巨噬细胞吞噬鸡红细胞实验[6],本研究的主要目的是在征求意见稿的基础上,摸索最佳实验条件,从而使该方法能灵敏、稳定的反映小鼠腹腔单核-巨噬细胞吞噬能力。
1 材料与方法
1.1 动物、试剂及仪器 SPF级ICR小鼠,18~22 g,5~6周龄,雌性,上海斯莱克实验动物有限责任公司提供,动物生产许可证:SCXK(沪)2012-0002;羧酸盐修饰荧光微球(F8827)为美国Invitrogen产品;牛血清白蛋白(Bovine serum albumin fractionⅤ,BSA)为美国AMERSCO公司产品,无支原体新生小牛血清为浙江天杭生物科技有限公司产品;Hank’s液为Gibco产品;PBS为实验室自行配制;流式细胞仪(BD Accuri®C6)为美国Becton Dickinson公司产品;金葵素胶囊(Jinkuisu capsule,JKS)由江苏苏中药业集团股份有限公司提供。
1.2 方法
1.2.1 预调理荧光微球 取荧光微球与1%BSA以1∶100体积比混匀,微球浓度为4.5×106个/ml,37℃避光孵育30 min,超声处理5 min,临用前配。
1.2.2 小鼠腹腔巨噬细胞的制备 实验前4 d给每只小鼠腹腔注射0.2 ml 2%绵羊血红细胞以激活小鼠巨噬细胞。实验当天用颈椎脱臼法处死小鼠,腹腔注射加5%小牛血清的Hank's液5ml/只,轻轻按揉腹部20次,以充分洗出腹腔巨噬细胞,然后将腹壁剪开一个小口,吸取腹腔洗液2 ml用75 m(200目)过滤器过滤至试管内,经计数,腹腔巨噬细胞数为2 ×105~4 ×105ml-1。
1.2.3 吞噬实验
1.2.3.1 不同细胞浓度、微球浓度、孵育时间的摸索 三块六孔板,上排每孔加1 ml制备的腹腔原液,下排每孔加1 ml经Hank's液1∶1稀释的腹腔液(巨噬细胞数为1×105~2×105ml-1),每板第一列每孔加调理的荧光微球1.1 ml,第二列每孔加荧光微球2.2 ml,第三列每孔加3.3 ml,即微球浓度分别为5×106/孔、1×107/孔和 1.5×107/孔。分别于37℃二氧化碳细胞培养箱避光孵育1、1.5和2 h后,弃上清,每次使用2.0 ml 4℃PBS缓冲液轻轻洗涤2次,去上清后再加入4℃ PBS缓冲液0.5 ml,用细胞刮刮下贴壁细胞,轻轻吹打均匀后经75 m过滤器过滤后上机分析,实验重复5次。
1.2.3.2 不同巨噬细胞消化方法 一块六孔板,每孔加1 ml制备的腹腔原液和调理的荧光微球2.2 ml,于37℃二氧化碳细胞培养箱避光孵育1.5 h后,弃上清,每次使用2.0 ml 4℃PBS缓冲液轻轻洗涤2次,去上清后再加入4℃ PBS缓冲液0.5 ml,上排每孔加2 ml 0.25%Na2EDTA-胰酶消化液,下排每孔加2 ml 0.02%EDTA消化液,37℃消化30 min,弃消化液,上排加含5%小牛血清的Hank's液4 ml反复吹打,下排加不含血清的Hank's液4 ml反复吹打,收集细胞,1 500 r/min,5 min离心洗涤2次,重悬于0.5 ml 4℃ PBS缓冲液中,经75 m过滤器过滤后上机分析,实验重复5次。
1.2.4 流式细胞仪检测 先在FSC和SSC二维散点图选取巨噬细胞区域,在FSC-H和SSC-A图中去除粘连体细胞,然后再以SSC和FL2(FITC)直方图检测FITC阳性的巨噬细胞,以此视作吞噬荧光微球的巨噬细胞,检测5 000个靶细胞,FITC阳性细胞比例即为巨噬细胞吞噬率(PP),在直方图中通过标尺标定未吞噬荧光微球的巨噬细胞群和吞噬荧光微球的巨噬细胞群,经软件分析未吞噬荧光微球的巨噬细胞和吞噬不同数量荧光微球的巨噬细胞的比例。吞噬指数(PI)=被吞噬的荧光微球总数/巨噬细胞总数,其中,被吞噬的荧光微球总数=吞噬1个荧光微球的巨噬细胞总数×1+吞噬2个荧光微球的巨噬细胞总数×2+吞噬3个荧光微球的巨噬细胞总数×3+吞噬4个荧光微球的巨噬细胞总数×4+吞噬5个荧光微球的巨噬细胞总数×5,以此类推。
1.2.5 流式细胞术检测金葵素胶囊对小鼠腹腔巨噬细胞吞噬功能的影响 40只ICR小鼠随机分成4组,分别为阴性对照组、247、495、1 485 mg/kg BW 金葵素胶囊处理组,金葵素胶囊取内容物用纯净水调配成受试浓度,灌胃容积为20 ml/kg BW,阴性对照组以等容积纯净水灌胃,连续灌胃30 d,按1.2.2方法获取巨噬细胞,调整浓度至1×105~2×105ml-1,荧光微球浓度为1×107/孔,37℃孵育1 h后进行检测。
1.2.6 鸡红细胞法检测金葵素胶囊对小鼠腹腔巨噬细胞吞噬功能的影响 按1.2.5方法进行分组和灌胃,按《保健食品检验与评价技术规范》2003年版增强免疫力功能中方法进行小鼠腹腔巨噬细胞吞噬功能的检测。
1.3 统计学分析 吞噬百分率需进行数据转换,X=Sin-1,式中 P为吞噬百分率,所得数据经SPSS17.0单因素方差分析。
2 结果
2.1 巨噬细胞吞噬荧光微球实验 流式细胞仪分析和数据获取结果。图1是流式细胞仪分析结果图,图1A为FSC和SSC单个细胞二维散点图,R1为巨噬细胞,图1B为FL2(FITC)直方图,通过标尺标定吞噬荧光微球的巨噬细胞群。
2.2 不同细胞浓度、微球浓度、孵育时间对巨噬细胞吞噬率和吞噬指数的影响 由表1可见,微球浓度越高,吞噬率和吞噬指数越大;细胞浓度为1×105~2 ×105ml-1,孵育时间 1.5 h,微球浓度为 1.5 ×107/孔时吞噬率(PP)和吞噬指数(PI)最高(89.87%,1.54),孵育至2 h时出现下降(57.71%,1.51);细胞浓度对吞噬率和吞噬指数的影响与荧光微球浓度呈负相关。
2.3 不同巨噬细胞消化方法对巨噬细胞吞噬率和吞噬指数的影响 贴壁巨噬细胞经胰酶加EDTA消化后PP为44.51%,PI为0.68,单独使用EDTA消化后PP为37.92%,PI为0.57,均低于使用细胞刮刀处理组。
2.4 金葵素胶囊对小鼠腹腔巨噬细胞吞噬功能的影响 用流式细胞术法检测金葵素胶囊对小鼠腹腔巨噬细胞吞噬功能的影响(表2),可见灌胃30 d后,中、低剂量组吞噬率和吞噬指数与对照组比差异无统计学意义,但高剂量组吞噬率(PP)与对照组相比差异有统计学意义(P<0.05);鸡红细胞法检测结果(表3)与流式法一致,说明流式细胞术法可以用于研究小鼠腹腔巨噬细胞的吞噬能力,与传统方法相比结果有一致性。

图1 吞噬荧光微球后的小鼠腹腔巨噬细胞FSC-SSC二维散点图和FL2直方图Fig.1 Dot-plot of FSC-SSC and histogram of FL2 of mouse peritoneal macrophages treated with fluorescent microspheres
表1 不同巨噬细胞浓度、不同微球浓度、孵育时间对巨噬细胞吞噬率和吞噬指数的影响()Tab.1 Effects of different concentration of peritoneal macrophages,fluorescent microspheres and incubation time on phagocytosis()

表1 不同巨噬细胞浓度、不同微球浓度、孵育时间对巨噬细胞吞噬率和吞噬指数的影响()Tab.1 Effects of different concentration of peritoneal macrophages,fluorescent microspheres and incubation time on phagocytosis()
Note:Compared with 5×106/well fluorescent microspheres,1 h group,1)P <0.05;compared with 2 h incubation time group,2)P <0.05;compared with 2 ×105 -4 ×105ml-1cell,1.5 h group,3)P <0.05.
Cell concentration Time/well 1.5×107 Concentration of fluorescent microspheres 5×106/well 1×107 PI 2×105-4×105ml-1 1 h 68.25±1.342) 1.20±0.21 73.98±1.972) 1.30±0.12 77.29±2.331)2)/well PP(%) PI PP(%) PI PP(%)8 57.71±1.68 1.51±0.13 1.35±0.15 1.5 h 73.47±1.872) 1.19±0.34 78.26±2.112) 1.26±0.18 80.63±1.342) 1.44±0.19 2 h 57.24±1.46 1.18±0.22 59.78±2.46 1.22±0.24 64.52±2.40 1.34±0.20 1×105-2×105ml-1 1h 72.06±1.162) 1.26±0.22 73.99±1.322) 1.25±0.23 77.04±1.242) 1.32±0.17 1.5 h 80.62±1.582) 1.35±0.21 82.57±2.102) 1.38±0.14 89.87±1.221)2)3)1.54±0.21 2 h 52.90±1.95 1.36±0.15 56.10±1.58 1.40±0.1
表2 流式细胞术法检测金葵素对小鼠腹腔巨噬细胞吞噬功能的影响(,n=10)Tab.2 Effect of JKS on influencing phagocytosis of mouse peritoneal macrophages by flow cytometry assays(,n=10)
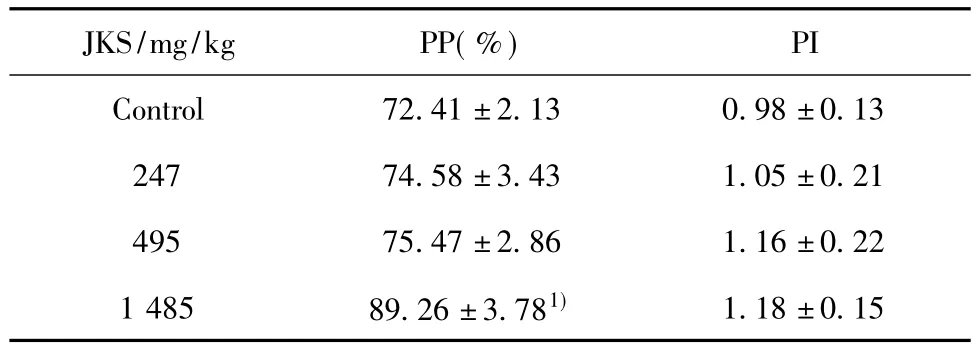
表2 流式细胞术法检测金葵素对小鼠腹腔巨噬细胞吞噬功能的影响(,n=10)Tab.2 Effect of JKS on influencing phagocytosis of mouse peritoneal macrophages by flow cytometry assays(,n=10)
Note:Compared with control,1)P < 0.05.
JKS/mg/kg PP(%)PI 1.18±0.15 Control 72.41±2.13 0.98±0.13 247 74.58±3.43 1.05±0.21 495 75.47±2.86 1.16±0.22 1 485 89.26±3.781)
表3 鸡红细胞法检测金葵素对小鼠腹腔巨噬细胞吞噬功能的影响(,n=10)Tab.3 Effect of JKS on influencing phagocytosis of mouse peritoneal macrophages by chicken red blood-cell method(,n=10)

表3 鸡红细胞法检测金葵素对小鼠腹腔巨噬细胞吞噬功能的影响(,n=10)Tab.3 Effect of JKS on influencing phagocytosis of mouse peritoneal macrophages by chicken red blood-cell method(,n=10)
JKS/mg/kg PP(%)PI Control 16.70±3.40 0.26±0.16 247 17.60±7.71 0.28±0.13 495 22.10±7.25 0.33±0.11 1 485 24.20±6.301)0.36±0.11
3 讨论
本研究在征求意见稿的基础上经多次实验,摸索了可能影响吞噬率和吞噬指数的实验条件:巨噬细胞浓度、微球浓度、孵育时间及酶消化方法。
实验发现,荧光微球的浓度对吞噬率有一定程度的影响,微球浓度越高,吞噬率越高。可见巨噬细胞的吞噬能力很强,不易达到饱和。但荧光微球浓度过高会增加实验成本,故而从经济角度出发,选用1×107/孔即已足够。
2 ×105~4 ×105ml-1和1 ×105~2 ×105ml-1两个浓度的巨噬细胞在1 h时吞噬率无显著性差异,但当细胞浓度1×105~2×105ml-1,微球浓度1.5×107/孔,孵育1.5 h时吞噬率与2×105~4×105ml-1组有显著性差异,分析原因:1.5 h孵育结束时,由于2×105~4×105ml-1组细胞数过多,未稀释的巨噬细胞组6孔板上清漂浮一层粘附有荧光微球的巨噬细胞,吸附在孔底的巨噬细胞没有足够的荧光微球吞噬,所以未稀释的巨噬细胞的吞噬率低于低浓度的巨噬细胞。
小鼠腹腔巨噬细胞对荧光微球的吞噬率随孵育时间的延长而增高,但1.5 h吞噬率达到最高,2 h时却出现下降。与之前相关报道不一致[7],推测可能是由于胞吞胞吐作用,吞噬了荧光微球的巨噬细胞排出了一部分荧光微球。但该理论还需要进一步论证。综上可见1×105~2×105ml-1细胞浓度,1×107/孔微球浓度,孵育1 h,可使实验快速而又精确的反应巨噬细胞的吞噬率。
由于使用细胞刮刀将贴壁细胞刮下时易造成碎片过多,易抱团等问题,故而尝试使用酶消化法,但是试验中发现巨噬细胞贴壁非常牢固,酶消化30 min无法充分消化,只能部分上清上机测试,导致吞噬率和吞噬指数偏低,不能准确反应巨噬细胞吞噬能力,且消化时间过长,操作步骤多,对于大批量样本检测有难度,所以不推荐使用酶消化法。另外,腹腔原液吸出后建议放入硬质塑料试管中,常用的1次性塑料软试管巨噬细胞非常容易吸附,易导致细胞计数浓度和使用浓度相差太大,影响实验结果。
综上所述,流式细胞术法检测巨噬细胞吞噬能力的方法是可行的,优化后能更快速、精确地反映巨噬细胞吞噬能力,与传统鸡红细胞法相比结果具有一致性。后续研究需完善实验方法,并进一步开发流式细胞仪在测定保健食品增强免疫力功能的应用。
[1]Shao X,Mednick A,Alvarez M,et al.An innate immune system cell is a major determinant of species-related susceptibility differences to fungal pneumonia[J].J Immunol,2005,175(5):3244-3251.
[2]石芳芳,李成华,宋林生,等.用流式细胞仪测定扇贝血细胞吞噬活性[J].生物技术通报,2006,(增刊1):430-433.
[3]Drevets DA,Elliott AM.Fluorescence labeling of bacteria for studies of intracellular pathogenesis[J].J Immunol Methods,1995,187(1):69-79.
[4]Brousseau P,Pellerin J,Morin Y,et al.Flow cytometry as a tool to monitor the disturbance of phagocytosis in the clam Mya arenaria hemocytes following in vitro exposure to heavy metals[J].Toxicology,2000,142(2):145-156.
[5]Gaforio JJ,Serrano MJ,Algarra I,et al.Phagocytosis of apoptotic cells assessed by flow cytometry using 7-aminoactinomycin D[J].Cytometry,2002,49(1):8-11.
[6]李 煜,齐丽娟,迈一冰,等.比较流式细胞术和鸡红细胞法检测小鼠腹腔巨噬细胞吞噬功能[J].毒理学杂志,2012,26(2):133-135.
[7]黄 琼,李 志,杨杏芬,等.流式细胞术检测小鼠腹腔巨噬细胞吞噬功能[J].中国药理学与毒理学杂志,2007,21(2):140-146.