能量限制下SIRT1高表达对大鼠卵巢生殖寿命的影响
2014-11-26向延芳傅玉才许锦阶栗丽罗丽莉
向延芳,傅玉才,许锦阶,栗丽,罗丽莉*
(1.解放军第169医院妇产科,衡阳 421002;2.汕头大学医学院细胞衰老实验室,汕头 515041;3.汕头大学医学院第一附属医院妇科,汕头 515041)
始基卵泡自胚胎形成后即进入自主发育和闭锁的轨道,当功能性卵泡完全丧失后,卵巢衰老萎缩进入绝经期[1]。卵泡从卵巢中持续丢失,就好像时钟的指针在不断前进,所以国外有学者将这一现象称为“女性的生物钟”[2]。始基卵泡的储备量与生俱来,如果能延缓卵泡成熟的速度,减少卵泡的凋亡将可能延长女性的生育年限[3]。能量限制(CR)是一种目前公认的有效延缓衰老的方法,不仅能延缓衰老,还能延缓和预防一些与年龄相关疾病的发生发展[4-5]。本实验中对成年期大鼠限制其能量摄入,观察CR后长寿因子SIRT1在卵巢中的定位、表达,探讨其对大鼠卵巢功能和生殖寿命的影响及可能机制,为抗卵巢衰老研究提供新的实验依据。
材料与方法
一、实验动物及分组
由汕头大学医学院实验动物中心提供清洁级健康8周龄雌性Sprague-Dawley(SD)大鼠24只,初始体重(200±10)g。实验期间,动物房室温保持在22℃左右,保持12h自动照明。
动物适应性喂养2周后随机分为:对照组(NC),自由饮水,自由取食;CR组,予NC组食量的65%。标准鼠粮持续喂养8周,饲料(执行标准:GB14924.3-2001,含蛋白质20.11%、脂肪4.84%、粗纤维7.34%)总能量为17.3282MJ/kg。
二、仪器和试剂
仪器:BX-51TRF型生物显微镜(Olympus,日本),普通光学显微镜(云南光学仪器厂),动物饲养层流柜(广州医疗器械厂)。
试剂:苏木精(上海化学试剂采购供应站试剂厂),伊红(上海试剂三厂),戊巴比妥钠(北京化学试剂公司),兔抗鼠SIRT1、β-actin多克隆抗体(Santa Cruz,美国),生物素连接的抗兔IgG抗体(Jackson,美国);ABC(avidin-biotin complex)试剂盒(Vector Laboratories,美国)。
三、研究方法
1.卵巢组织形态学观察及卵泡分类计数:每个卵巢取7张组织切片,切片间隔至少为50μm进行H-E染色。计数每张卵巢组织切片上所有的各级卵泡数(原始卵泡、初级卵泡、次级卵泡、窦状卵泡和闭锁卵泡)。
2.免疫组织化学法(ABC法)检测SIRT1在卵巢组织中的定位和表达:组织切片脱蜡、水化后,3%H2O2作用10min,用PBS缓冲液洗涤切片3次,每次时间为5min。2%的小牛血清白蛋白封闭30min后滴加兔抗鼠SIRT1抗体(一抗),4℃湿盒中孵育过夜;PBS缓冲液洗涤后滴加二抗,室温孵育1h;与ABC试剂反应30min;DAB显色后苏木素复染、1%盐酸酒精分化,脱水、透明、封片。PBS替代一抗作为空白对照。Olympus BX-51型显微镜(日本)下观察并拍照。阳性结果判断:细胞内棕色或棕黄色颗粒为阳性结果。应用SimplePCI软件进行分析计数,灰度值≤55为强阳性,反之为弱阳性。
3.Western blot检测SIRT1蛋白在卵巢中的表达:取新鲜的卵巢放入组织匀浆器中,冰上匀浆提取组织总蛋白,测蛋白浓度;各实验组均上样30μg蛋白,进行SDS-PAGE电泳,转膜;5%脱脂奶粉4℃封闭过夜,分别加入稀释的β-actin或SIRT1抗体约1ml于室温下摇床孵育2h;弃一抗,洗涤后加二抗室温下摇床孵育1h,加入ABC反应试剂,ECL化学发光,暗室下X光片成像。GIS凝胶成像系统(上海 Tanon GIS-2009)分析其灰度值。
四、观察指标
能量摄入:每天称取饲料,计算摄取热量;大鼠体重:每周称取体重记录;腹部脂肪重量:实验结束时分离肾周组织和腹膜后脂肪称重;卵巢组织形态学及卵泡分类计数;STRT1蛋白在卵巢中的定位和表达。
五、统计学方法
结 果
一、两组大鼠每周平均体重比较

图1 两组大鼠体重变化情况
与对照组大鼠比较,CR组的大鼠表现为体重不增或略降,10d左右逐步好转。实验开始后,NC组大鼠体重逐渐增加,实验结束时体重为(235.24±2.88)g,与实验开始时体重[(195.97±3.09)g]相比,差异有统计学意义(P<0.001);CR组的体重也是从实验开始的(200.41±3.02)g逐渐增加到实验结束时的(220.77±2.34)g(P<0.001);实验结束时,CR组的大鼠体重与NC组相比有显著性差异(P<0.05)(图1)。
二、两组大鼠腹部脂肪比较
实验结束时,CR组大鼠的腹部脂肪量为(3.86±0.22)g,明显少于 NC组大鼠[(5.51±0.18)g](P<0.01)。
三、两组大鼠卵巢的卵泡数变化
CR组和 NC组的初级卵泡[(25.2±1.4)vs.(21.9±0.9)]、次级卵泡[(18.0±0.8)vs.(20.5±1.4)]和闭锁卵泡数[(25.2±1.1)vs.(27.8±1.2)]均无统计学差异(P>0.05);但是CR组与NC组相比,原始卵泡数显著增多[(91.5±2.6)vs.(62.3±2.6)],窦状卵泡数显著减少[(15.2±0.6)vs.(23.0±1.8)](P<0.01)。
四、免疫组织化学实验结果
SIRT1在卵巢组织中的卵母细胞和间质组织中均有表达,棕色或棕黄色颗粒可见于细胞浆和细胞核中。NC组卵巢中卵母细胞核内表达,部分强阳性,胞浆弱阳性,周边间质组织部分弱阳性;能量CR组中卵母细胞核强阳性表达,胞浆阳性表达,周边间质组织阳性表达(如箭头所指)(图2)。
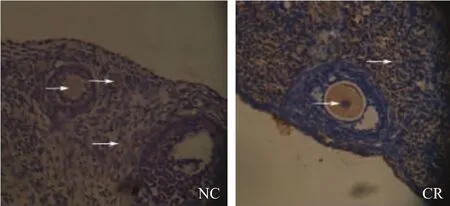
图2 SIRT1蛋白在卵巢中的表达与定位(免疫组化ABC法,×200)
五、CR对大鼠卵巢组织中SIRT1蛋白表达的影响
Western blot检测显示,CR组大鼠卵巢组织中的SIRT1高表达,灰度值扫描值与对照组有显著性差异(P<0.05)。
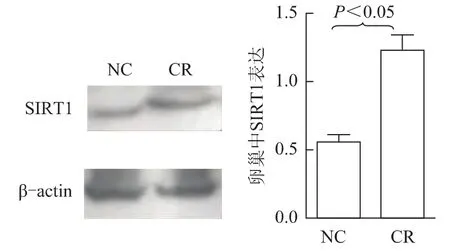
图3 免疫印迹法检测卵巢中SIRT1的表达
讨 论
1935年,McCay等[6]首次报道了CR能显著提高大鼠的平均寿命和最长寿命,后续对酵母、蠕虫、果蝇以及哺乳动物的实验陆续证明,在满足机体对各种营养素需要量的前提下,适当限制能量摄入,能明显延缓衰老的速度。过去的几十年中,美国威斯康星州国立灵长类动物研究中心(WNPRC)和国立卫生院(NIH)动物研究中心一直对延长灵长类动物的寿命进行CR的相关研究[7-8],根据其研究结果,30%左右的CR以及18%的体重下降对于寿命的延长及健康的改善最为有效,因此本研究选用35%作为能量限制作为研究标准。
CR可减少与年龄相关的疾病的发生率在灵长类、人类实验中已有了初步的结果[9-11]。CR是唯一被科学界普遍公认的除遗传操作以外延缓衰老的调控手段,可促进脂肪动员,预防脂类代谢紊乱造成的许多疾病,最终延长寿命。了解CR引起这些效应的作用机制有助于指导人类的饮食和生活方式,起到延缓衰老、预防疾病发生的作用。
本研究中NC组大鼠体重在整个实验过程中持续增加,35%CR组大鼠在经历1周左右的体重不增后缓慢增长。CR组大鼠无营养不良表现,与实验开始时体重相比增加明显,但实验结束CR组的大鼠体重显著低于NC组,CR组腹周脂肪量明显小于NC组,说明减少过度的能量摄入使大鼠的体重减轻、体内脂肪量减少。同时CR组的原始卵泡数比NC组明显增多,窦状卵泡数减少,与Selesniemi等[12]的研究结果一致。由于卵巢的总卵泡数在胚胎时期就已经是确定的,不能再生[13],原始卵泡的数目是女性的基本生殖单位也是卵巢储备的唯一形式[14]。当原始卵泡向着不同级卵泡成熟转化时,原始卵泡不断减少并最终耗竭殆尽。我们的实验结果表明CR可以阻止原始卵泡向成熟卵泡的转化,减少原始卵泡的消耗,保留卵巢的储备从而延长生殖寿命。
Sir2(silence information regulator 2)基因家族是一种保守的从古细菌到哺乳动物都存在的NAD+(烟酰腺嘌呤二核苷酸)依赖的组蛋白/非组蛋白去乙酰基酶,对细胞的分化、代谢、衰老等生理活动都起着十分重要的调节作用[15],是调节生物体衰老进程的一个重要基因,其不仅能从遗传角度影响寿命,还能从CR的代谢角度调节细胞寿命,被认为是CR介导发挥效应的一个关键调节因子[16-17]。研究发现,CR能够引起Sir2的表达上调,并且这一现象从低等生物酵母到高等生物如哺乳类动物、灵长类动物等都普遍存在[18],哺乳动物共有7个Sir2同源基因(SIRT1~SIRT7),其中SIRT1与Sir2的同源性最高[19]。
由于人类寿命明显延长和婚育年龄的推迟,探索如何延长生殖寿命,延缓生殖系统衰老显得至关重要。我们实验研究中CR大鼠卵巢的SIRT1表达增强,卵巢的储备增加,提示SIRT1对于延缓卵巢衰老延长生殖寿命有积极的作用。在关于各种细胞功能的研究中,SIRT1对心脏[20]、胰腺[21]、脑血管[22]等均有保护作用,因此,SIRT1作为治疗不同疾病的靶点越来越被重视。随着研究的深入,它与疾病的相关性将给我们提供新的临床思路,SIRT1有可能作为特定作用靶点具有治疗潜能。
[1]Huang Z,Fragouli E,Wells D.Biomolecules of human female fertility potential therapeutic targets for pharmaceutical design[J].Curr Pharm Des,2012,18:310-324.
[2]Morita Y,Tilly JL.Oocyte apoptosis:like sand through an hourglass[J].Dev Biol,1999,213:1-17.
[3]Hillier SG,Smitz J,Eichenlaub-Ritter U.Folliculogenesis and oogenesis:from basic science to the clinic[J].Mol Hum Reprod,2010,16:617-620.
[4]Omodei D,Fontana L.Calorie restriction and prevention of age-associated chronic disease[J].FEBS Lett,2011,585:1537-1542.
[5]Lebel M,Picard F,Ferland G,et al.Drugs,nutrients,and phytoactive principles improving the health span of rodent models of human age-related diseases[J].J Gerontol A Biol Sci Med Sci,2012,67:140-151.
[6]McCay CM.Iodized salt a hundred years ago[J].Science,1935,82:350-351.
[7]Colman RJ,Anderson RM,Johnson SC,et al.Caloric restriction delays disease onset and mortality in rhesus monkeys[J].Science,2009,325:201-204.
[8]Mattison JA,Roth GS,Beasley TM,et al.Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study[J].Nature,2012,489:318-321.
[9]Sharma N,Bhat AD,Kassa AD,et al.Improved insulin sensitivity with calorie restriction does not require reduced JNK1/2,p38or ERK1/2phosphorylation in skeletal muscle of 9-month-old rats[J].Am J Physiol Regul Integr Comp Physiol,2011,302:R126-136.
[10]Manzanero S,Gelderblom M,Magnus T,et al.Calorie restriction and stroke[J].Exp Transl Stroke Med,2011,3:8.
[11]Chiba T,Tsuchiya T,Komatsu T,et al.Development of calorie restriction mimetics as therapeutics for obesity,diabetes,inflammatory and neurodegenerative diseases[J].Curr Genomics,2010,11:562-567.
[12]Selesniemi K,Lee HJ,Tilly JL.Moderate caloric restriction initiated in rodents during adulthood sustains function of the female reproductive axis into advanced chronological age[J].Aging Cell,2008,7:622-629.
[13]Hartshorne GM,Lyrakou S,Hamoda H,et al.Oogenesis and cell death in human prenatal ovaries:what are the criteria for oocyte selection?[J]. Mol Hum Reprod,2009,15:805-819.
[14]Maheshwari A,Fowler PA.Primordial follicular assembly in humans-revisited[J].Zygote,2008,16:285-296.
[15]Sivaraman P,Mattegunta S,Subbaraju GV,et al.Design of a novel nucleoside analog as potent inhibitor of the NAD dependent deacetylase,SIRT2[J].Syst Synth Biol,2010,4:257-263.
[16]Antosh M,Whitaker R,Kroll A,et al.Comparative transcriptional pathway bioinformatic analysis of dietary restriction,Sir2,p53and resveratrol life span extension in Drosophila[J].Cell Cycle,2011,10:904-911.
[17]Chalkiadaki A,Guarente L.Sirtuins mediate mammalian metabolic responses to nutrient availability[J].Nat Rev Endocrinol,2012,8:287-296.
[18]Corbi G,Conti V,Scapagnini G,et al.Role of sirtuins,calorie restriction and physical activity in aging[J].Front Biosci(Elite Ed),2012,4:768-778.
[19]Greiss S,Gartner A.Sirtuin/Sir2phylogeny,evolutionary considerations and structural conservation[J].Mol Cells,2009,28:407-415.
[20]Chong ZZ,Wang S,Shang YC,et al.Targeting cardiovascular disease with novel SIRT1pathways[J].Future Cardiol,2012,8:89-100.
[21]Schug TT,Li X.Sirtuin 1in lipid metabolism and obesity[J].Ann Med,2011,43:198-211.
[22]Tajbakhsh N,Sokoya EM.Regulation of cerebral vascular function by sirtuin 1[J].Microcirculation,2012,19:336-342.
