1-L-谷氨酸-1-脱氧-D-果糖的热裂解分析研究
2014-11-24毛多斌李山牟定荣彭国岗白晓莉贾春晓杨靖
毛多斌,李山,牟定荣,彭国岗,白晓莉,贾春晓,杨靖
1 郑州轻工业学院烟草科学与工程学院 河南省郑州市科学大道166号 450000;2 红塔集团技术中心,云南省玉溪市 653100
1-L-谷氨酸-1-脱氧-D-果糖的热裂解分析研究
毛多斌1,李山1,牟定荣2,彭国岗2,白晓莉2,贾春晓1,杨靖1
1 郑州轻工业学院烟草科学与工程学院 河南省郑州市科学大道166号 450000;2 红塔集团技术中心,云南省玉溪市 653100
采用热重-微分热重技术研究了1-L-谷氨酸-1-脱氧-D-果糖的热失重和裂解温度,通过在线裂解气质联用技术分别分析研究了无氧和有氧条件下1-L-谷氨酸-1-脱氧-D-果糖在300℃、600℃、750℃和900℃四个温度的热裂解产物。研究结果表明1-L-谷氨酸-1-脱氧-D-果糖的裂解温度为161.3℃,在700℃时失重达到90.50%。无氧和有氧条件下裂解产物的种类和数量随着裂解温度升高而增多,有氧条件下裂解产物总数稍多于无氧条件,但种类有明显差异。 无氧裂解和有氧裂解产物主要为酮类、吡咯类、吡啶类、呋喃类、吡嗪类、吲哚类以及少量芳香族化合物。有氧热裂解产物的香韵分析结果表明1-L-谷氨酸-1-脱氧-D-果糖裂解产物具有烘烤香、坚果香、甜香、花香、奶香等香韵。
1-L-谷氨酸-1-脱氧-D-果糖;热裂解;热重分析;气相色谱-质谱联用
迄今为止,关于烟草中存在的Amadori化合物热裂解研究已有不少报道。Mills[1],Britt[2]等通过裂解炉与气质联用仪结合对不同温度下1-L-脯氨酸-1-脱氧-D-果糖的热裂解进行了研究,分析了1-L-脯氨酸-1-脱氧-D-果糖的裂解及多环芳烃形成途径。Despointes[3],Yaylayan[4]和张敦铁[5]等通过在线裂解气质联用技术对1-L -脯氨酸-1-脱氧-D-果糖在不同温度下的热裂解产物进行了分析,阐述了1-L-脯氨酸-1-脱氧-D-果糖的初级裂解产物和次级裂解产物的形成机理以及裂解产物所具有的香气成分。Keyhani和欧亚非等[6-7]采用在线热裂解气质联用技术分析了1-L-苯丙氨酸-1-脱氧-D-果糖在不同温度下的热裂解产物,阐述了1-L-苯丙氨酸-1-脱氧-D-果糖的裂解产物的种类以及部分裂解产物相对含量随温度变化的规律。Sara[8]和Coleman等[9]通过在线裂解气质联用方法分别对1-L-甘氨酸-1-脱氧-D-果糖和1-L-天冬酰胺-1-脱氧-D-果糖进行了热裂解研究,阐述了pH值和裂解温度对部分裂解产物的影响。毛多斌和芦昶彤[10-11]等通过在线裂解和气质联用技术对1-L-亮氨酸-1-脱氧-D-果糖、1-L-异亮氨酸-1-脱氧-D-果糖、1-L-丙氨酸-1-脱氧-D-果糖在不同温度下的裂解产物进行了分析,通过热重-差热曲线研究了这三种Amadori化合物的热失重特性,阐述了其对卷烟香气所产生的积极影响。由此可见,Amadori化合物热裂解仍是国内外烟草化学研究的重要内容,然而,关于1-L-谷氨酸-1-脱氧-D-果糖的热裂解研究尚未见文献报道。
本文采用TG-DTG和在线裂解气质联用技术对1-L-谷氨酸-1-脱氧-D-果糖进行热裂解研究,探明其热裂解转化特性,分析在不同裂解温度、不同裂解氛围(有氧和无氧)条件下裂解产物的变化,阐释裂解转化途径及裂解产物的香气特征,旨在为其在卷烟中的应用提供参考。该研究有助于人们深入了解和正确评价该物质在卷烟中的作用,对于指导卷烟配方和生产、提高卷烟品质具有重要价值。
1 实验部分
1.1 仪器与试剂
Diamond TG/DTG综合热分析仪(美国Perkin Elmer公司);Agilent GC7890-MS59735型气相色谱-质谱联用仪(美国Agilent公司)CDS 5200热裂解仪(配备热裂解专用石英管,美国CDS公司);AB265-S型电子天平(瑞士METTLER公司)。
1-L-谷氨酸-1-脱氧-D-果糖(纯度≥98%,郑州奥利实业有限公司提供,其结构已经过IR,LC-MS和NMR表征)。所有风味物质对比参照物购于sigma或百灵威公司,且为市售最高纯度商品。
1.2 实验方法与条件
1.2.1 TG-DTG分析
首先称取10 mg样品,放置于高纯氧化铝坩埚中,然后将热重分析仪控制温度调整为20℃~700℃,以10℃/min的速率在氮气保护的条件下进行升温。在持续升温的过程中氮气的流速为100 mL/min。
1.2.2 在线裂解气质联用(Py-GC-MS)分析
裂解氛围:无氧条件为氮气;有氧条件为10%氧气和90%氮气。
称取固体样品0.40 mg,加入中空小石英管中,两端塞入石英棉,将其置于热裂解仪的裂解头加热丝中。
热裂解条件:初始温度为25℃,保持8 min,以1℃/min升温到72℃;接着以5℃/min升至280℃,保持5 min,然后以20℃/s的速度分别升温到300℃、600℃、750℃、900℃保持10s。最后在氦气的氛围中将裂解产物导入GC-MS进行分析。
气相色谱条件:DB-5MS型弹性石英毛细管色谱柱(30 m×0.25 mm,0.25μm);进样口温度:280℃,进样量:1μL;载气选择高纯氦气(纯度99.9999%);升温程序:50℃保持2 min,然后以5℃/min升到280℃,保持20 min;分流比为25:1。
质谱条件:电子轰击离子源(EI),离子源温度:230℃,电离能量70 ev,传输线温度280℃,质量扫描范围30~550 amu。利用NIST11标准谱库联机定性检索。
2 结果与讨论
2.1 TG-DTG图谱分析
TG-DTG分析结果如图1。从图1可以看到DTG曲线上在161.3℃有一个明显的峰,在此温度下样品的失重速率达到最大。从TG曲线上可以看到,随着温度的升高,1-L-谷氨酸-1-脱氧-D-果糖有两次明显的失重过程,第一次失重过程发生在120℃-215℃,第二次失重过程发生在215℃-500℃,第一次过程中样品失重由12.08%增加到54.97%,变化率达42.89%,第二次失重过程中样品失重由54.97%增加到85.00%,变化为30.03%。失重温度达700℃时,样品总失重达到90.50%,综合TG-DTG的曲线分析我们还可以看出这种化合物为没有熔点的化合物,裂解温度为161.3℃。

图1 1-L-谷氨酸-1-脱氧-D-果糖TG-DTG分析Fig.1 TG-DTG analysis of 1-L-glutamic-1-deoxy-D-fructose
2.2 裂解产物分析
对1-L-谷氨酸-1-脱氧-D-果糖分别在300℃、600℃、750℃、900℃温度下无氧和有氧热裂解产物进行鉴定,其中2-甲基吡嗪等23种化合物的结构采用与标准品相对照的方法进行鉴定,即在与裂解产物相同的实验条件下对混合标样进行GC-MS分析,通过对比标准品的保留时间和质谱图,确定裂解产物中这些化合物的结构;裂解产物中其他化合物的结构鉴定采用检索NIST 11质谱数据库并结合人工解析的方法。各组分的相对含量采用峰面积归一法测定。为了保证实验的重复性,每个温度平行测定3次并计算各组分相对含量的相对标准偏差,得到其相对标准偏差为0.52%~4.98%。结果表明裂解试验具有很好的重复性。结果见表1。

表1 不同温度下1-L-谷氨酸-1-脱氧-D-果糖热裂解产物分析结果Tab.1 Analysis on pyrolysis products of 1-L-glutamic-1-deoxy-D-fructose under different temperatures

表1 (续)

表1 (续)
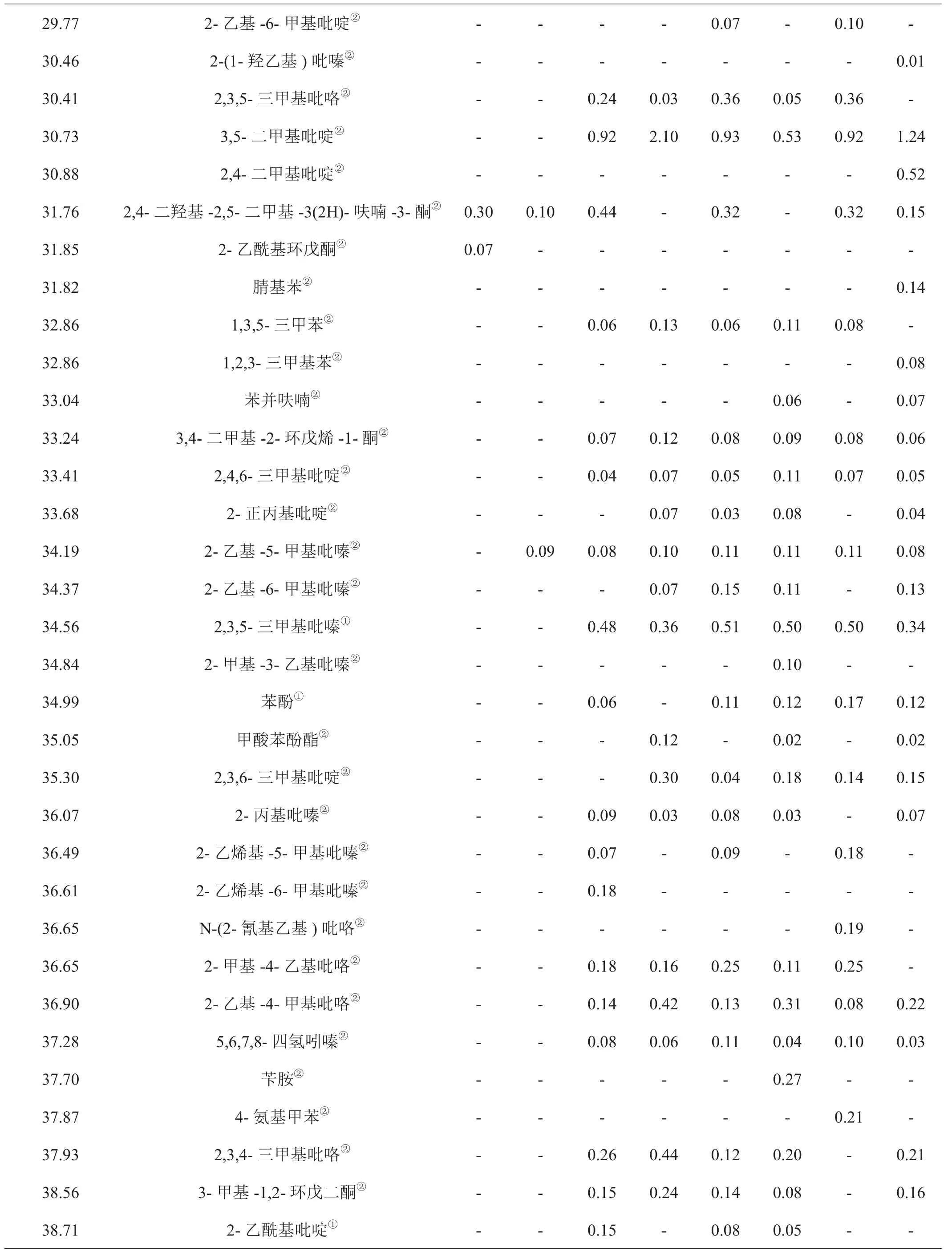
表1 (续)

表1 (续)
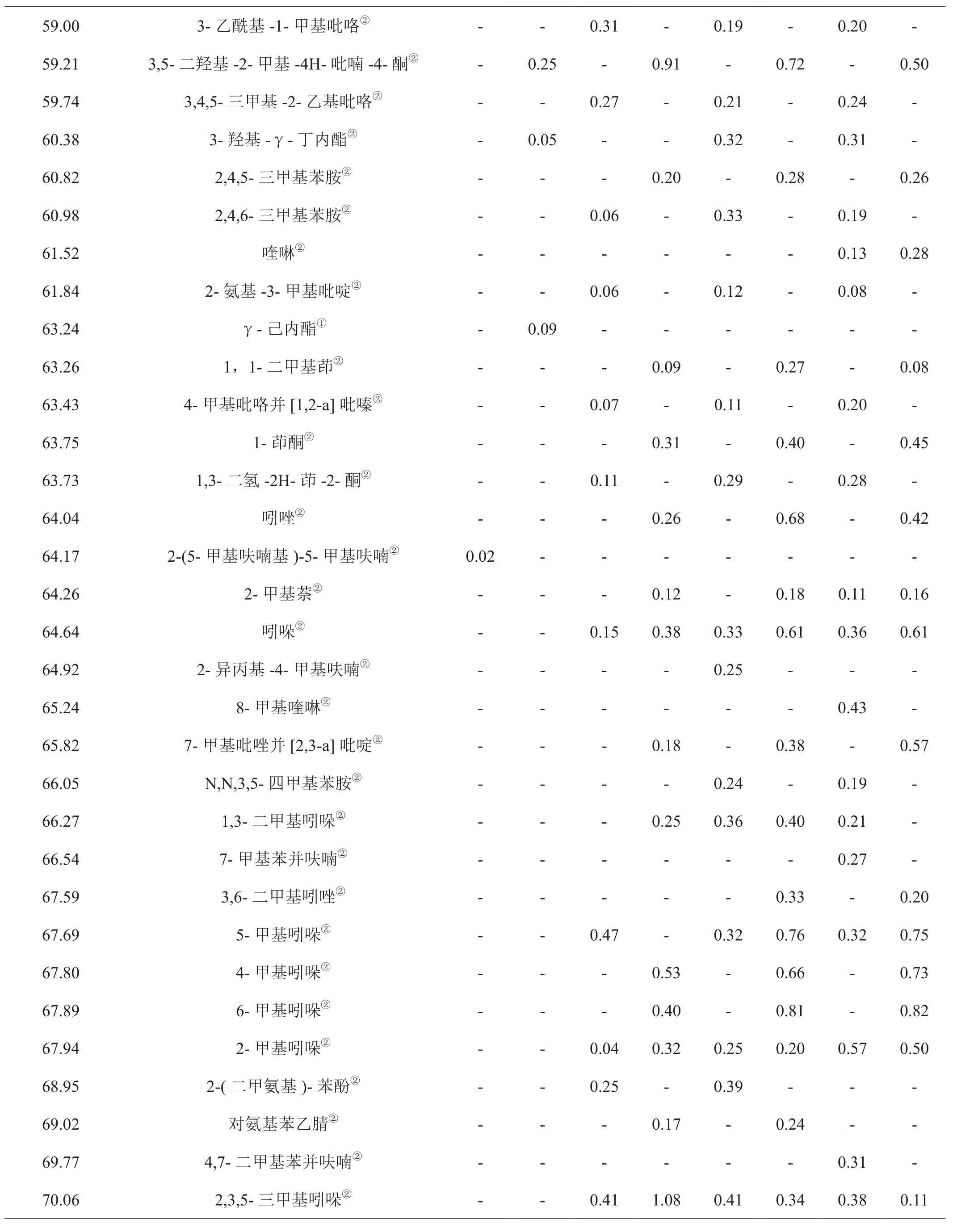
表1 (续)
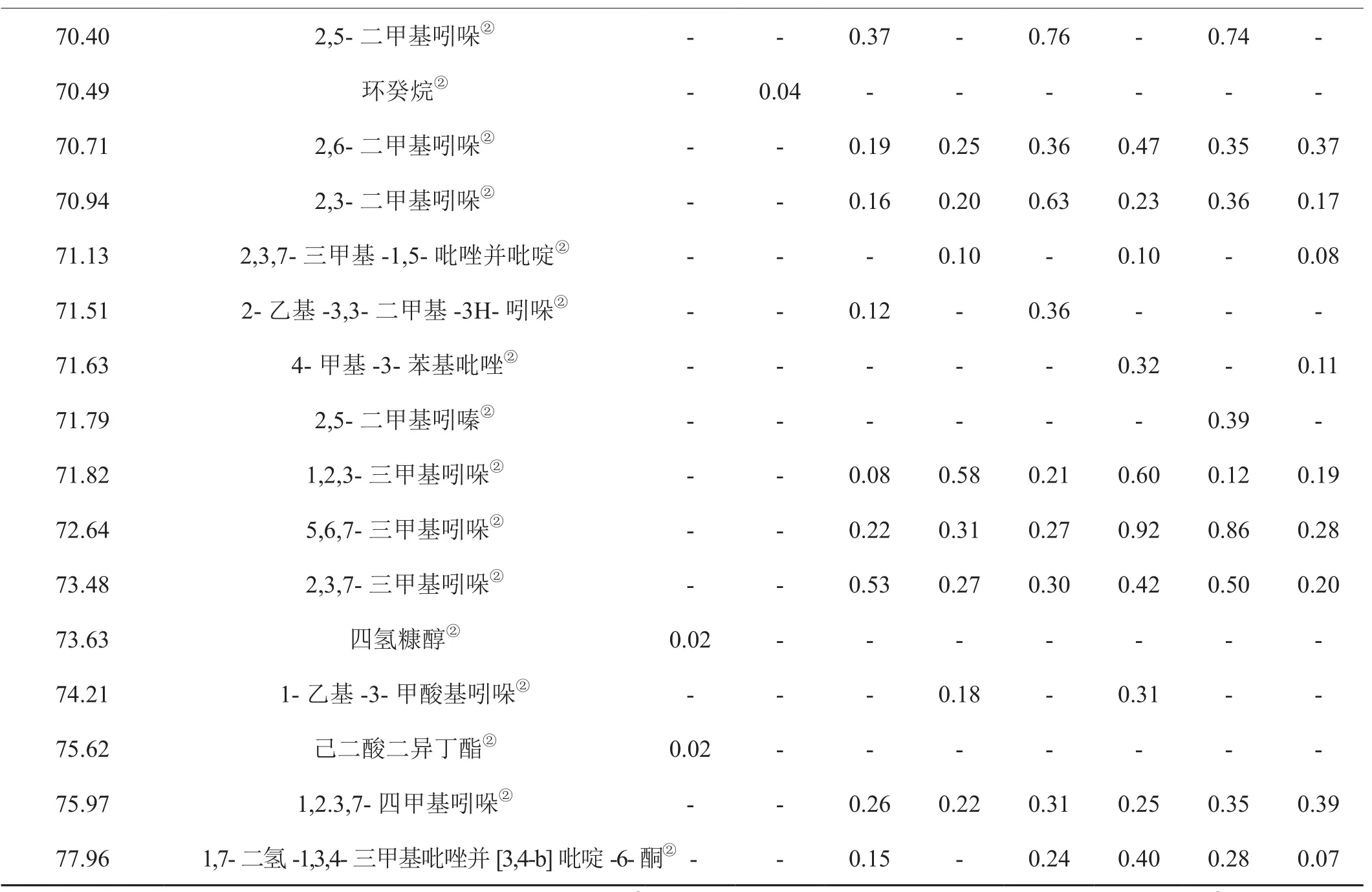
表1 (续)
由表1可以看出,无论有氧或无氧裂解,裂解温度对裂解产物数量有显著影响。在无氧条件下300℃检出21种物质,600℃检出102种,750℃检出120种,900℃检出119种。在有氧条件下300℃检出23种物质,600℃检出113种,750℃检出130种,900℃检出127种。300℃条件下的裂解产物数量远少于其它裂解温度点,可能与被裂解对象未充分裂解有关,从1-L-谷氨酸-1-脱氧-D-果糖的TG曲线(图1)可见该温度点失重约65%,而600℃及以上温度失重大于90%。
同时可以看出,无氧和有氧裂解产物种类主要有杂环化合物、酮类、羧酸类、烯烃类、芳烃类等。其中,以杂环化合物为主要种类。以750℃裂解产物为例,无氧条件下检测到含氧杂环化合物16种,占裂解产物数量的13.33%。含氮杂环54种,占裂解产物数量的45.00%;有氧条件下检测到含氧杂环14种,占总裂解产物的10.77%,含氮杂环53种,占裂解产物数量的40.77%。若把裂解温度划分为低温(300℃)、中温(600℃)和高温裂解(750℃及900℃),还可以看出,低温条件下不产生芳香族有害成分,低温产生的主要成分2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮随温度升高而降低,有害成分数量随温度升高而增加。
2.3 无氧和有氧条件下热裂解产物对比分析
通过对表1分析可以发现,无氧条件下四个温度点共检出裂解产物数量145种,有氧条件下四个温度点共检出裂解产物数量153种,有氧裂解产物检出数量较无氧条件下多;另一方面,无氧和有氧条件裂解产物的种类有明显差异,两个条件下检出的相同产物共96种,无氧条件下检出专有产物共49种,有氧条件下检出专有产物57种。以四个温度点都检出的成分为例,无氧条件下检出11种,有氧条件下检出15种,两者共同成分是乙酸、2-乙酰基呋喃、2,5-二甲基吡嗪、γ-丁内酯、5-甲基糠醛、乙酸丁酯、2-乙酰基吡咯、2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮,前者专有的是4-甲基-3-戊烯-2-酮、2,6-二甲基吡嗪和2,4-二羟基-2,5-二甲基-3(2H)-呋喃-3-酮,后者专有的是2,3-丁二酮、2,3-戊二酮、2-甲基吡嗪、4-羟基丁酸、5-甲基糠醇、2-乙基-5-甲基吡嗪和3,5-二羟基-2-甲基-4H-吡喃-4-酮。
根据不同裂解温度下有氧和无氧热裂解产物对比分析结果(见表2)。上述实验结果说明氧分子在裂解过程中可能参与裂解反应过程,造成裂解产物数量和种类不同,至于如何造成这种差异是一个值得深入研究的科学问题,这种不同可能造成最终裂解产物的总体香气的差异,因此,有氧热裂解的分析结果更能反映香气前体物质在卷烟中产生香气的结果。

表2 不同温度下无氧和有氧热裂解产物数目对比分析结果Tab.2 Comparative analysis of pyrolysis products in aerobic and oxygen-free conditions under different temperatures
2.4 裂解产物香气分析
依据TG-DTG分析结果,750℃裂解1-L-谷氨酸-1-脱氧-D-果糖较完全,并能较为真实反映卷烟燃吸温度状态,故以此温度下有氧热裂解为例分析裂解产物所具有的香气特征。根据相关文献报道[12-13]以及按照食品香气分类方法[14],可将裂解产物中的物质分为烘烤香、坚果香、甜香、奶香、花香等韵调。
烘烤香主要由烷基和酰基吡嗪、酰基吡咯、酰基吡啶和酰基呋喃类所构成,具体包括2,5-二甲基吡嗪(0.27%)、2,6-二甲基吡嗪(0.27%)、2-乙烯基吡嗪(0.03%)、2-乙基-5-甲基吡嗪(0.11%)、2-乙基-6-甲基吡嗪(0.11%)、2,3,5-三甲基吡嗪(0.50%)、2-甲基-3-乙基吡嗪(0.10%)、2,5-二甲基-3-乙基吡嗪(0.33%)、2-乙基-3,5-二甲基吡嗪(0.41%)、2-乙酰基-3-甲基吡嗪(0.08%)、3,5-二甲基-2-丙基-吡嗪(0.11%)、2-乙酰基-1-甲基吡咯(0.20%)、2-乙酰基吡咯(0.57%)、2-乙酰基吡啶(0.05%)和2-乙酰基呋喃(0.70%)。
坚果香主要由烷基吡咯类物质构成,具体包括1-甲基吡咯(0.17%)、2,4-二甲基吡咯(0.06%)、3-甲基吡咯(0.49%)、2-甲基吡咯(0.35%)、2,5-二甲基吡咯(0.09%)、2-乙基吡咯(0.36%)、3-乙基吡咯(0.11%)、2,3,5-三甲基吡咯(0.05%)、2-甲基-4-乙基吡咯(0.11%)、2-乙基-4-甲基吡咯(0.31%)、2,3,4-三甲基吡咯(0.20%)、N-甲基吡咯烷酮(0.23%)、2-吡咯烷酮(1.54%)和2,3,4,5-四甲基-1H-吡咯(0.09%)。
甜香由吡喃酮和部分呋喃类物质构成,主要有2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮(8.04%)、3,5-二羟基-2-甲基-4(H)-吡喃-4-酮(0.72%)、5-甲基糠醛(1.08%)、3-甲基呋喃(0.15%)、2-乙基呋喃(0.42%)、2,5-二甲基呋喃(0.99%)、2,4-二甲基呋喃(0.06%)、2-乙烯基呋喃(0.12%)、糠醛(0.04%)和5-甲基糠醇(0.24%)、γ-丁内酯(1.34%)、2(5H)-呋喃酮(0.21%)。4-环戊烯-1,3-二酮(0.36%)、2-环戊烯酮(0.29%)、2-甲基-2-环戊烯-1-酮(0.37%)、3,4-二甲基-2-环戊烯-1-酮(0.09%)、2,3-二甲基-2-环戊烯-1-酮(0.25%)。
在裂解产物体系中含有吲哚和甲基取代吲哚是一个显著特征,该类物质在浓度较低情况下表现出花香[15-16]。具体有吲哚(0.61%)、1,3-二甲基吲哚(0.40%)、5-甲基吲哚(0.76%)、4-甲基吲哚(0.66%)、2-甲基吲哚(0.20%)、2,3,5-三甲基吲哚(0.34%)、2,6-二甲基吲哚(0.47%)、2,3-二甲基吲哚(0.23%)、1,2,3-三甲基吲哚(0.60%)、5,6,7-三甲基吲哚(0.92%)、2,3,7-三甲基吲哚(0.42%)、1-乙基-3-甲酸基吲哚(0.31%)和1,2.3,7-四甲基吲哚(0.25%)。
吡啶类化合物和吡咯(0.48%)及2-甲基吡嗪(0.24%)在低浓度表现一般为壤香,其在体系中的存在对于增强白肋烟特征香有重要作用。主要有吡啶(0.29%)、2-甲基吡啶(0.38%)、4-甲基吡啶(0.13%)、3-甲基吡啶(0.16%)、2,6-二甲基吡啶(0.04%)、2-乙基吡啶(0.38%)、2,5-二甲基吡啶(0.20%)、3,4-二甲基吡啶(1.84%)、2-乙烯基吡啶(0.07%)、2,3-二甲基吡啶(0.08%)、3,5-二甲基吡啶(0.53%)、2,4,6-三甲基吡啶(0.11%)、2-正丙基吡啶(0.08%)、2,3,6-三甲基吡啶(0.18%)、2,3,5-三甲基吡啶(0.24%)、3-乙基-5-甲基吡啶(0.10%)、2-乙基-3,5-二甲基吡啶(0.14%)和2-乙基-4,6-二甲基吡啶(0.04%)。
奶油香类由连续二酮和内酯类物质构成,主要有2,3-丁二酮(0.49%)、2,3-戊二酮(0.22%)、3-甲基-1,2-环戊二酮(0.08%)。另外,以乙酸为主的酸类物质,在卷烟抽吸过程中可直接进入烟气,促进烟气酸碱平衡,减少刺激性,改善吸味。
2.5 裂解产物主要香气成分形成途径分析
从前述分析结果可以看出,1-L-谷氨酸-1-脱氧-D-果糖热解香气成分主要为呋喃类、吡喃类、吡咯类、吡啶类、吡嗪类、酮类、吲哚类等,其形成过程起始于氨基酸残基和葡萄糖残基[17]。关于呋喃类化合物如2-乙酰基呋喃的形成途径,可由葡萄糖残基通过2,3-烯醇化得到1-氨基-4-脱氧邻酮醛糖,进而通过Strecker降解变为1,4-二脱氧邻酮醛糖,再由1,4-二脱氧邻酮醛糖通过环化和脱水形成[18];吡喃(酮)类化合物如2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮是由糖残基通过2,3-烯醇化和邻位消去反应所得[3-4,19-20]。吡咯类化合物如3-甲基吡咯是由Stecker降解和氨基酸残基裂解产生的乙醛和α-氨基丙酮反应得到[10,21]。吡啶类化合物如吡啶有可能是糖残基中吡喃环在受热的条件下开环,与N原子结合形成新的共轭产物,从而进一步环化生成[19]。吡嗪类化合物如2-甲基吡嗪的形成途径可能是通过Strecker降解的α-二羰基化合物和氨基酸残基反应所生成的α-氨基羧基化合物与小分子醛类(如丙烯醛)反应得到[10,21]。酮类化合物如4-环戊烯-1,3-二酮的形成途径可能是由1-L-谷氨酸-1-脱氧-D-果糖经烯醇化后C-C键发生断裂生成五碳醛糖,五碳醛糖再经脱水环化得到[20,22-23]。吲哚类化合物如2-甲基吲哚的形成途径比较复杂,可能是由谷氨酸残基经过二次聚合形成[24-25]。
2.6 裂解产物有害成分分析
从表1分析结果可以得到不同温度下苯系物、稠环芳烃、芳胺及酚类有害成分的含量(见表3)。从表3可见,裂解温度不同,有害物质的释放量有较大不同。
裂解产生的苯系物包括甲苯,乙基苯,邻二甲苯,异丙基苯,1,3,5-三甲苯,对二甲苯和1-乙基-3-甲基苯,无论是无氧裂解还是有氧裂解,苯系物含量变化的总体趋势是随着裂解温度的升高而升高;稠环芳烃包括茚,1-甲基茚,3-甲基茚,2-甲基萘和1,1-二甲基茚,无氧裂解时随温度的升高产生的稠环芳烃的种类和释放含量都有所增加,有氧裂解在750℃时稠环芳烃释放量达到最大;芳胺类包括4-氨基甲苯,3,4-二甲基苯胺,2,4,6-三甲基苯胺,N,N,3,5-四甲基苯胺,苄胺,2,4-二甲基苯胺,3,5-二甲基苯胺和2,4,5-三甲基苯胺,无氧裂解和有氧裂解都是在750℃时芳胺释放量最大;在无氧裂解产生的酚类包括3-甲基苯酚和苯酚,而有氧下只检测到苯酚,苯酚相对含量随温度变化不明显。该分析结果可为烟草添加剂安全性评价提供一定的参考。

表3 1-L-谷氨酸-1-脱氧-D-果糖裂解产生有害成分的相对含量Tab.3 Harmful contents produced by pyrolysis of 3 1-L-glutamic-1-deoxy-D-fructose
3 结论
1-L-谷氨酸-1-脱氧-D-果糖为没有熔点的Amadori化合物,其稳定性受温度的影响较大,通过TG-DTG分析,判断得出其裂解温度为161.3℃;采用在线裂解气质联用技术,在300℃、600℃、750℃、900℃有氧和无氧条件下,对1-L-谷氨酸-1-脱氧-D-果糖的裂解产物进行分析鉴定和对比分析,结果表明无论有氧或无氧裂解,裂解产物数量随着裂解温度的升高而增大,仅在较高的温度下生成少量有害物质;有氧条件与无氧条件裂解产物数量相当,但种类有很大的不同;该Amadori化合物750℃裂解产物香气示例分析表明其裂解产物具有烘烤香、坚果香、甜香、花香、奶香等香韵。研究结果可为其在卷烟燃烧过程的转化行为提供例证,为卷烟加工技术和安全性评价提供理论依据和参考。
[1]Mills D F,Hodge J E.Amadori compounds: vacuum thermolysis of 1-deoxy-1-L-prolino-D-fructose [J].Carbohydrate Research,1976,51(1): 9-21.
[2]Britt P F,Buchanan A C,Clyde V,et al.Does glucose enhance the formation of nitrogen containing polycyclic aromatic compounds and polycyclic aromatic hydrocarbons in the pyrolysis of proline? [J].Fuel,2004,83(11): 1417-1432.
[3]Despointes H A,Yaylayan V A,Keyhani A.Pyrolysis/GC/MS analysis of 1-[(2’-Carboxy)pyrrolidinyl]- 1-deoxy-D-fructose (proline Amadori compound) [J].Journal of Agricultural and Food Chemistry,1994,42(11): 2519-2524.
[4]Yaylayan V A,Despointes H A.Identification of per-O-(trimethylsilyl) derivatives of aldoses generated from thermal decomposition of N-(1-deoxy-D-fructopyranos-1-yl) proline: reversibility of the Amadori rearrangement [J].Carbohydrate Research,1996,286: 179-187.
[5]张敦铁,殷发强,何佳文.三种Amadori化合物的热裂解研究[J].中国烟草学报,2006,12(2): 13-16.
[6]Keyhani Anahita,Yaylayan Varoujan A.Pyrolysis/GC/MS analysis of N-(1-deoxy-D-fructos-1-yl)-L-phenyl-alanine:Identification of novel pyridine and naphthalene derivatives[J].Journal of Agricultural and Food Chemistry,1996,44(1),223-229.
[7]欧亚非,鞠华波,贾春晓,等.1-L-苯丙氨酸-1-脱氧-D-果糖热裂解产物分析[J].烟草科技,2011,(4):41-46.
[8]Sara I F S.Martins,Antonius T M Marcelis,Martinus A J S,et al.Kinetic modeling of Amadori N-(1-deoxy-D-fructos-1-yl)-glycine degradation pathways.PartⅠReaction mechanism [J].Carbohydrate Research,2003,338(16):1651-1663.
[9]Coleman W M,Chung H L.Pyrolsis GC-MS analysis of Amadori compounds derived from selected amino acids and glucose [J].Journal of Analytical and Applied Pyrolysis,2002,62(2): 215-223.
[10]毛多斌,鞠华波,牟定荣,等.1-L-亮氨酸-1-脱氧-D-果糖和1-L-异亮氨酸-1-脱氧-D-果糖的热裂解分析[J].中国烟草学报,2010,16(6): 1-9.
[11]芦昶彤,白兴,贾春晓,等.1-L-丙氨酸-1-脱氧-D-果糖的热裂解分析[J].郑州轻工业学院学报,2011,26(4):35-40.
[12]张明森,黄凤兴,梁泽生,等.精细有机化工中间体全书[M].北京:化学工业出版社,2008: 336-731
[13]Afoakwa Emmanuel Ohene,Paterson Alistair,Fowler Mark,et al.Matrix effects on flavor volatiles release in dark chocolates varying in particle size distribution and fat content using GC-mass spectrometry and GC-olfactometry[J].Food Chemistry 2009,113(1): 208-215.
[14]Ashurst P R.Food Flavorings,3rd Edition [M].Gaithersburg,Maryland: Aspen Publishers,Inc.,1999: 113-116.
[15]毛多斌,马宇平,梅业安.卷烟配方和香精香料[M].北京:化学工业出版社,2001:107-120.
[16]毛多斌,张槐岭,贾春晓.卷烟香味化学[M].郑州:河南科学技术出版社,1994:51-199.
[17]Yu Wang,Juliani H Rodolfo,Simon James E,et al.Amino acid-dependent formation pathways of 2-actylfuran and 2,5-dimethyl-4-hydroxy-3[2H]-furanone in the maillard reaction[J].Food Chemistry. 2009,115(1): 233-237.
[18]Cerny Christoph,Davidek Tomas.Formation of aroma compounds from ribose and cysteine during the Maillard reaction [J].Journal of Agricultural and Food Chemistry,2003,51(9): 2714-2721.
[19]Yaylayan Varoujan,Sporns Peter.Novel mechanisms for the decomposition of 1-(Amino acid)-1-deoxy-D-fructoses(Amadori compounds): A mass spectrometric approach [J].Food Chemistry,1987,26(4): 283-305.
[20]Pain John B,Pithawalla Yezdi B,Naworal John D.Carbohydrate pyrolysis mechanisms from isotopic labeling:Part3.The pyrolysis fo D-glucose: Formation of C3 and C4 carbonyl compounds and a cyclopentendion isomer by eletrocyclic fragmentation mechanisms [J].Journal of Analytical and Applied Pyrolysis,2008,82(1): 42-69.
[21]Yaylayan Varoujan A,Keyhani Anahita.Elucidation of the mechanism of pyrrol formation during thermal degradation of13C-labeled L-serines[J].Food Chemistry 2001,74(1):1-9.
[22]Paine John B,Pithawalla Yezdi B,Naworal John D.Carbohydrate pyrolysis mechanisms from isotopic labeling:Part4.The pyrolysis of D-glucose: The formation of furans[J].Journal of Analytical and Applied Pyrolysis,2008,83(1): 37-63.
[23]Paine John B,Pithawalla Yezdi B,Naworal John D.Carbohydrate pyrolysis mechanisms from isotopic labeling:Part2.The pyrolysis of D-glucose: General disconnective analysis and the formation of C1and C2carbonyl compounds by electrocyclic fragmentation mechanisms [J].Journal of Analytical and Applied Pyrolysis,2008,82(1):10-41.
[24]Sharma Ramesh K,Chan W Geoffery,Hajaligol Mohammad R.Product compositions from pyrolysis of some aliphatic α-amino acids[J].Journal of Analytical and Applied Pyrolysis,2006,75(2): 69-81.
[25]Sharma Ramesh K,Chan W Geoffery,Hajaligol Mohammad R.Effect of reaction conditions on product distribution from the co-pyrolysis of α-amino acids with glucose [J].Journal of Analytical and Applied Pyrolysis,2009,86 (1): 122-134.
Pyrolysis analysis of 1-L-glutamic-1-deoxy-D-fructose
MAO Duobin1,LI Shan1,MOU Dingrong2,PENG Guogang2,BAI Xiaoli2,JIA Chunxiao1,YANG Jing1
1 School of Tobacco Science and Engineering,Zhengzhou University of Light Industy,Zhengzhou 450002,China;2 R﹠D Center,Hongta Tobacco(Group) CO.,Ltd.,Yuxi 653100,China
Thermal gravimetric analysis and pyrolysis temperature of 1-L-glutamic-1-deoxy-D-fructose were investigated by thermogravimetryderivative thermogravimetry analysis (TG-DTG).Pyrolysis analysis of 1-L-glutamic-1-deoxy-D-fructose was performed by an on-line pyrolysis gas chromatography-mass spectrometry (Py-GC-MS) at temperatures of 300℃,600℃,750℃ and 900℃ under atmosphere of pure nitrogen and mixing of nitrogen and oxygen (v/v 9:1) respectively.Results indicated that pyrolysis temperature of 1-L-glutamic-1-deoxy-D-fructose was 161.3℃ and weight loss at 700℃ reached 90.50%.When 1-L-glutamic-1-deoxy-D-fructose was treated under oxygen-free and oxygen-presence conditions,both varieties and amount of pyrolysis products increased when pyrolysis temperature rose from 300℃ to 900℃.The amount of products under aerobic condition was slightly more than that under oxygen-free condition.The variety of products between two conditions was significantly different.Ketones,pyrroles,pyridines,furans,pyrazines,indoles and a few aromatic compounds were found in the pyrolysis products under two conditions.Analysis on flavor notes of aerobic pyrolysis products indicated that pyrolysis products of 1-L-glutamic-1-deoxy-D-fructose featured baked,nutty,sweet,floral and creamy flavors.
1-L-glutamic-1-deoxy-D-fructose; pyrosis; TG-DTG; GC-MS
10.3969/j.issn.1004-5708.2014.02.003
TS411;TS264.3 文献标志码:A 文章编号:1004-5708(2014)02-0018-12
中国烟草总公司卷烟增香保润重大科技专项“糖衍生物类香味前体物质合成分析及其应用技术研究”(合 同 号:110201101025(BR-07))
毛多斌(1962—),博士,教授,主要研究方向为烟草化学与香精香料,Tel: 0371-86609623,Email: maoduobin@zzuli.edu.cn
2013-03-04
