油藏内源微生物生长代谢及驱油特性研究
2014-11-22夏小雪朱维耀李娟龙运前北京科技大学土木与环境工程学院北京100083
夏小雪,朱维耀,李娟,龙运前(北京科技大学土木与环境工程学院,北京 100083)
郭省学,宋智勇,汪卫东(中石化胜利油田分公司采油工艺研究院,山东 东营 257000)
微生物采油技术分为外源微生物采油技术(MEOR,microbial enhanced oil recovery)和内源微生物采油技术(ASMR,activation of stratal microflora recovery)两种[1,2]。其中内源微生物采油技术是通过添加营养激活剂活化油藏中原有的微生物群落,从而对地下原油进行降解、降黏,增强原油的流动性[3,4];与外源微生物采油技术相比,具有更能适应油藏环境、现场操作简单、成本低廉等优点,是目前较为活跃的研究方向[5~7]。因此,在大量开展外源微生物采油技术的同时,充分利用内源微生物采油技术的优势,发挥其潜力,对于进一步提高我国微生物采油技术水平十分必要[8~11]。
笔者针对胜利油田已经进入注水开发晚期的沾3区块,考察了压力以及孔隙介质对其中内源微生物生长代谢的影响,并采用微观仿真光刻蚀可视化模型,利用激活的内源混合微生物,进行微观驱油试验,对驱替过程中剩余油的形态和流动特征进行显微观察和分析,揭示微生物在油藏条件下的驱油特性,进而为微生物现场驱油提供参考和依据。
1 试验
1.1 试验材料
试验所用原油和水样均取自胜利油田沾3区块生产井井口和注水站。该油藏埋深为1240~1360m[12,13],温度为54~63℃,地层水矿化度8900mg/L,地层水pH值6.8,孔隙度30%左右,渗透率800~1000mD,平均地面原油黏度1422mPa·s,适合内源微生物的生长与繁殖[14,15]。
试验驱替水采用自来水,试验用油为脱水脱气原油添加适当比例煤油配制成的模拟油。选择激活剂的配方为:淀粉水解液5%(体积分数)+磷酸氢二铵0.05g/L+尿素1g/L+硝酸铵0.1g/L。
1.2 试验试剂与仪器
试验所用试剂:石油醚、乙醇、变色硅胶、葡萄糖、蛋白胨,均为分析纯,国药集团化学试剂有限公司。
试验主要仪器:YZ15蠕动泵,常州普瑞流体技术有限公司;UNICO2000分光光度仪,尤尼柯(上海)仪器有限公司;NDJ-1B旋转黏度计,上海昌吉地质仪器有限公司;THZ-C恒温振荡器,上海旦鼎国际贸易有限公司;生物显微镜,北京视界通仪器有限公司;佳能数码相机。
1.3 试验方法
1.3.1 内源微生物的培养
取200mL微生物液,加入一定量的激活剂,将其分别置于高压、高压+孔隙介质、常压、常压+孔隙介质环境中,在60℃的条件下恒温培养,并定期对不同培养条件下的微生物液取样,进行微生物染色镜检观察,查看其中活微生物的数量,分析不同培养条件对微生物生长的影响;同时应用表面张力测定仪测量微生物液的表面张力,考察各生长时期微生物液表面张力的变化情况。
1.3.2 微生物对原油的作用
将一定量的微生物液和原油混合,倒入500mL的三角瓶中,放入恒温振荡器,在60℃、110r/min的条件下培养15d。并间隔一定时间对样品取样进行显微观察,查看原油状态的变化;同时对原油黏度进行测量,分析混合微生物对原油的降解效果。
1.3.3 微观模型中剩余油形态变化
模拟油藏条件,以油田提取的内源微生物群落作为驱油剂,利用微观仿真光刻蚀可视模型,对水驱、微生物驱油过程中剩余油形态变化进行了跟踪观察。具体步骤如下:对微观模型抽真空饱和水→油驱水造束缚水→注入含有微生物和营养物质的地层水→在60℃、10MPa条件下培养发酵15d→后续水驱→试验结束。在整个试验过程中观察记录试验现象,并用同样的方法进行一组空白对照试验。
2 结果与讨论
2.1 微生物生长代谢
2.1.1 镜检微生物数
为保证驱油过程中一定数量微生物的存在,对上述不同培养条件下的微生物液取样,进行微生物染色镜检观察,查看其中活微生物的数量,结果如图1所示。由图1可知,油藏内源微生物被激活后,混合微生物的生长先后经历了前48h的适应期、第48~72h的对数增长期和第72~144h的稳定期过程;随着稳定期过后,部分分裂增殖的微生物逐渐死亡,但死亡率远比单微生物的死亡率低。与常压条件相比,高压条件下微生物的生长缓慢,说明高压培养过程中能适应油藏极端环境的微生物较少,且经过DNA测序发现初期大量增殖的微生物菌种不同,表现出群落结构中优势微生物菌种的不同,因此高压条件下微生物的衰减时间同样延缓。此外,孔隙介质的存在为微生物提供了良好的附着场所,所以孔隙介质条件下,微生物的生长周期延长。
2.1.2 微生物液表面张力的变化
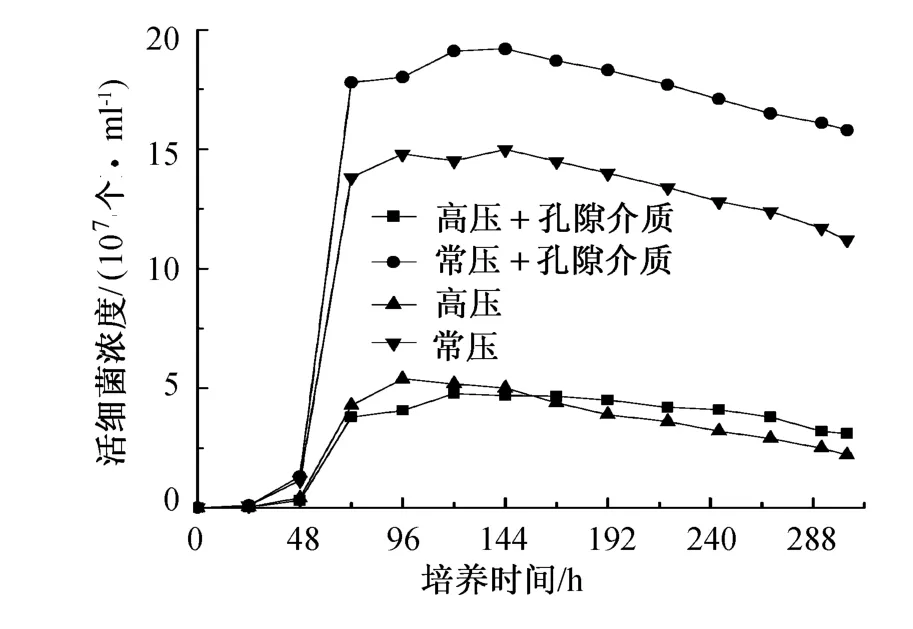
图1 不同培养条件下活微生物浓度图

图2 不同培养条件下微生物液表面张力变化
由于混合微生物主要产表面活性物质,而表面活性物质的多少可由微生物液表面张力的大小来表征,为此对4种培养条件下的微生物液进行表面张力测定,结果如图2所示。由图2可知,常压、无孔隙介质条件下培养的微生物液表面张力略高于常压、孔隙介质条件;高压、无孔隙介质条件下培养的微生物液的表面张力略高于高压+孔隙介质条件。常压+孔隙介质条件下,微生物液的表面张力下降的最快,稳定时表面张力最低,这说明微生物液表面张力的大小与微生物液的浓度有关。随着微生物液浓度的增加,微生物代谢产生的表面活性物质量增多,溶解在微生物液中,导致微生物液表面张力下降。由镜检试验可知,微生物在24~72h的生长处于对数增长期,代谢旺盛,4种条件下培养的微生物液表面张力值均迅速下降,96h后微生物生长缓慢,死亡率逐渐增加,生物表面活性物质的产生率下降,因而微生物液表面张力的降低幅度逐渐减小。
2.2 微生物对原油的作用情况
2.2.1 微生物作用使原油乳化
对培养的样品取样观察,发现原油有乳化现象产生,结果如图3所示。由图3可知,培养5d时,油水界面清晰,原油的乳化程度并不明显,没有形成中相微乳液,说明微生物产生表面活性剂乳化原油需要一定的时间;10d时,产生的生物表面活性剂浓度增加,油水界面处微生物对原油的乳化能力增强,表现出水相颜色变黄,部分原油进入水相,形成了近混相的乳状液;15d时,乳化现象明显,表现在进入水相的原油增多,形成了混相稳定的乳状液。乳状液的形成能够大幅度提高混相黏度,进而扩大水驱波及体积,提高采收率。

图3 原油乳化现象
2.2.2 微生物作用各阶段原油黏度变化
对培养的样品每隔5d取油样离心,分离油水混合物,并吸取上层原油进行黏度测定,测试温度为60℃,结果如图4所示。由图4可知,原油黏度随着剪切速率的增加基本不变,说明原油属于牛顿流体;而随着微生物作用时间的增加,微生物代谢产生的表面活性剂逐渐与原油作用形成乳状液,提高了混相黏度,样品原油初始黏度增加,且伴随剪切速率的增加,样品中原油的黏度逐渐降低,并表现出剪切变稀的性质,说明原油由牛顿流体逐渐变成非牛顿流体中的假塑性流体。剪切稳定时样品中原油黏度基本不变,随着培养时间的增加,原油的黏度依次降低,说明经过微生物作用后,降解了原油中的高黏度成分。
2.3 微生物驱油特性分析

图4 微生物作用不同时间原油的流变曲线
2.3.1 微生物作用前后模型中剩余油形态变化
对饱和油的模型进行一次水驱后,发现模型中存在着大量的膜状和盲端剩余油,且主要分布在大孔道内,而模型中小孔道内的剩余油主要以柱状和簇状为主,见图5(a)。微生物作用一段时间后,观察到模型中不同类型剩余油均发生了不同程度的变化。其中,微生物对原油的降解,使膜状剩余油表面凹凸不平,扩大了表面活性剂的接触面积,进而使膜状剩余油逐渐被剥离成自由的小油滴在孔道中间聚集,见图5(b)。微生物产表面活性剂吸附在孔隙介质表面,使柱状剩余油两端与壁面的接触角变大,并逐渐向小孔道内部作用,最终使亲油的小孔道表面润湿反转,变成亲水表面,进而易被驱替出孔隙介质,见图5(c)。在垂直于主流线的相对两角处,由于水波及不到,存在着大量的簇状剩余油;由于表面活性剂两性基团的作用,使得簇状剩余油所在的孔道壁面发生了润湿反转,从而增强了簇状剩余油的流动性,见图5(d)。
2.3.2 后续水驱时剩余油的动态变化过程
后续水驱时,各类剩余油均被启动,剩余油的动态变化过程如图6所示。由图6可知,经过微生物的作用,降低了油水界面张力,破坏了初始情况下油水界面稳定系统,使得油水界面膜被软化;后续水驱时,在驱替液的作用下油膜前缘逐渐变形、被拉长,并断裂成小油滴,脱离模型中剩余油块,最终被携带出孔隙介质。这一过程持续重复,直至模型中的可动剩余油被驱替干净。

图5 微生物作用前后模型中不同类型剩余油变化
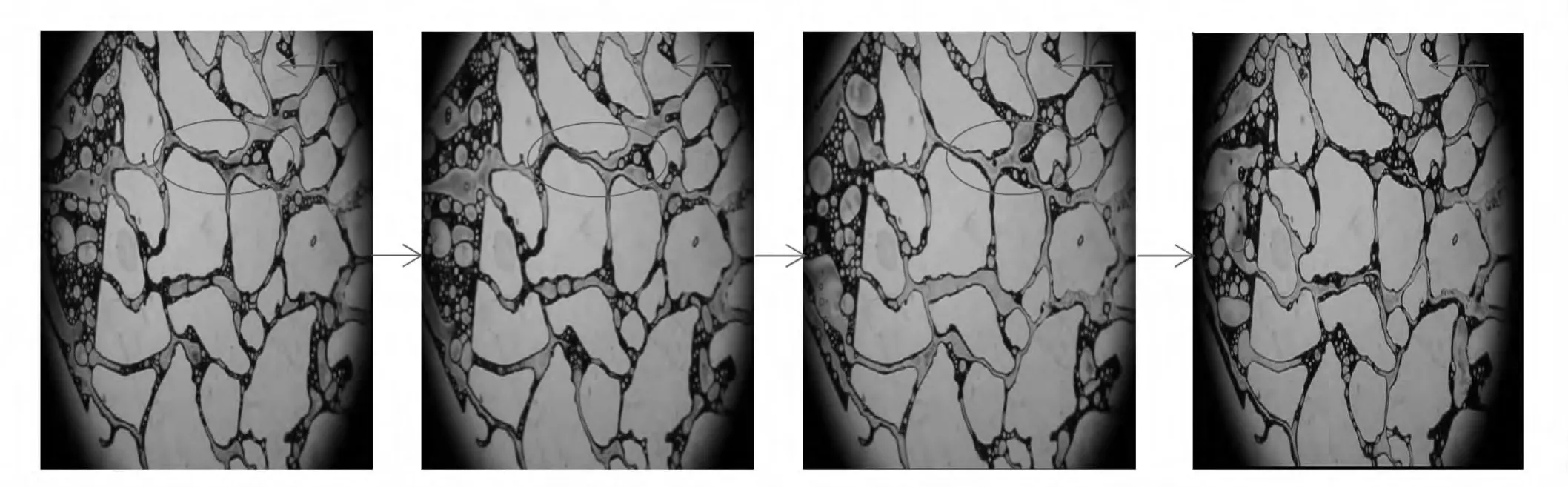
图6 模型中剩余油的动态变化过程
2.3.3 后续水驱时模型中波及体积扩大现象
后续水驱过程中,发现模型中出现波及体积扩大的现象,如图7所示。由于微生物液的黏度与水溶液黏度相似,水波及不到的区域微生物液也波及不到,因此后续水驱过程中波及体积扩大的现象主要是由微生物代谢产生的表面活性剂对原油乳化使驱替液黏度增加以及微生物向对角线剩余油迁移等特性共同造成的。

图7 后续水驱波及体积扩大现象
3 结论
1)油藏高压条件下,内源微生物的生长与衰减缓慢,能适应油藏极端环境的微生物较少,且孔隙介质的存在使微生物生长周期延长;同时测定发现微生物液表面张力的大小与微生物液浓度有关,微生物代谢产生表面活性物质量越多,微生物液的表面张力值下降的越快。
2)微生物与原油作用后,发现原油有乳化现象产生,且微生物作用时间越长,乳化现象越明显;通过对微生物作用不同时间原油黏度的测定,发现微生物可降解原油中高黏度成分,并使原油表现出剪切变稀的性质。
3)微生物驱油主要是通过降解原油和代谢产生生物表面活性物质乳化、剥离剩余油,从而增强了剩余油的流动性,与其他化学剂驱相比,具有调堵、降黏、改善驱油效果等多重作用,显著提高了采收率。
[1]Lee H O,Bae J H,Hejl K.Laboratory design and field implementation of microbial profile modification process [J] .SPE 49074,1998.
[2]Step A K,Bryant R S,Lave F M.提高多孔介质中波及系数的微生物方法 [J] .国外油田工程,1997,12(4):5~6.
[3]Wang Xiuyuan.Advances about researches of microbial enhanced oil recovery [J].Russia Microbiology,1995,22(6):383~384,357.
[4]张毅 .采油工程技术新进展 [M].北京:中国石化出版社,2005.175~176.
[5]郭省学,宋智勇,郭辽原,等 .微生物驱油物模试验及古菌群落结构分析 [J].石油天然气学报(江汉石油学院学报),2010,32(1):148~152.
[6]宋智勇,郭辽原,袁书文,等 .高温油藏内源微生物的调堵及种群分布 [J].石油学报,2010,31(6):975~979.
[7]蒋焱,徐登霆,陈健斌,等 .微生物单井处理技术及其现场应用效果分析 [J].石油勘探与开发,2005,32(2):104~106.
[8]Bordoloi N K,Konwar B K.Microbial surfactant-enhanced mineral oil recovery under laboratory conditions [J].Colloids and surfaces B:Biointerfaces,2008,63(1):73~82.
[9]Sun S S,Zhang Z Z,Luo Y J,et al.Exopolysaccharide production by agenetically engineered enterobacter cloacae strain for microbial enhanced oil recovery [J] .Bioresource Technology,2011,10(2):6153~6158.
[10]汪卫东,汪竹,耿雪莉,等 .美国微生物采油技术现场应用效果分析 [J].油气地质与采收率,2002,9(6):75~76.
[11]宋智勇,郭辽原,高光军,等 .内源微生物驱油物模实验及其群落演变研究 [J].石油钻采工艺,2010,32(1):89~93.
[12]曹功泽,徐登霆,张绍东,等 .胜利油田沾3断块内源微生物现场激活试验及分析 [J].石油天然气学报(江汉石油学院学报),2012,34(7):136~140.
[13]包木太,王兵,袁长忠,等 .胜利油田沾3区块内源微生物室内模拟激活实验研究 [J].化工学报,2008,59(9):2334~2338.
[14]包木太,刘涛,高光军,等 .不同激活剂条件下油藏内源微生物激活过程中DGGE分析 [J].湖南大学学报,2009,36(11):67~72.
[15]王登庆,郭辽原,刘涛,等 .压力对采油微生物生长代谢的影响 [J].中国石油大学学报(自然科学版),2009,33(3):114~117.
