SPE-LC-MS/MS测定4种食品接触材料中7种全氟有机物*
2014-11-20徐睿谭红杨鸿波孙海达何锦林
徐睿,谭红,杨鸿波,孙海达,何锦林
1(贵州大学,贵州贵阳,550001)2(贵州省分析测试研究院,贵州 贵阳,550001)
全氟有机化合物(PFCs)作为20世纪最重要的化工产品之一,被广泛应用于表面防污处理剂、泡沫火剂、农药、食品包装材料、不黏锅涂层和生活用品的加工生产过程中[1-2],起到防污、防油、防水、抗静电、降低表面张力等[3-4]作用。氟是极性最强的元素,所以PFCs同时具有极高的热稳定性和化学稳定性,能够耐受高温、光照、化学作用、微生物作用和高级脊椎动物的代谢作用而不分解。在生物体内,PFCs主要通过与蛋白质的结合而累积于血液、肝脏、肾脏、胆囊等组织器官中[2],从而对生物体造成一定的危害,主要表现为:肝脏毒性、心血管毒性、发育毒性、免疫系统毒性、内分泌干扰性及潜在的致癌性[5]。由于大量生产和广泛应用,该类化合物已经成为全球性污染物。目前,全球范围内几乎所有的环境介质中均可检测到 PFCs,如水体[6]、土壤[7]、大气[8]、和尘埃[9]等;在不同地区的生物组织[10]和血液[11]以及人体血液[12]中也发现了PFCs,甚至在偏远的极地地区[13]也检测到了PFCs的存在。鉴于PFCs给人体和环境带来的危害,美国、加拿大、欧盟等国家和地区相继颁布了相关法规禁止PFCs在某些领域的使用,同时限制该类物质的最大允许添加量[14]。
目前,关于食品接触材料中PFCs的检测报道较少,且多集中于不黏锅和爆米花桶,而食品接触材料是人体暴露于PFCs污染的重要来源,有研究指出,PFCs在高温条件下会从食品接触材料迁移到食物中,从而对食品造成污染,影响人类健康[15]。因此,建立市售食品接触材料中PFCs的定量检测方法对人体暴露于PFCs的健康风险评估具有重要意义。本文建立了4种市售食品接触材料中全氟己酸(PFHxA)、全氟庚酸(PFHpA)、全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟十二烷酸(PFDoA)、全氟十四烷酸(PFTA)、全氟辛烷磺酸盐(PFOS)7种PFCs残留的SPE-LC-MS/MS分析方法,对样品前处理方法、质谱条件进行了比较和优化。
1 实验部分
1.1 材料与仪器
全氟己酸(PFHxA)、全氟庚酸(PFHpA)、全氟辛酸(PFOA)、全氟十二烷酸(PFDoA)、全氟十四烷酸(PFTA)、全氟辛烷磺酸盐(PFOS)7种标准品,纯度>99%,德国Dr.Enrenstorfer GmbH公司;甲醇、乙腈(色谱纯),美国Honeywell公司;甲酸(色谱纯),德国Merck公司;乙酸铵(优级纯),天津科密欧;HLB固相萃取小柱(500mg/6mL)、C18固相萃取小柱(500 mg/3 mL),均购自天津博纳艾杰尔科技有限公司;爆米花桶(32A盎司)、烧烤油纸、汉堡纸袋、蛋挞锡纸,均购自当地超市。
Agilent 1200/6410液相色谱质谱联用仪(LCMS/MS),美国Agilent公司;N-EVAP-111样品浓缩仪,美国Organomation公司;GX-274全自动固相萃取仪,美国Gilson公司;SHA-BA双功能水浴恒温振荡器,广州永程公司;BG-OX数洗超声波清洗器,广州邦杰公司;HH-2C数显恒温水浴锅,金坛市鸿科仪器厂;RE-52A旋转蒸发仪,上海亚荣仪器厂。
1.2 实验方法
1.2.1 标准工作液的配制
准确称取PFCs标准品0.01 g(精确至0.1 mg),用甲醇配制成浓度为1.00 μg/mL的单标标准储备液,于4℃下保存。分别准确吸取适量PFCs单标标准储备液于容量瓶中,用甲醇配成10 ng/mL的混合标准溶液,临用前用甲醇稀释成所需浓度的标准工作液。
1.2.2 样品的提取与净化
称取4种样品各1.00 g(精确至0.01 g,样品剪成5 mm×5 mm小块)至150 mL三角瓶中,加入1%甲酸-甲醇溶液25 mL,试样充分湿润后超声提取60 min,将提取液过滤至50 mL棕色鸡心瓶中,将鸡心瓶置于60℃水浴减压旋转浓缩近干,加入2 mL水涡旋振荡溶解残渣,待净化。
将待净化液体过经活化的C18固相萃取小柱,保持流速小于1 mL/min,弃去流出液,加入6mL甲醇洗脱,收集洗脱液于氮吹管中,40℃水浴氮吹近干,加入1 mL甲醇,超声溶解,过0.22 μm的有机滤膜,待测。
1.3 液质联用仪分析条件
为减少实验过程带来的污染,将原色谱管路更换为Peek材料,全过程尽量避免使用聚四氟乙烯器皿。
1.3.1 色谱条件
色谱柱:Kromasil C8柱(100 mm ×4.6 mm,2.6 μm);流动相:0.1%甲酸-乙腈(A)和2 mmol/L乙酸铵水溶液(B);洗脱梯度见表1;流速0.3 mL/min;柱温:30 ℃;进样量:5 μL。
1.3.2 质谱条件
离子源:ESI;离子源温度:350℃;电离电压:-4 000 V;检测模式:多反应检测模式(MRM);辅助气、雾化气、碰撞气:氮气。根据各组分的保留时间和一级、二级质谱参数,按时间分段用多反应离子检测(MRM)模式对各组分进行质谱检测,各化合物的保留时间、母离子、子离子、碰撞电压、碰撞能量等参数见表2。
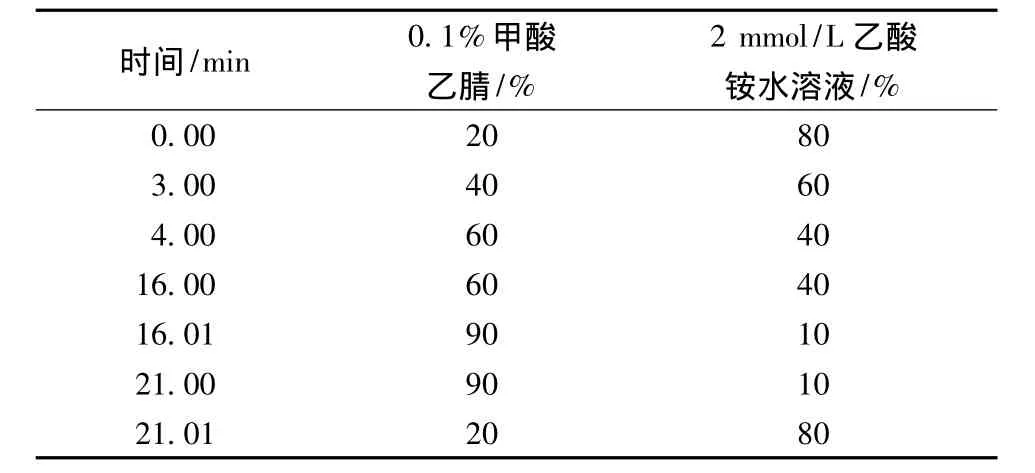
表1 流动相组成和梯度Table 1 The Composition and Gradient of Mobile Phase

表2 PFCs的质谱分析参数Table 2 The MRM Parameters of 7 PFCs
2 结果与讨论
2.1 提取方法的选择
以1%甲酸甲醇为提取溶剂,比较了超声提取、索氏提取和振荡提取3种提取方式的提取效果。结果表明,振荡提取周期长且提取含量低;索氏提取虽提取含量高,但操作繁琐耗时较长;超声提取周期短且提取含量高。故本文选取破坏力强、耗时短、提取含量高的超声提取方法作为本法的提取方式。

图1 不同超声时间对7种PFCs提取效果的比较Fig.1 Comparisons of results of 7 PFCs between diffierent extraction time
以1%甲酸甲醇为提取剂,比较了不同的超声时间对接触材料中7种PFCs的提取效果,7种PFCs的提取率在0~60 min内表现出明显的递增,60 min后趋于平衡甚至下降(图1),所以确定超声时间为60 min。
2.2 样品的净化
2.2.1 固相萃取柱的选择
本研究考察了HLB和C18两种固相萃取小柱对7种PFCs的回收情况。分别取浓度为1 ng/mL的混合标准溶液各1 mL加入到25 mL空白甲酸甲醇溶液中,旋蒸近干,加入2mL水,涡旋溶解后分别过经活化的HLB和C18小柱,加甲醇洗脱,将洗脱液40℃氮吹近干,加1 mL甲醇定容,上机测定。结果表明,C18固相萃取柱的萃取效果优于HLB固相萃取柱(图2)。所以本实验选取C18固相萃取小柱。

图2 两种不同的固相萃取柱对对7种PFCs提取效果的比较Fig.2 Comparisons of Recoveries of 7 PFCs on Three Different SPE Column
2.2.2 洗脱液体积的确定
取1 mL 1 ng/mL的标准混合液于氮吹管中,40℃氮吹近干,加入2 mL水后过C18固相萃取小柱,依次加入0.5、1、1.5、2、2.5 mL 甲醇洗脱,测定 PFCs的回收率,结果表明当洗脱液体积为大于2 mL时7种PFCs回收率基本不变(图3),所以本文选取2 mL甲醇作为洗脱液。
2.3 不同色谱柱的比较
在本实验室的条件下,比较了C18和C8色谱柱。由于PFCs具有-(CF2-CF2)n-直链,在C18色谱柱上保留很强,即使用100%乙腈也很难洗脱,且色谱峰保留时间长、不稳定、拖尾严重;改用C8色谱柱,色谱峰拖尾现象有所改善,流动相水相中加入2 mmol/L乙酸铵、乙腈中加入0.1%的甲酸后,分离度提高,峰形对称、尖锐。
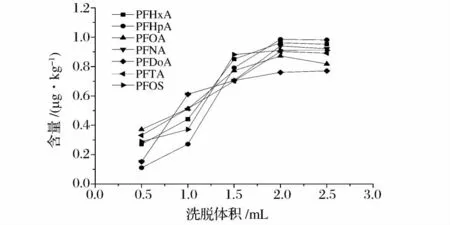
图3 不同洗脱体积时7种PFCs回收效果的比较Fig.3 Comparisons of Recoveries of 7 PFCs among different elution volumn
高浓度的盐会对质谱仪造成损坏,同时会影响PFCs去质子化效果,因此本实验对乙酸铵的浓度进行了比较和优化,讨论了乙酸铵浓度分别为2、5、10 mmol/L时各PFCs在C8色谱柱的色谱行为。实验表明,随着乙酸铵浓度的增加,各质谱峰稍展宽,响应值下降,因此,选择2 mmol/L乙酸铵为流动相,21 min内可完成食品接触材料中7种PFCs的检测,且回收率、灵敏度与重现性均良好。虽进样体积不大,但在进样针上仍有一定的残留,故在方法中设置洗针进样——在吸样前后分别洗针然后再进样,以消除残留影响且回收率与灵敏度均良好。
2.4 方法检出限与线性关系
以甲醇稀释 PFCS混合标准溶液至0.5、1、2、4、8、10 ng/mL,按本研究仪器条件进行检测,以浓度x(ng/mL)对峰面积y作PFCS标准曲线回归方程,线性方程、回归系数、方法检出限见表3。7种PFCS标准溶液的总离子色谱图见图4。

表3 7种PFCS的线性方程、回归系数、方法定量限Table 3 Lineral equation,Coefficients(r),Limits of detection(LOD),Recoveries and RSD for 7 PFCs
2.5 回收率与相对标准偏差
以烧烤油纸阴性样品进行3个加标水平的回收实验,每个加标水平取6个平行样,检测结果见表4。平均回收率为90%~116%,相对标准偏差为1.6%~5.0%。

图4 7种PFCs标准溶液的总离子流色谱图Fig.4 Total Ion Chromatograms of Seven PFCs standard solution
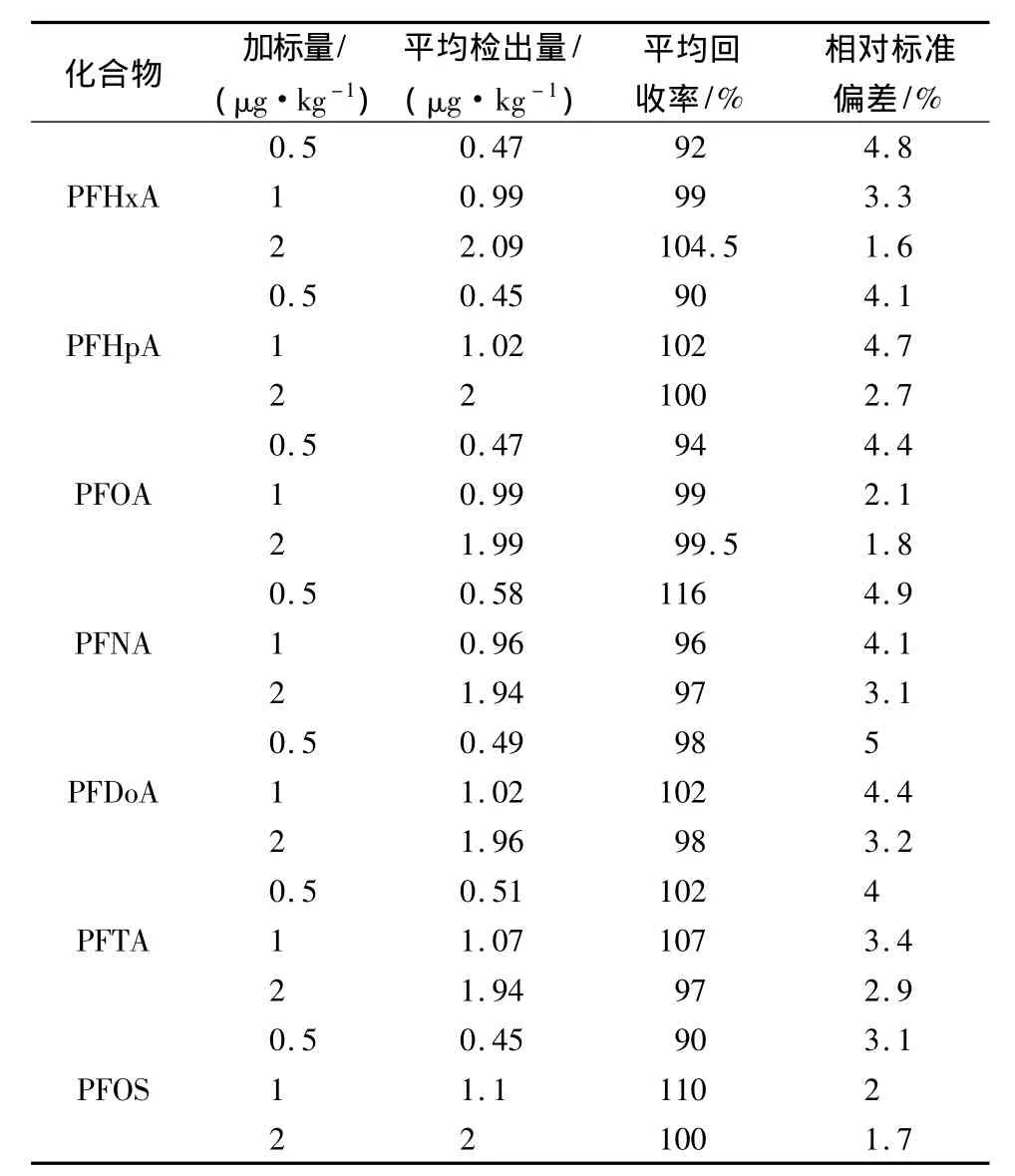
表4 样品中PFCs的回收率与相对标准偏差(n=6)Table 4 The recoveries and RSDs for 7 PFCs
2.6 实际样品检测
在优化条件下,对从市场上买来不同批次的爆米花桶、烧烤油纸、汉堡纸袋、蛋挞锡纸进行检测,结果表明:爆米花桶中共检出4种PFCs,分别为PFHxA、PFHpA、PFOA、PFNA,其平均含量分别为 15.811 4、0.469 0、0.222 5 和 0.036 3 μg/kg;烧烤油纸中共检出1种PFCs,为PFHxA,平均含量为1.334 4 μg/kg;汉堡纸袋中共检出2种PFCs,为PFHxA和PFHpA,其平均含量分别为0.163 9和0.459 9 μg/kg;3批次的蛋挞锡纸中PFCs的污染程度不均:批次1和批次2均检出1种 PFCs,为 PFHxA,其平均含量分别为1.461 0和0.177 0 μg/kg;批次3中共检出6种 PFCs,分别为 PFHxA、PFHpA、PFNA、PFDoA、PFTA 和PFOS,其平均含量分别为 1.68、3.15、0.68、0.74、0.64、0.07 μg/kg。此值虽不会对人体健康产生即时危害,但为PFCs暴露途径、暴露水平和健康风险提供了数据支撑,也证明我国市售食品接触材料中存在PFCs的污染问题,且污染并不均匀,应引起重视,而且有必要对市售各类食品接触材料中PFCs进行长期的检测和监控。
3 结论
本文建立了4种食品接触材料中7种PFCs的SPE-LC-MS/MS分析方法,该方法前处理简单,回收率高、精密度与重现性良好,方法检出限为0.03~0.52 μg/kg(S/N=3),适合于各类食品接触材料中PFCs的定量检测。
[1]Lehmler H J.Synthesis of environmentally relevant fluorinated surfactants-a review[J].Chemosphere,2005,58(11):1 471-1 496.
[2]郭斐斐,王雨昕,李敬光,等.超高效液相色谱-串联质谱法测定人体尿液中全氟有机化合物[J].色谱,2011,2(29):126-130.
[3]冯盘,施佳慧,朱加进.不粘锅涂层和爆米花袋残留全氟化合物的提取方法[J].食品与机械,2010,26(3):167-172.
[4]武晓果,谢周清.南北极全氟化合物的含量、分布及迁移[J].极地研究,2009,21(3):197-210.
[5]范英武,郎朗,季宇彬.全氟辛酸毒性的研究现状[J].食品与药品,2008,10(7):66 -69.
[6]ZHANG T,SUN H W,LIN Y,et al.Perfluorinated compounds in human blood,water,edible freshwater fish,and seafood in China:daily intake and regional differences in human exposures[J].Journal of agricultural and food chemistry,2011,59(20):11 168 -11 176.
[7]Washington J W,Ellington J J,Jenkins T M,et al.Analysis of perfluorinated carboxylic acids in soils:Detection and quantitation issues at low concentrations[J].Journal of Chromatography,2007,1152(1/2):111 -120.
[8]Dreyer A,Weinberg I,Temme C,et al.Polyfluorinated compounds in the atmosphere of the atlantic and southern oceans:evidence for a global distribution[J].Environmental Science&technology,2009,43(17):6 507 -6 514.
[9]ZHANG T,SUN H W,WU Q,et al.Perfluorochemicals in meat,eggs and indoor dust in china:assessment of sources and pathways of human exposure to perfluorochemicals[J],Environmental Science&technology,2010,44(9):3 572 -3 579.
[10]Loi E I H,Yeung L W Y,Taniyasu S,et al.Trophic magnification of poly-and perfluorinated compounds in a subtropical food web[J].Environmental science & technology,2011,45(13):5 506 -5 513.
[11]DAI J T,LI M,JIN Y H,et al.Perfluorooctanesulfonate and perfluorooctanoate in red panda and giant panda from China [J].Environmental Science&technology,2006,40(18):5 647-5 652.
[12]Kannan K,Corsolini S,Falandysz J,et al.Perfluorooctanesulfonate and related fluorochemi-icals in human blood from several countries[J].Environmental Science &Technology,2004,38(17):4 489 -4 495.
[13]Butt C M,Rerger U,Bossi R et al.Levels and trends of poly-and perfluorinated compounds in the arctic environment?[J].Environmental Science & Technology,2010,408(15):2 936-2 965.
[14]张晓丽,刘崇华,冼燕萍,等.液相色谱-串联质谱法测定纺织品中7种全氟有机物[J].分析测试学报,2010,12(29):1 182 -1 185.
[15]冯盘.食品接触材料中全氟辛酸和全氟辛烷磺酰基化合物的检测和溶出迁移规律研究[D].杭州:浙江大学,2011:34.
