绿叶菜农药残留去除的清洗方法*
2014-11-20卫晓怡楼文高王胜桥白晨张艳艳陆文蔚刘天琪马秉杰
卫晓怡,楼文高,王胜桥,白晨,张艳艳,陆文蔚,刘天琪,马秉杰
1(上海商学院旅游与食品学院,上海,200235)2(上海商学院流通领域食品管理中心,上海,2014001)3(上海商学院 计算机学院,上海,200235)4(上海商学院管理学院,上海,200235)
我国是农药使用大国,每年用量约25万t,其中杀虫剂、杀菌剂、除草剂分别约占总产量的70%、13%、15%,尚有少量的植物生长调节剂和杀鼠剂等,农药的使用可每年减少粮食损失200~300亿kg,挽回直接经济损失600亿元[1]。但是,施用农药在促进作物生长、保障人类食物来源等方面做出巨大贡献的同时,也对生态环境及人类健康产生负面影响。随着我国农业的发展,栽培技术的不断进步,蔬菜的生长期已越来越短,伴随着害虫抗药性的普遍提高,农药用量与施药频次不断增加,加上施药后采摘间隔短,市售蔬菜农药残留问题严峻[2-3],对消费者健康的危害时有发生。
目前,我国在蔬菜生产中主要使用农药有:有机磷类、有机氯类、氨基甲酸酯类、拟除虫菊酯类等[4]。从农业部的统计分析获悉,目前我国农产品的农药残留检测合格率总体达95%以上,但其残留状况不稳定,存在风险隐患,如夏季病虫害发生严重及反季节栽培均会导致农药使用量加大,易造成农产品农药残留超标[5]。
我国居民日常膳食中喜食蔬菜种类繁多,特别是营养丰富的绿叶菜。据2014年上海市农业委员会统计报告显示,上海蔬菜年消费量达560万t以上,春季地产蔬菜日均上市量在9 200t以上,其中绿叶菜上市量不低于4 300t[6]。绿叶菜是一类主要以鲜嫩的绿叶、叶柄和嫩茎为产品的速生蔬菜,生长期短,采收灵活,栽培十分广泛,品种繁多,我国栽培的绿叶菜有10多个科30多个种,常见绿叶菜有菠菜(藜科),芹菜、芫荽(伞形科),生菜、莴苣、茼蒿(菊科),苋菜(苋科)等。然而研究显示,绿叶菜由于其叶片柔软且水分多,害虫喜食而喷洒农药较多,是引起农药残留危害风险的高危品种,是各地农产品安全监察部门的重点监控对象。
我国各地区农产品安全监测显示,农药残留在市售绿叶菜中最严重,检出率和超标率都比较高,解决绿叶菜农药残留超标,是目前蔬菜在流通环节中亟待解决的问题。超市及集贸市场在绿叶菜上市前采用经济快捷的清洗方法有效去除绿叶菜农药残留[7],是保障居民农产品食用安全的最后一道防线。清洗去除农药残留,会受农药以及清洗剂理化性质的影响[8-10],如农药的辛醇/水分配系数(Kow 值)、溶解度、蒸汽压,清洗剂的温度、pH值、乳化性等。已有研究表明[11-12],蔬菜采摘后采用臭氧、洗涤剂、盐水、碱性溶液、酸性溶液、高温或热水处理等物理及化学方法,可有效消除农药残留。选择经济有效的清洗方式去除蔬菜的农药残留,减少农药残留对健康的危害,保障居民食用安全性,已成为当前超市及集贸市场销售农产品的关注重点。
本研究选择生食为主的生菜以及农药残留较严重的菠菜2种常见绿叶菜为代表,以复合毒死蜱(Chlorpyrifos)及克百威(Carbofuran)模拟绿叶菜农药污染。已有研究报道显示,毒死蜱[13]和克百威[14-15]是常见的2种绿叶菜生产使用农药。毒死蜱属于二烷基磷酸酯类农药,克百威属于甲基氨基甲酸酯类农药,这2种农药在酸性条件下稳定,碱性条件下(pH 7.5~9.0)易水解,随温度升高易降解。根据其农药特性,推测碱性溶液是绿叶菜去除这2种农药较好的清洗剂。
已有研究表明,清洗剂对农产品农残的去除受清洗温度、时间、清洗剂浓度、pH值、水流速度等因素影响[16-18]。
由此,本研究以毒死蜱及克百威复合农药污染后的生菜、菠菜为研究对象,模拟其在流通环节中清水、NaHCO3碱性溶液的清洗方法,检测在不同清洗时间、温度、溶剂浓度等条件下农药残留去除情况,通过响应面方法确定其最佳的清洗方式。
1 材料与方法
1.1 样品与试剂
1.1.1 样品
新鲜绿叶菜2种:生菜(Lactuca sativa,菊科,产自上海,大棚技术种植)、菠菜(Spinacia oleracea L.,藜科,产自山东,冷藏保鲜技术经长途运输至上海),2013年10月采样于上海市徐汇区农贸市场。
1.1.2 试剂
农药残留快速检测试剂盒包括:反应酶(乙酰胆碱酯酶,acetylcholinesterase)、底物(碘化硫丁酰胆碱,s-butyrylthiocholine iodide)、显色剂(二硫代二硝基苯甲酸,DTNB)、缓冲液(无水磷酸氢二钾、磷酸二氢钾),购自东莞市绿健生物科技有限公司;毒死蜱乳剂(Chlorpyrifos,有效成分40%,有机磷农药),克百威颗粒(Carbofuran,有效成分90%,氨基甲酸酯类农药),购自美国陶氏益农公司;NaHCO3,购自国药集团化学试剂有限公司。
1.2 仪器与设备
HAD-NCD-100A型多功能农产品安全分析仪(北京恒奥德仪器仪表有限公司),DS-1高速组织捣碎机(上海精密科学仪器有限公司),快速移液器(美国Thermo Fisher),比色皿,玻璃棒,砧板,剪刀,洗瓶,漏斗,滤纸(上海高信化玻仪器有限公司),SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂),蔬菜脱水器(余姚市居优乐电器有限公司)。
1.3 实验方法
1.3.1 蔬菜模拟农药残留的样品处理
稀释2种农药,稀释倍数分别为:40%毒死蜱乳剂配制为30 mL/15L;90%克百威颗粒配制为10 g/15 L。为模拟农药污染蔬菜,将从市场上购买的新鲜绿叶菜(生菜、菠菜)清水洗净2 min,用蔬菜脱水器甩去表面水份,将清洗过的绿叶菜分别浸泡于2种农药稀释液10 min,清水冲洗0.5 min,将冲洗后的绿叶菜用蔬菜脱水器甩掉表面水分,取出室温放置12 h自然晾干,待用。
1.3.2 样品农药残留检测前处理
采用GB/T 5009.199-2003《蔬菜中有机磷和氨基甲酸醋类农药残留量的快速检测》的标准处理方法。蔬菜样品以及蔬菜混合样品(生菜、菠菜质量比1∶1混合),剪成1 cm左右见方碎片,取样品1 g,放入烧杯或提取瓶中,加人5 mL缓冲溶液,振荡1~2 min,倒出提取液,静置3~5 min,待用。
1.3.3 农药残留检测
按试剂盒操作说明,采用酶抑制率法检测:蔬菜中有机磷和氨基甲酸酯类农药对胆碱酯酶的正常功能起抑制作用,抑制程度的大小与农药的残留浓度成线性相关,即其抑制率与农药质量分数呈正相关。酶催化神经传导代谢产物(乙酰胆碱)水解,其水解产物与显色剂反应,产生黄色物质,用农产品安全分析仪在410 nm处测定吸光度随时间的变化值,计算出抑制率(R)。因此,通过测试蔬菜样品与胆碱酯酶作用前后催化反应的速率变化,即可测试胆碱酯酶活性变化,从而测定样品中农药毒死婢和克百威的残留情况(以酶的抑制率表示)(D)。

式中:R为酶的抑制率;AC为对照样测试吸光度值;AS为样品测试吸光度值。
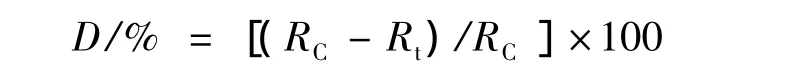
式中:D为残留农药去除率;RC为样品清洗前酶抑制率;Rt为样品清洗后酶抑制率。
农产品安全分析仪工作条件:波长410 nm;半波宽8 nm±1 nm;读数范围0.000~3.500 Abs;测量范围0.000~4.500 Abs;分辨率0.000 1 Abs;线性系数r≥0.995;重复性 ±1.0%;精确度 ±0.5%;温度24℃;湿度75%。
1.3.4 清洗方法
1.3.4.1 清洗方法的单因素试验
根据已有研究,初步确定试验各因素的用量范围[16-18],分析其清洗时间、温度、溶液浓度等单因素变化对绿叶菜农药残留去除的影响。分别配制各溶液6L于10 L的塑料箱中,取农药浸泡过的绿叶菜样品适量于塑料箱中,使其完全浸没于处理液中,加盖,置于空气浴振荡器中处理以模拟水流环境,转速为100 r/min。清洗后均再用清水冲洗0.5min。将冲洗后的绿叶菜用蔬菜脱水器甩掉表面水分,自然条件下晾干待测。对照样为农药污染后不经过清洗的样品。
(1)将污染的生菜、菠菜样品分别在清水中清洗,清洗温度为 20,25,30,35,40,45 ℃,清洗时间为0,5,10,15,20,25,30,40,50,60 min。
(2)在20℃条件下,将污染的生菜、菠菜样品分别在 NaHCO3碱溶液、市售洗洁精溶液中清洗。NaHCO3碱溶液清洗浓度为:质量分数0.6%,0.8%,1.0%,1.2%,1.4%,1.6%,1.8%,2.0%,2.2%,2.4%(pH 8.3~ 8.8),清洗时间为 0、5、10、15、20、25、30、40、50、60 min。
1.3.4.2 清洗方法的响应面试验
综合单因素试验结果,根据Box-Behnken试验设计,确定响应面因素水平(见表1),将农药污染的生菜、菠菜样品以质量比1∶1混合为绿叶菜样品,进行响应面试验优化清洗方式。
1.4 数据处理
采用Excel 2007和Design-Expert 7.1.6软件进行数据处理,对响应面试验得到的数据进行线性回归和方差分析,模型及因素的显著性均通过F值考察(P<0.05),结果以农残去除率(Y)表示。
2 实验结果
2.1 单因素试验对绿叶菜农药残留的影响
由图1-a可知,以20℃清水清洗,20~40 min的清洗时间对绿叶菜农残清除效果较好,清洗时间40~60 min后清除率反而有所降低。此外,20 min清洗时间下,30~50℃内有较好的农残去除效果,见图1-b。无论何种清洗条件,清水对菠菜的农残去除效果比生菜差,这可能与绿叶菜的种类有关。综合以上实验结果,同时考虑长时间清洗对绿叶菜品质的影响以及节约经济,以30~50℃下清洗绿叶菜20~40 min作为后续实验水平。
从图2可见,以质量分数1.2%~2.0%NaHCO3碱性溶液,在20℃清洗20 min条件下,对绿叶菜农残去除有较好的效果,过低或过高的浓度均会导致去除农残效果降低,其中,菠菜农残较生菜难去除。与清水清洗相比,NaHCO3碱性溶液、洗洁精溶液的农残去除效果较好。综合分析,确定NaHCO3碱性溶液在1.2%~2.0%浓度范围作为后续实验水平。
2.2 清洗方法的响应面优化试验
2.2.1 响应面法因素与水平的选择

图1 清水清洗对绿叶菜(生菜、菠菜)农药残留(毒死婢/克百威)的去除Fig.1 Removal of chlorpyrifos and carbofuran residues in Lactuca sativa and Spinacia oleracea with water

图2 不同浓度NaHCO3碱性溶液清洗对绿叶菜(生菜、菠菜)农药残留(毒死婢/克百威)的去除Fig.2 Effects of different mass fraction NaHCO3solution on the elimination of pesticides(chlorpyrifos and carbofuran)residue of Lactuca sativa and Spinacia oleracea
根据单因素试验结果,采用3因素3水平响应面法,因素编码及水平见表1。

表1 响应面试验因素水平表Table 1 Factors and their levels of response surface design
2.2.2 响应面试验设计及结果
通过Design Expert软件对响应面试验结果(表2)进行多元回归拟合,得到二次多项回归方程:
(1)清水农残去除率(Y1)对时间(A,min)、温度(B,℃)及水流速度(转速C,r/min)的回归方程为:Y1= -116.119 75+4.393 78A +4.252 08B +0.205 21C-1.6×10-3AB-3.15×10-4AC-3.85×10-4BC-0.064 390A2-0.0498 40B2-1.320 60×10-3C2。
(2)NaHCO3碱性溶液农残去除率(Y2)对时间(A,min)、温度(B,℃)及浓度(质量分数C,%)的回归方程为:Y2= -375.694 00+8.589 47A+6.086 05B+22.590 44C-0.0453 00AB-0.094 312AC-0.049 625BC-0.088 672A2-0.046 947B2-0.508 89C2。
2.2.3 回归模型方差及主因素分析
表3为模型回归方差分析结果。根据模型的回归方程,固定一个因素在编码值0的水平,分析另外2个因素对绿叶菜农残去除率的影响,软件生成3个三维响应面图(图3,图4),可直观地反应各因素的交互作用对响应值的影响,从而确定最佳清洗条件范围。如果一个响应曲面坡度相对平缓,表明响应值可以忍受处理条件的变异,而不影响到响应值的大小,但如果一个响应曲面坡度非常陡峭,表明响应值对于处理条件的改变非常敏感。
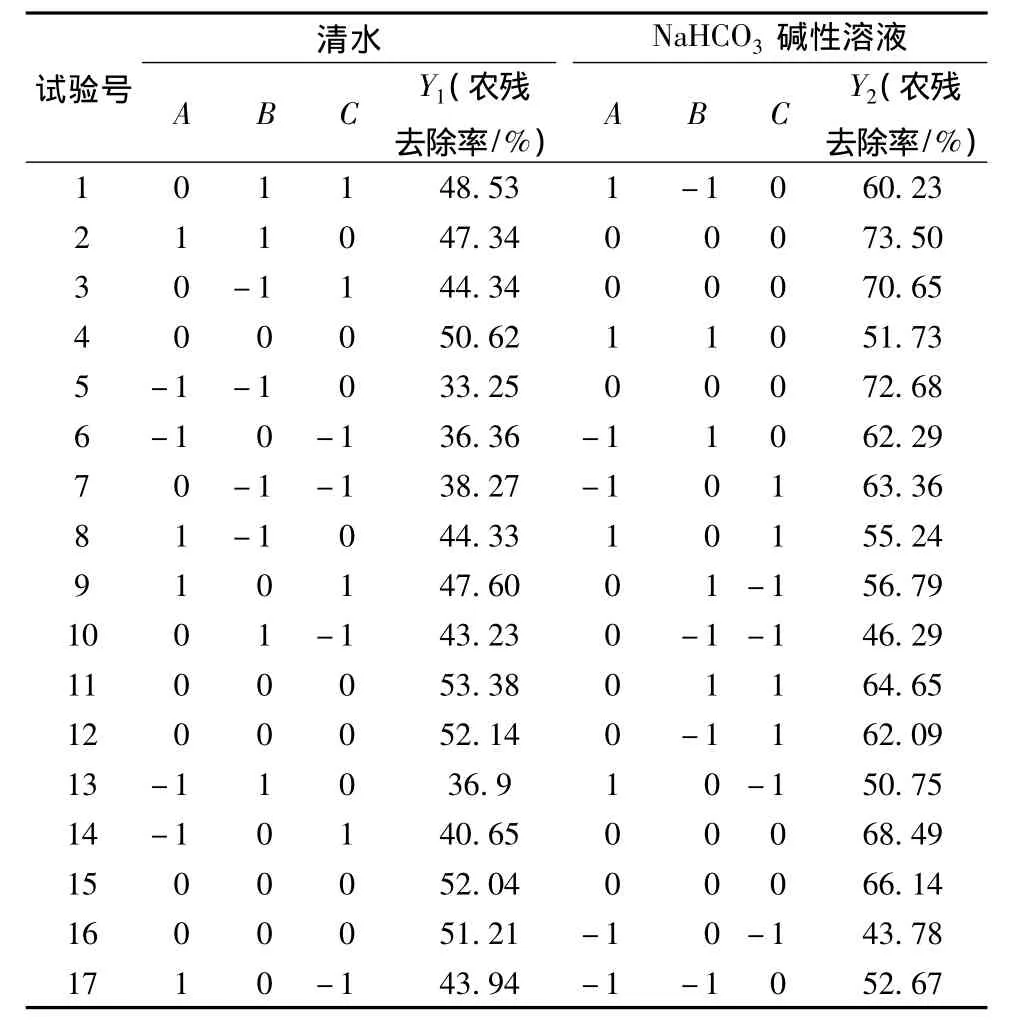
表2 响应面试验设计及结果Table 2 Response surface design arrangement and corresponding experimental data
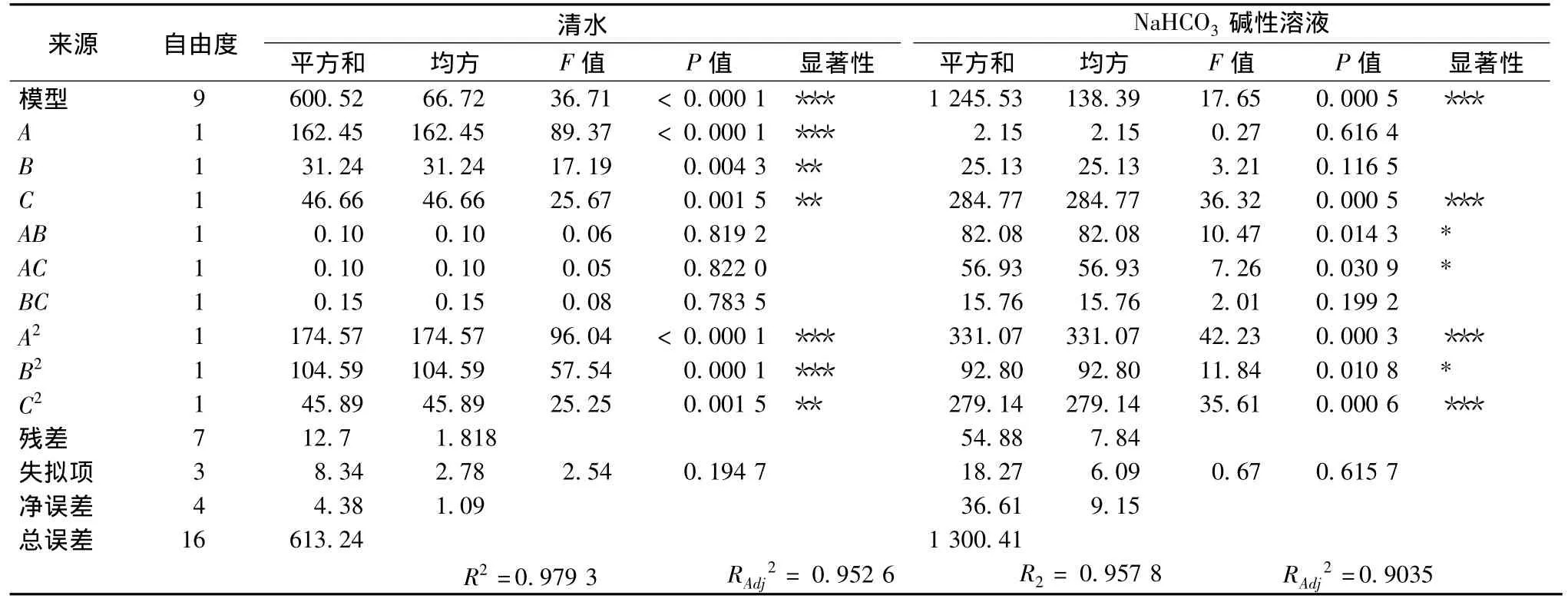
表3 回归模型方差分析结果Table 3 Analysis of variance for the proposed regression model
2.2.3.1 清水对绿叶菜农残去除率(Y1)模型
该模拟回归极显著(P<0.000 1),失拟项不显著(P>0.05),R2=0.979 3,说明该模型与实际试验拟合较好,可用于清洗时间A、清洗温度B及水流速度C对农残去除率的理论预测。从F值分析表明,A、B、C项均对绿叶菜农残去除率影响显著(P<0.05)。在所选择的试验范围内,依据一次项回归系数绝对值的大小可知因素的主效应关系为A>B>C。根据拟合模型绘制清水对绿叶菜农残去除率三维响应面图(见图3)。

图3 清水清洗时间、温度和水流速度各因素交互作用对绿叶菜农残去除率的影响Fig.3 Response surface and contour plots showing the effects of three process parameters on the elimination of pesticides(chlorpyrifos and carbofuran)residue of Lactuca sativa and Spinacia oleracea with water
由图3可知,清水清洗时间在30~40 min,温度在40~45℃,水流速度(转速)在40~80 r/min之间时,绿叶菜农残去除率可以到达最大值。其余条件下绿叶菜农残去除率较低,呈逐步递减的趋势。
通过求解回归方程,清水清洗去除绿叶菜农残的最佳条件为:清洗时间33 min,温度42℃,水流速度(转速)68 r/min。在此条件下,绿叶菜农残去除率的预测值为53.26%,验证实验所得值为52.78%,实际值与预测值之间的相对误差为0.91%。预测条件与实际较相符,采用响应面法优化得到的清洗条件参数准确可靠,按照建立的该模型进行预测在实践中是可行的。
2.2.3.2 NaHCO3碱性溶液对绿叶菜农残去除率(Y2)模型
该模拟回归极显著(P<0.000 5),失拟项不显著(P>0.05),R2=0.957 8,说明该模型与实际试验拟合较好,可用于清洗时间A、温度B及NaHCO3碱性溶液质量分数(浓度)C对农残去除率的理论预测。从F值分析表明,C以及交互项AB、AC对Y2影响显著(P<0.05),A、B不影响 Y2(P>0.05)。在所选择的试验范围内,依据一次项回归系数绝对值的大小可知因素的主效应关系为C>A>B。根据拟合模型绘制NaHCO3碱性溶液对绿叶菜农残去除率三维响应面图,见图4。

图4 NaHCO3碱性溶液清洗时间、温度和浓度各因素交互作用对绿叶菜农残去除率的影响Fig.4 Response surface and contour plots showing the effects of three process parameters on the elimination of pesticides(chlorpyrifos and carbofuran)residue of Lactuca sativa and Spinacia oleracea with NaHCO3solution
由图4可知,NaHCO3碱性溶液清洗时间在25~35 min,温度在35~45 ℃,质量分数1.6%~2.0%之间时,绿叶菜农残去除率可以到达最大值。其余条件下绿叶菜农残去除率较低,呈逐步递减的趋势。
通过求解回归方程,得到NaHCO3碱性溶液清洗去除绿叶菜农残的最佳条件为:清洗时间28 min,温度42℃,质量分数1.8%。在此条件下,绿叶菜农残去除率的预测值为71.63%,验证实验所得值为73.88%,实际值与预测值之间的相对误差为3.05%。预测条件与实际较相符,采用响应面法优化得到的清洗条件参数准确可靠,按照建立的该模型进行预测在实践中是可行的。
3 讨论
本研究结果表明,采用单因素试验及响应面试验对清水及NaHCO3碱性溶液去除绿叶菜(生菜、菠菜)农残(毒死婢、克百威)的清洗条件进行优化,通过回归分析建立了良好相关性方程,得到其最佳清洗条件分别为:清水清洗时间33 min,温度42℃,水流速度68 r/min(转速),农残去除率为52.78%;NaHCO3碱性溶液清洗时间28 min,温度 42℃,浓度18‰,农残去除率为73.88%。实验值与预测值基本相符,证实了各方程的准确性和实用性。通过清洗条件的优化,指导流通领域超市和集贸市场对绿叶菜的清洗方法,有利于建立相关管理制度,提高农产品食用安全性。
本研究表明,用清水清洗,适度的水温、清洗时间及水流冲击,有助于绿叶菜农残的去除。相关研究也证实,甘蓝50℃,上海青油菜40℃清洗,能较好去除高效氯氰菊酯残留,去除率与水温和浸泡时间都呈正相关[19-20];清水冲洗莴苣和菠菜的毒死蜱去除效果好,为 45.3%~72.9%[21]。
本实验结果显示,NaHCO3碱性溶液清洗优于清水,去除率可提高约40%,这可能与此类有机磷和氨基甲酸酯类农药在碱性条件下易发生水解有关。相关已有研究显示,pH 11.5的碱水清洗10~15 min对生菜中毒死蜱的去除率为70% ,效果明显好于pH 10.5的碱水、臭氧水和自来水[16]。pH 8.3~11.1的NaHCO3溶液对小白菜中毒死蜱残留的去除率为31.8%~34.4%[22]。上海青油菜中乐果的去除率随着pH值的升高、浸泡时间的延长而提高[23]。
本研究结果同时表明,过度的清洗,如长时间、高温度、高浓度等,会降低绿叶菜农残的去除率,这可能与过度清洗造成的蔬菜机械或化学损伤有关。已有报道显示,当甘蓝70℃,上海青油菜50℃以上清洗时,菜叶呈煮熟状,导致营养成分遭到破坏[19]。此外,碱性溶液容易渗入叶菜类蔬菜的薄且不完整的蜡质层,引起叶绿素转变为叶绿酸盐、叶绿醇等产生鲜绿色泽,推测过高浓度碱性溶液的长时间浸泡将破坏蔬菜细胞组织,反而降低其农残去除效果,如pH>9且浸泡时间超过20 min对青油菜的外观及营养有影响[23],长时间浸泡清洗不利于蔬菜农残去除,反而使其在蜡质层表面吸附和富集[16]。
此外,不同品种绿叶菜的表面积大小、农药内吸性程度和组织渗透程度差异对农药的去除作用都有影响。因此,清洗方式和条件要根据蔬菜种类、受污染农药品种与污染程度等确定清洗条件,以确保食用安全性,同时,需要关注这些方法在降解农残的同时对蔬菜营养与品质的不良影响。
[1]曹坳程,郭美霞.21世纪中国农药工业的需求与发展[J]. 中国农业科技导报,2005,7(6):37 -42.
[2]WANG Shu-mei,WANG Zhi-lun,ZHANG Yi-bei,et al.Pesticide residues in market foods in Shaanxi province of China in 2010[J].Food Chemistry,2013,138(2):2 016-2 025.
[3]ZHANG Bo,LI Yan,GAO XinHao,et al.Status and suggestions of the pesticide use in the protected vegetable fields in Shandong province[J].Journal Board of Asian Agricultural Research,2013,5(4):117 -120.
[4]YANG Lan-qin,HUANG Biao,HU Wenyou,et al.Assessment and source identification of trace metals in the soils of greenhouse vegetable production in eastern China[J].Ecotoxicology and Environmental Safety,2013,97:204 -209.
[5]ZHOU Jie-hong,JIN Shao-sheng.Safety of vegetables and the use of pesticides by farmers in China:evidence from Zhejiang province[J].Food Control,2009,20(1):1 043-1 048.
[6]中华人民共和国商务部.申城春播蔬菜65万亩[EB/OL].(2014-02-25)[2014-03-31].http://syggs.mofcom.gov.cn/article/resume/n/201402/20140200498667.shtml
[7]Arienzo M,Cataldo D,Ferrara L.Pesticide residues in fresh-cut vegetables from integrated pest management by ultra performance liquid chromatography coupled to tandem mass spectrometry[J].Food Control,2013,31(1):108 -115.
[8]HAO Jian-xiong,Wuyundalai,LIU Hai-jie,et al.Reduction of pesticide residues on fresh vegetables with electrolyzed water treatment[J].Journal of Food Science,2011,76(4):520-524.
[9]Krieger R I,Brutsche-Keiper P,Crosby H R,et al.Reduction of pesticide residues of fruit using water only or plus fit fruit and vegetable wash[J].Bulletin of Environmental Contamination& Toxicology.2003,70(2):213-218.
[10]Haute S van,Sampers I,Holvoet K,et al.Physicochemical quality and chemical safety of chlorine as a reconditioning agent and wash water disinfectant for fresh-cut lettuce washing[J].Applied and Environmental Microbiology,2013,79(9):2 850 -2 861.
[11]LUA Y G,NOU X W,Millner P,et al.A pilot plant scale evaluation of a new process aid for enhancing chlorine efficacy against pathogen survival and cross-contamination during produce wash[J].International Journal of Food Microbiology,2012,158(2):133 -139.
[12]Hassenberg K,Fr hling A,Geyer M,et al.Ozonated wash water for inhibition of Pectobacterium carotovorum on carrots and the effect on the physiological behaviour of produce[J].European Journal of Horticultural Science,2008,73(1):37 -42.
[13]YUAN Yu-wei,CHEN Chen,ZHENG Chuang-mu,et al.Residue of chlorpyrifos and cypermethrin in vegetables and probabilistic exposure assessment for consumers in Zhejiang Province,China[J].Food Control,2014,36(1):63-68.
[14]ZHANG Jin-qiang,DONG Yuan-hua,AN Qiong,et al.Residues of carbamate pesticides in soils and vegetables under different vegetation systems[J].Acta Pedologica Sinica,2006,43(5):772 -779.
[15]张劲强,董元华,安琼,等.不同种植方式下土壤和蔬菜中氨基甲酸酯类农药残留状况研究[J].土壤学报,2006,43(5):772 -779.
[16]韩礼,侯亚西,汪俊涵,等.不同清洗方式对生菜表面农药残留的降解效果[J].食品与发酵工业,2011,37(12):76-80.
[17]张锐,张玉鑫,白文.不同洗涤处理对叶菜中农药残留去除效果比较[J].农业科技与设备,2010(5):30-34.
[18]张爽,许月明,曹侃.蔬菜中农残去除方法研究[J].安徽科技学院学报,2008,22(5):6-9.
[19]张存政,骆爱兰,王冬兰,等.消解去除食用叶菜中高效氯氰菊酯残留方法的研究[J].农业环境科学学报,2004,24(1):196 -200.
[20]王长方,陈峰,魏辉,等.甘蓝中高效氯氰菊酯残留去除方法的研究[J].农业环境科学学报,2005,24(1):1 081-1 021.
[21]季静.蔬菜中残留农药去除方法及对小鼠相关酶活性的影响研究[D].济南:山东大学,2010:37-39.
[22]刘振龙.两种有机磷农药在小白菜中的残留动态及去除残留方法的研究[D].泰安:山东农业大学,2007:35-40.
[23]游泳,王长方,王俊,等.上海青残留乐果的去除方法[J].福建农林大学学报:自然科学版,2008,37(3):248-252.
