糖链长度对α-乳白蛋白-糖复合物抗原性的影响
2014-11-20范金波蔡茜彤侯宇周素珍冯叙桥
范金波,蔡茜彤,侯宇,周素珍,冯叙桥
(渤海大学食品科学研究院辽宁省食品安全重点实验室,辽宁锦州,121013)
近年来,食物过敏现象逐年增多,已成为人类营养尤其是儿童营养中的一个重要的社会健康问题。调查表明,公众自诉有食物过敏史的大约有15%,约8%小于3岁的儿童有过食物过敏经历。在美国、欧洲等发达地区,已经十分重视食物过敏的研究与防治,而在我国,食物过敏问题还没有引起足够的重视,对食物过敏方面的研究报道较少[1-2]。
牛乳是优质的营养食品,但也是较易引起过敏反应的食物之一,约有2%~6%的婴幼儿对牛乳蛋白有不同程度的过敏。研究表明,α-乳白蛋白(α-LA)、β-乳球蛋白和酪蛋白是牛乳中引起过敏反应的主要乳蛋白。目前,α-LA由于富含必需氨基酸、营养丰富,经常添加到婴幼儿配方奶粉、乳饮料及运动营养补充剂中[3],但是α-LA的抗原性严重影响了α-LA的应用。因此,探索合适的加工方式来降低牛乳α-LA的致敏性,对于提高牛乳制品的安全性具有重要的现实意义。在蛋白质改性技术中,糖基化改性被认为是最安全、最有前景的降低牛乳蛋白致敏性的改性方法。
目前,国内对应用糖基化降低乳蛋白致敏性的研究较少,尤其是对糖的选择方面,缺乏理论基础。有研究表明,在蛋白质的糖基化反应中糖链长度对于糖基化蛋白性能的提高起着十分重要的作用。与单糖、双糖相比,添加多糖可增加蛋白质的功能特性,包括热稳定性、乳化性等[4]。然而,对于糖基化反应中糖链长度对于蛋白质抗原性的影响未有报道。因此,本研究利用α-乳白蛋白(α-LA)-糖复合物,研究糖链长度对α-LA-糖复合物抗原性的影响,为低敏性乳制品的开发提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
胰蛋白酶,购自美国Sigma公司;甲醇(色谱级),购自美 国 Fisher 公 司;NaCl、KCl、KH2PO4、K2HPO4·12H2O、NaOH均为分析纯,购自北京化学试剂公司。
电子天平(ALC-210),美国Satorious公司;酶标仪(M680),美国伯乐公司;高效液相色谱(1100),美国Agilent公司;微量振荡器(ZW-A),江苏省坛金市荧华仪器制造有限公司。
1.2 实验方法
1.2.1 α-乳白蛋白-糖复合物的制备
将α-LA和不同碳链长度的还原寡糖(葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖)按摩尔比1∶13溶解于去离子水中,制成最终蛋白质质量分数为5%的混合液,用1 mol/L NaOH调节溶液pH至8.0,冷冻干燥。将冻干的混合物粉末放入培养皿中,保持相对湿度在65%(饱和KBr溶液)左右,放入培养箱中,55 ℃ 下进行糖基化反应,分别于 0、12、24、36、48 h取出混合物,所得α-LA-糖复合物溶解于去离子水中,溶液最终质量分数为5%,透析除去未反应的糖及盐分,再次冻干,得到的冻干粉于-20℃保存。同时,将不加入糖的α-LA在相同条件下处理作为对照(ct)。
1.2.2 糖基化反应程度的测定
采用邻苯二甲醛法(OPA法)[5]。准确称取40 mg的OPA溶解于1 mL的甲醇中,分别加入20%(w/v)的 SDS 2.5 mL、0.1 mol/L 的硼砂 25 mL、100 μL β-巯基乙醇,最后用去离子水定容至50 mL,此为OPA试剂。测定时取50 μL的样品(蛋白浓度2 mg/mL)与1 mL OPA溶液混合,室温放置2 min。反应完毕后,于340 nm下测其吸光值A1,以在OPA试剂中加入50 μL去离子水为空白样,两者之差ΔA为自由氨基的净吸光值。用浓度为(0.25~2.00)×10-3mol/L赖氨酸作标准曲线,通过标准曲线转换成赖氨酸的浓度。游离氨基酸残留量即为糖基化反应后的α-LA-糖中游离氨基酸的浓度与未反应的α-LA中游离氨基酸的浓度的比值。
1.2.3 间接竞争ELISA方法测定α-乳白蛋白及复合物的抗原性
前期通过α-LA免疫新西兰大白兔,制备了兔抗α-乳白蛋白的多克隆抗体。经测定最高效价达到了1∶256 000;同时,所制备的抗体与乳中其他主要蛋白质不存在免疫交叉反应,特异性良好,利用此抗体测定α-乳白蛋白的抗原性,过程如下:
(1)抗原包被:用包被液(浓度为50 mmol/L,pH 9.6的碳酸盐缓冲液)稀释α-LA至质量浓度为0.5 μg/mL,100 μL/孔加入96 孔酶标板,于4 ℃放置过夜。
(2)样品和抗血清预混合:在反应管中加入蛋白质量浓度为0.1 g/L的样品和相同体积一定稀释度(α-LA,1∶64 000)的抗血清,不加样品的反应管作为无竞争体系,4℃放置过夜,次日倾去孔内液体,PBST(PBS+0.05%Tween-20)洗涤3次,拍干。
(3)封闭:加封闭液(含0.1 g/L明胶的包被液)进行封闭,100 μL/孔,37 ℃ 放置 1 h,PBST 洗涤 3次,拍干。
(4)抗原抗体反应:加入(2)中样品和抗血清的预混合液,100 μL/孔,37 ℃ 温育 1 h,PBST 洗涤 3次,拍干。
(5)加酶标二抗:用封闭液将HRP-羊抗兔IgG稀释 5 000 倍,100 μl/孔,37 ℃温育1 h,PBST 洗涤3次,拍干。
(6)显色:加新鲜配制的 TMB底物溶液,100 μL/孔,37℃暗处反应15 min,显示蓝色。
(7)终止反应:加浓度为2 mol/L的H2SO4,50 μL/孔终止反应,颜色变黄。
(8)吸光值测定:利用酶标仪双波长测定各孔的吸光值。
(9)数据处理:被测物残留的抗原性大小用其抗原抑制率来评价,按下式计算:

式中:B为被测样的A值;B0为无竞争体系的A值。
1.2.4 糖基化位点分析
采用胰蛋白酶酶解糖基化后的样品,酶与底物摩尔比1∶100,在37℃下进行并调节样品至pH 8.5,酶解2 h后灭酶,利用高效液相色谱-质谱联用分析糖基化蛋白酶解产物,根据蛋白一级序列分析其糖基化位点。
色谱条件:Zobalx SB-C18色谱柱(2.1 mm ×150 mm)。洗脱速度为0.2 mL/min,流动相分别为5%~45%的缓冲液A(三氟乙酸∶水=体积比0.1∶99.9),洗脱 50 min;45%~60%缓冲液 A,洗脱5 min;60%~90%的洗脱液A,洗脱65 min。质谱条件:喷雾电压为3.5 kV,干燥气温度为300℃,质量扫描范围300~2 000 m/z。
2 结果与分析
2.1 糖基化反应程度的测定
糖基化反应的基础是蛋白质中氨基酸侧链(主要为赖氨酸的ε-氨基)与还原糖的还原性羰基末端反应,得到共价复合物。所以,通过测定糖基化前后的自由氨基残留量的变化可以定量分析α-LA糖基化反应程度。如图1所示,所有糖基化的α-LA-糖复合物中的游离氨基酸残留量均随反应时间的增加而降低,表明α-LA与还原糖之间发生了交联。其中,单糖与α-LA混合物游离氨基酸降低最快,在处理48 h后,葡萄糖-α-LA的游离氨基酸残留量为40.59%。在与其他糖的反应中,游离氨基酸降低较慢,麦芽糖-α-LA、麦芽三糖-α-LA、麦芽四糖-α-LA 和麦芽五糖-α-LA的游离氨基酸残留量分别为50.49%、57.98%、70.38%和72.94%。结果表明,与α-LA的糖基化反应中,糖的反应性由高到低分别为:葡萄糖>麦芽糖>麦芽三糖>麦芽四糖>麦芽五糖。糖基化程度以及反应速率随糖链长度的增加而降低,可能是由不同分子大小的糖所引起的结合位阻不同而引起的[6]。糖链越短,所含的开链形式越多,糖与蛋白质中氨基的反应活性就越强[7-8]。

图1 糖链长度对自由氨基残留量的影响Fig.1 Effect of saccharide size on free amino groups of glycated α-LA
2.2 α-乳白蛋白-糖复合物抗原性分析
图2显示的是不同链长寡糖糖基化产物抗原性的变化。在55℃加热条件下,未经过糖基化的α-LA的抗原性伴随加热时间的延长稍有提高,这可能是由于长时间的热处理,使α-LA的构象改变,蛋白质空间结构的展开导致分子内部的部分抗原决定簇暴露[9],这与 Kleber[10]等人研究 β-LG 加热条件下抗原性变化的趋势一致。
5种糖基化样品的抗原性与原α-LA蛋白相比,抗原性均有明显下降。α-LA的抗原性随糖基化反应时间的增长而降低,说明糖基化程度对于降低蛋白质抗原性起着十分重要的作用。被引入的糖分子通过空间位阻和电荷作用,掩蔽蛋白上的抗原决定簇,从而降低α-LA的抗原性[11]。然而,抗原性降低效果最好的是麦芽三糖-α-LA复合物,48h糖基化处理后,α-LA的抗原抑制率达到51.67%,但是由糖基化反应程度结果看,麦芽三糖-α-LA的糖基化程度并不是最高的。这说明,糖与蛋白的结合部位可能对其抗原性起到更为关键的作用。
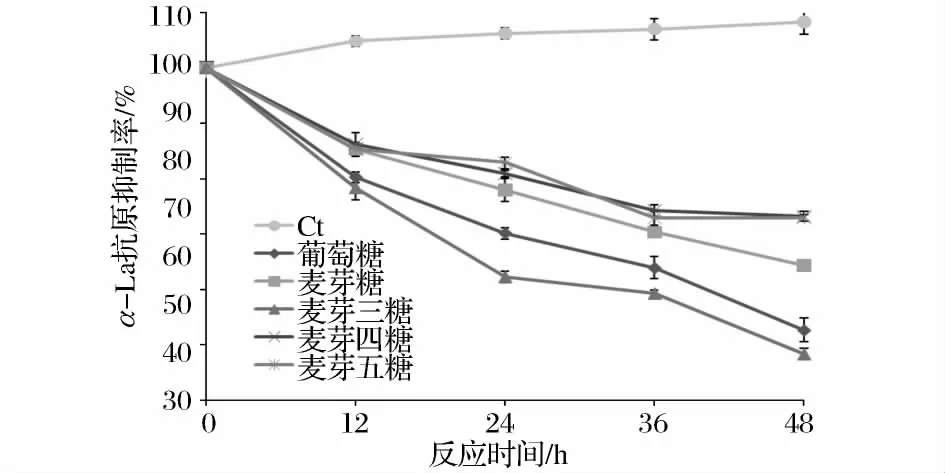
图2 糖链长度对α-乳白蛋白抗原性的影响Fig.2 Effect of saccharide size on the antigenicity of α-LA
2.3 糖基化位点分析
图3为葡萄糖-α-LA糖基化样品的酶切肽段的ESI质谱图,其中,经过分子质量对比分析(有1分子葡萄糖加入到肽段上,肽段分子质量增加162)得出糖基化肽段有6条,分别为肽段(17~62)、(59~79)、(80~94)、(95~108)、(99~114)和(109~122)。结果表明,葡萄糖糖基化样品中,Lys58、Lys62、Lys93、Lys98、Lys108以及 Lys1146个赖氨酸残基被糖基化。利用同样的方法,分析麦芽糖、麦芽三糖、麦芽四糖及麦芽五糖糖基化产物的糖基化位点,如表1所示。对比5种还原糖的糖基化位点及其糖基化产物的抗原性,我们发现Lys58糖基化位点可能对于α-LA的抗原性起重要作用。Lys58位点仅在抗原性降低最多的葡萄糖-α-LA和麦芽三糖-α-LA中被糖基化。由于糖基化作用是通过被引入的糖分子的空间位阻和电荷作用,掩蔽蛋白上的抗原决定簇,从而降低蛋白的过敏原性。因此,我们判断Lys58位点位于α-LA的抗原决定簇序列上。Maynard[12]等人的研究也指出,肽段(17~58)以及包含此段氨基酸序列的更大肽段与IgE有强烈的反应,表明肽段(17~58)为α-LA的主要抗原决定簇。综合以上结果说明糖基化反应产物的抗原性受糖基化程度及糖基化位置的共同影响。
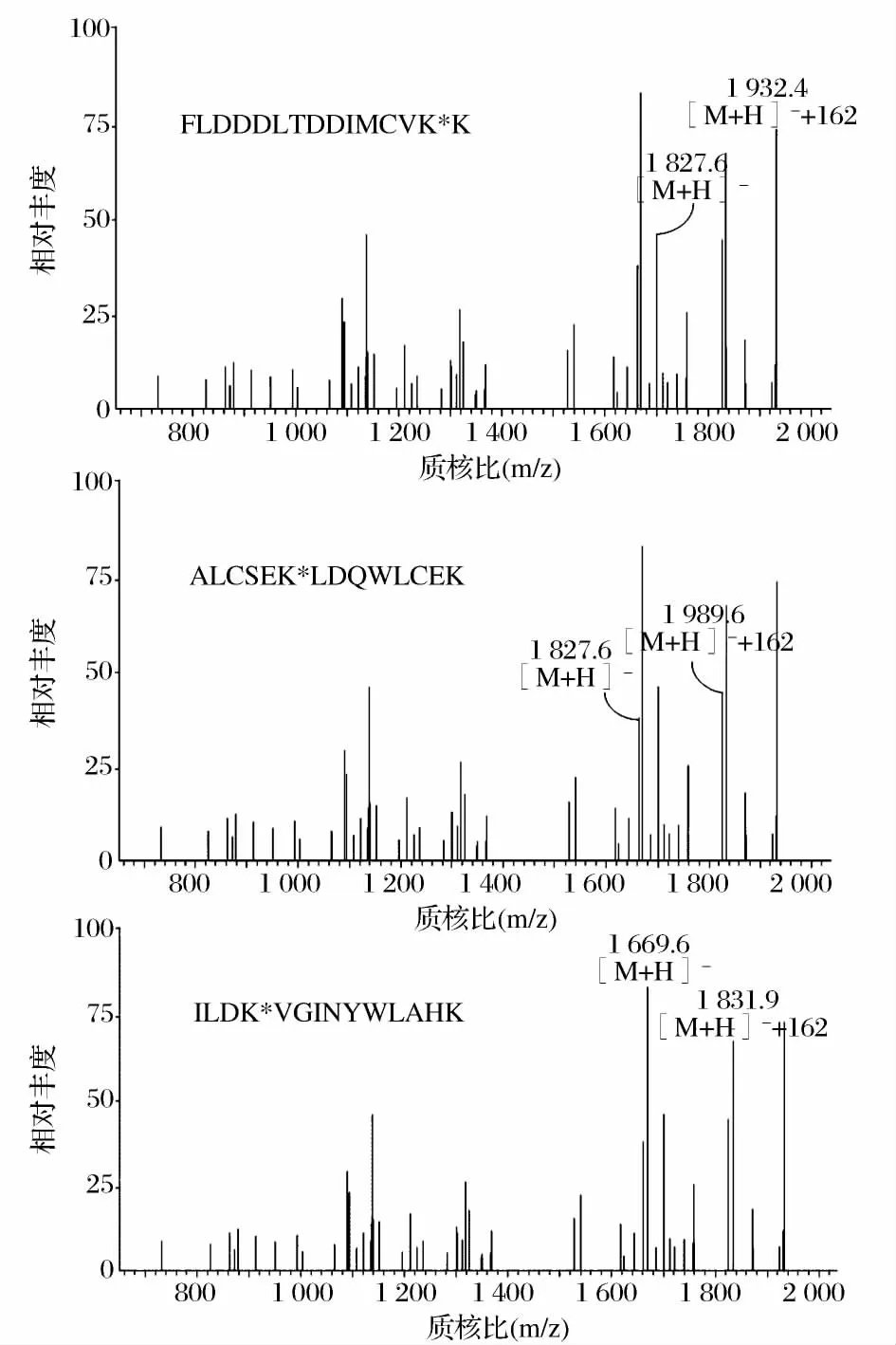
图3 葡萄糖-α-LA的糖基化肽段(80~94,95~108,109~122)Figure 3 Sequences correspond to glycated peptides of

表1 α-乳白蛋白糖基化样品胰蛋白酶酶解肽段质谱分析Table 1 HPLC-MS/MS analysis of peptides obtained from the trypsin digestion of glycated α-LA after glycation
3 结论
本文重点研究了5种不同糖链长度的糖与α-乳白蛋白糖基化反应对后者抗原性的影响,结果表明糖基化程度随糖链长度的增长而降低。此外,经过糖基化反应α-LA抗原性显著下降,并且α-LA的抗原性随糖基化反应时间的增长而降低,说明糖基化程度对于降低蛋白质抗原性起着十分重要的作用。但是抗原性降低幅度最大的是麦芽三糖-α-LA,进一步通过测定糖基化位点,发现Lys58位点仅存在于抗原性降低最多的葡萄糖-α-LA和麦芽三糖-α-LA中,说明α-LA糖基化产物的抗原性受糖基化程度及糖基化位点的共同影响。
[1]包怡红.乳清多肽及其发酵制品的研究[D].哈尔滨:东北农业大学,2001:11-34.
[2]Maldonado J,Gil A,Narbona E,et al.Special formulas in infant nutrition:a review[J].Early Human Development,1998,53(1):S23-S32.
[3]Lönnerdal B,Lien E L.Nutritional and physiologic significance of α-lactalbumin in infants[J].Nutrition Reviews,2003,61(9):295-305.
[4]Shu Y W,Sahara S,Nakamura S,et al.Effects of the length of polysaccharide chains on the functional properties of the Maillard-type lysozyme-polysaccharide conjugate[J].Journal of Agricultural and Food Chemistry,1996,44(9):2 544-2 548.
[5]Fayle S E,Healy J P,Brown P A,et al.Novel approaches to the analysis of the Maillard reaction of proteins[J].E-lectrophoresis,2001,22(8):1 518-1 525.
[6]Nacka F,Chobert J M,Burova T,et al.Induction of new physicochemical and functional properties by the glycosylation of whey proteins[J].Journal of Protein Chemistry,1998,17(5):495-503.
[7]Chevalier F,Chobert J M,Popineau Y,et al.Improvement of functional properties of β-lactoglobulin glycated through the Maillard reaction is related to the nature of the sugar[J].International Dairy Journal,2001,11(3):145-152.
[8]Pokharna H K,Pottenger L A.Nonenzymatic glycation of cartilage proteoglycans:an in vivo and in vitro study[J].Glycoconjugate Journal,1997,14(8):917-923.
[9]Kleber N,Hinrichs J.Antigenic response of β-lactoglobulin in thermally treated bovine skim milk and sweet whey[J].Milchwissenschaft,2007,62(2):121-124.
[10]Kleber N,Krause I,Illgner S,et al.The antigenic response of β-lactoglobulin is modulated by thermally induced aggregation[J].European Food Research and Technology,2004,219(2):105-110.
[11]Arita K,Babiker E E,Azakami H,et al.Effect of chemical and genetic attachment of polysaccharides to proteins on the production of IgG and IgE[J].Journal of Agricultural and Food Chemistry,2001,49(4):2 030-2 036.
[12]Maynard F,Jost R,Wal J M.Human IgE binding capacity of tryptic peptides from bovine α-lactalbumin[J].International Archives of Allergy and Immunology,1997,113(4):478-488.
