影响12种壬基酚同分异构体液液萃取效率的因素研究
2014-11-20王世玉吴文勇尹世阳刘玉龙陈会会
王世玉,刘 菲*,吴文勇,尹世阳,刘玉龙,陈 亮,张 伟,陈会会
(1.中国地质大学(北京)水资源与环境工程北京市重点实验室,北京100083;2.北京市水科学技术研究院,北京100048;3.中国石油集团安全环保技术研究院,北京102206;4.水利工程仿真与安全国家重点实验室,天津大学,天津300072;5.河北煜环环保科技有限公司,河北石家庄050000)
壬基酚(nonylphenol)是一种典型的环境内分泌干扰物[1-2],主要由雌激素效应不同的同分异构体组成[3]。壬基酚主要来自污水中壬基酚聚氧乙烯醚(NPEOs)的降解。壬基酚能够导致生物生殖系统畸形,国外曾报道壬基酚能够导致雄性生物雌性化及后代出现雌雄兼备现象[4-5],还能引起人类乳腺癌细胞株MCF-7增殖[6],对生物和人体造成严重危害。随着工农业的发展,水体受壬基酚污染越来越严重,污水中壬基酚的提取已成为亟需解决的问题,实现水体中壬基酚的提取对地下水监测也具有非常重要的现实意义。
目前,国内外对于水样中壬基酚的提取主要有液液萃取[7-10]、固相萃取[11-22]、固相微萃取[23]、蒸汽蒸馏[24]及离子液体[25]等方法。薛光璞等[7]、傅明珠等[8]用液液萃取技术分别对长江南京段及长江口段水样进行处理,壬基酚回收率分别达76.1%~125%、77.2% ~103.6%。金星龙等[9]、李正炎等[10]分别对天津某污水处理厂和西瓦胡水样用液液萃取技术处理后测定出壬基酚含量分别为44.3~110.7 ng/L、17.4 ~113.4 ng/L。固相萃取、固相微萃取、蒸汽蒸馏及离子液体对壬基酚提取的回收率在70%以上,但是固相萃取及固相微萃取技术因其固相萃取柱、固相萃取膜及固相萃取纤维较昂贵,且不能重复使用等特点不适于大批量水样的处理;蒸汽蒸馏法因其要达到一定压力和温度,对半挥发性物质提取易造成损失;离子液体法较传统有机溶剂萃取有时间长的缺陷[26]。以上提取方法对壬基酚都是限于总量方面的研究,但是相关毒理学实验表明,壬基酚每种异构体的雌激素效应不同,对环境造成危害的并不是所有异构体,所以有必要对每种异构体进行单独定量研究,而对每种异构体提取是定量的前提。
本文以EPA3520对酚类物质的液液萃取方法为基础,对12种壬基酚同分异构体的萃取条件进行优化,通过选择萃取溶剂、萃取溶剂用量、盐度、pH等条件,对12种壬基酚同分异构体回收率作了比较,确定了液液萃取的最优条件,优化了水样中壬基酚液液萃取方法,使其在设备廉价、操作简单的前提下,达到同样符合USEPA对回收率的规定。
1 实验部分
1.1 仪器与主要试剂
6890N/5975型气相色谱 -质谱仪(美国Agilent公司),7683B Series自动进样;毛细管色谱柱,DB-5MS(60 m ×0.25 μm ×0.25 mm);Syncore平行蒸发仪(瑞士BUCHI公司);SA400垂直振荡器(日本大和 yamato公司);pH计(北京旭日东辉公司)。
壬基酚混合标准:0.25 g,纯度100%;萘-D8:0.1 g,纯度 99.3%(德国 Dr Ehrenstorfer GmbH公司)。
二氯甲烷、正己烷、乙酸乙酯(色谱级,美国迪马公司);环己烷(农残级,美国迪马公司);氯化钠、无水硫酸钠(优级纯,天津四友精细化学品有限公司),置于400℃马弗炉内烘烤12 h,保存备用。
氦气:纯度99.999%(北京华元气体有限公司);超纯水(电阻率18 MΩ·cm)。
1.2 标准储备溶液的配制
将固体壬基酚混合标准、内标物质萘-D8溶于二氯甲烷,配制成1000 mg/L的标准储备溶液,分装熔封于安瓿瓶中于-18℃下避光保存,使用时逐级稀释。
1.3 水样前处理
本研究以USEPA3520C对酚类物质的液液萃取方法为基础,展开液液萃取壬基酚条件的优化。未优化的USEPA3520方法应用于壬基酚为:在1 L超纯水中配制壬基酚浓度为5 μg/L的空白加标样品,调节水样 pH<2,加入30 g氯化钠进行盐析,用60 mL二氯甲烷为萃取剂分三次萃取,每次20 mL,合并萃取液,萃取液经无水硫酸钠脱水后平行蒸发至小于1 mL,加入50 mg/L内标萘-D8标准溶液10 μL[27-28]。
1.4 色谱条件
升温程序:50℃为初温,保持1 min;以5℃/min升到150℃,保持1 min;再以2℃/min升到180℃,保持5 min。进样口温度250℃;载气 He;柱流速1 mL/min;进样方式:不分流;进样量1 μL,溶剂延迟17 min;MS接口温度280℃。
1.5 质谱条件
离子源为电子轰击源;离子源温度230℃;四极杆温度150℃;扫描范围50~300 amu;电流电压70 eV;电子倍增器电压1988 V;信号采集方式为全扫描(Scan)和选择性离子扫描(SIM)模式。12种壬基酚同分异构体分离的谱图如图1所示[29]。
2 结果与讨论
2.1 不同萃取剂对12种壬基酚同分异构体回收率的影响
为研究不同萃取溶剂对壬基酚的提取效率,依次用二氯甲烷、正己烷、环己烷、乙酸乙酯作为萃取溶剂处理样品(USEPA3520C),具体实验步骤参照1.3节。每种萃取剂进行3个重复样处理。结果表明,用二氯甲烷、正己烷、乙酸乙酯作萃取剂时,内标萘-D8及壬基酚出峰无异常(图2为用正己烷作萃取剂的谱图)。当用环己烷作萃取剂时,由于环己烷的沸点高于正己烷,出峰时间较正己烷晚,在溶剂延迟之后出峰,和萘-D8出峰时间极为相近,掩盖萘-D8的出峰(图3)。所以,在采用萘-D8为内标物时不宜采用环己烷作萃取剂。
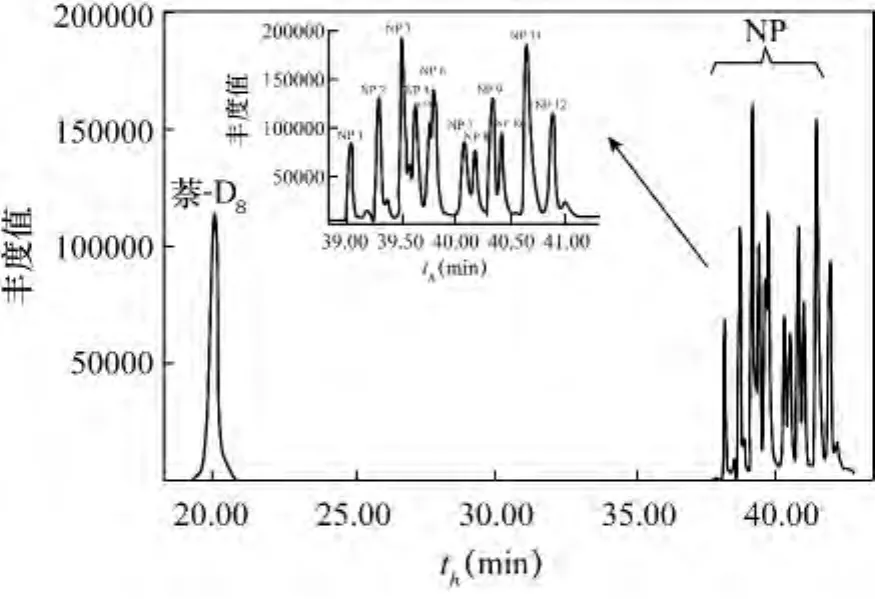
图2 萃取剂为正己烷的色谱图Fig.2 Chromatogram for hexane as extraction solvent
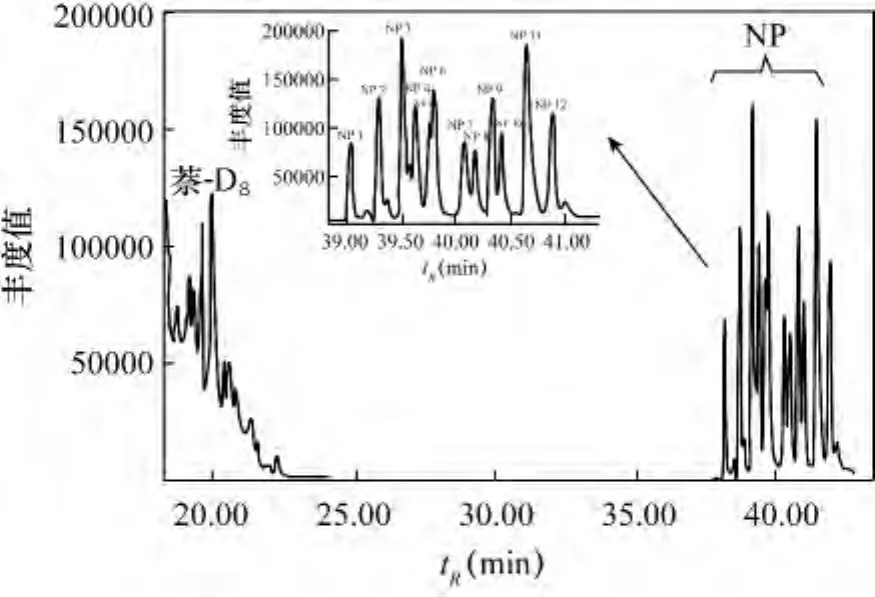
图3 萃取剂为环己烷的色谱图Fig.3 Chromatogram for cyclohexane as extraction solvent
不同萃取溶剂对12种壬基酚同分异构体的回收率情况见图4。由图4可以看出,12种壬基酚同分异构体在以二氯甲烷、正己烷、乙酸乙酯为萃取剂的条件下回收率分别达75.1% ~86.6%、64.9% ~73.2%、53.0%~67.8%。可以看出二氯甲烷的萃取效率最高。原因是壬基酚和二氯甲烷均为极性物质,而正己烷是非极性物质,根据相似相溶原理,壬基酚更能溶于二氯甲烷。乙酸乙酯较其他三种溶剂在水中的溶解度较大,故萃取效率不佳。所以选用二氯甲烷作为壬基酚的最佳萃取溶剂。
2.2 萃取剂二氯甲烷用量对12种壬基酚同分异构体回收率的影响
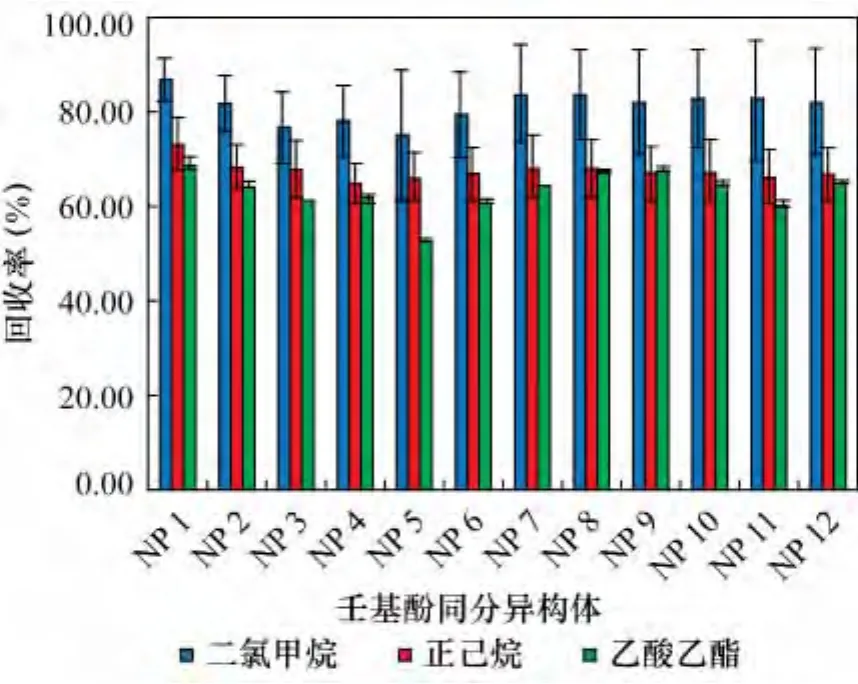
图4 不同萃取溶剂12种壬基酚同分异构体的回收率Fig.4 Recoveries of 12 NP isomers for different extraction solvents
参照2.1节结论,选用二氯甲烷作萃取剂,在只改变萃取剂二氯甲烷用量前提下按照1.3节步骤进行样品处理,研究不同萃取剂用量对壬基酚回收率的影响。分别用 40、60、80、100、120 mL 二氯甲烷分批次萃取(USEPA3520C),每次用量20 mL。每个用量水平进行3个重复样测定。从图5看出,12种壬基酚同分异构体回收率在 40、60、80、100、120 mL 的二氯甲烷用量下,回收率分别为71.1% ~77.6%、81.5% ~93.2%、85.6% ~95.7%、81.9% ~95.4%、62.2% ~72.7%。由图5看出,在二氯甲烷用量小于80 mL范围内,12种异构体回收率随萃取剂用量的增多而升高。当二氯甲烷超过80 mL时,壬基酚回收率呈下降趋势。分析可能的原因,由于是分批次萃取,二氯甲烷每次用量为20 mL,当萃取至第4遍,水中几乎不存在壬基酚,随着萃取次数增多,萃取剂量加大,平行蒸发过程加长可能会导致壬基酚挥发,最终壬基酚回收率下降。
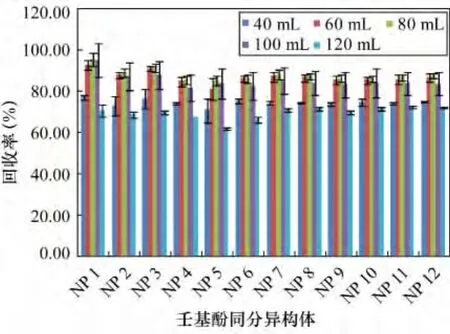
图5 不同萃取剂用量12种壬基酚同分异构体的回收率Fig.5 Recoveries of 12 NP isomers for different extraction solvent dosages
为验证此推断,本研究在平行蒸发管中分别加入40、60、80、100、120 mL 二氯甲烷,均加入 100 mg/L壬基酚混合标准溶液50 L,每种萃取量水平做3个重复样,只进行平行蒸发过程,检测结果见图6。当加入壬基酚的量一定时,萃取溶剂越多,浓缩时间就会越长。除了40 mL溶剂中NP1、NP2的回收率较60 mL稍低外,其他异构体的回收率均随溶剂用量(即平行蒸发时间)的增多而降低,从而证实了过长的浓缩时间会降低壬基酚回收率这一推断。当萃取剂用量为60 mL和80 mL时,壬基酚回收率无明显变化。考虑到经济效益,选定60 mL作为壬基酚液液萃取的最佳溶剂用量。
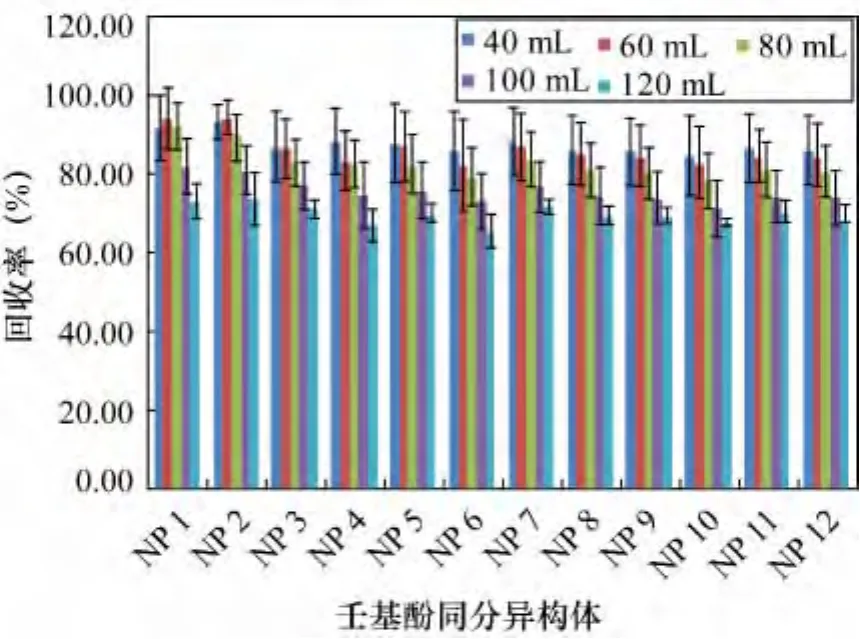
图6 不同萃取时间12种壬基酚同分异构体的回收率Fig.6 Recoveries of 12NP isomers for different extraction time
2.3 pH值对12种壬基酚同分异构体回收率的影响
为研究不同pH对壬基酚回收率的影响,参照2.1节和2.2节结论,在萃取剂选用60 mL二氯甲烷,其他条件按照1.3节进行处理的前提下,只改变溶液pH值。向1 L水样中加入稀释后的硫酸,调节水样pH值,用pH计测得水样pH值分别为0.87、2.85、3.90、4.88、5.29(US EPA3520C)。每个 pH水平做3个重复样。不同pH值下12种壬基酚同分异构体回收率如图7所示。
不同 pH 值 0.87、2.85、3.90、4.88、5.29 条件下,12种壬基酚同分异构体回收率分别为76.0% ~78.8%、66.2% ~80.3%、55.1% ~66.1%、72.2%~88.0%、78.9% ~96.3%。12种壬基酚同分异构体在不同pH值条件下具有相同的变化趋势,又由于实验是暴露于空气中进行的,为方便分析,随机选用NP2回收率随pH值的变化和CO2平衡体系图相结合(图8)。可以看出,NP2回收率转折点pH3.90和CO2平衡体系中HCO3-出现的pH点基本相吻合。当pH<3.90时,NP2回收率随pH值的升高而降低,原因是壬基酚在溶液中存在如式(a)的电离平衡,溶液pH值增大导致H+减少,平衡向右移动,促进壬基酚电离,以分子形式存在的壬基酚减少,从而使壬基酚回收率降低。当pH>3.90时,溶液中开始出现HC,溶液中存在如式(b)的电离平衡,的出现促使平衡向右移动,溶液中以分子形式存在的壬基酚开始增多,所以壬基酚回收率呈上升趋势。可以看出,在pH值为0.87和5.29时,壬基酚回收率均较高,但是在pH5.29附近壬基酚回收率随pH值变化幅度较大,而pH0.87附近,回收率变化较缓慢。为减少人为操作对回收率带来较大影响,选用pH值为0.87较合适,又由于pH值为0.87不易调节。因此,选定pH<1作为壬基酚液液萃取的最佳pH值。
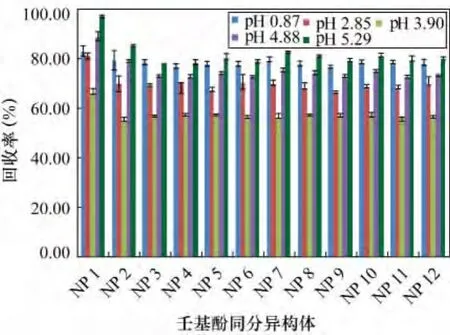
图7 不同pH条件下12种壬基酚同分异构体的回收率Fig.7 Recoveries of 12 NP isomers for different pH

图8 不同pH下NP2回收率和CO2平衡体系关系Fig.8 The relationship between recovery of NP2 and the CO2balance system at differert pH
2.4 氯化钠用量对12种壬基酚同分异构体回收率的影响
参照2.1节、2.2节及2.3节结论,在萃取剂选用60 mL二氯甲烷,调节水样pH<1,其他条件按照1.3 节进行处理的前提下,分别用 10、30、60、90、120 g氯化钠进行盐析(US EPA3520C)。每个氯化钠用量水平做3个重复样,不同氯化钠用量条件下,12种壬基酚的回收率结果见图9。
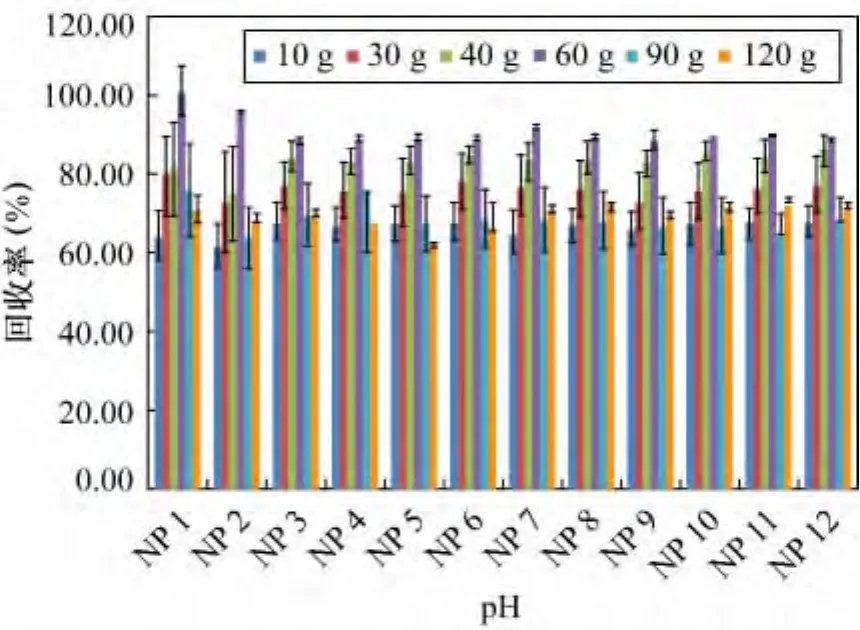
图9 氯化钠不同用量12种壬基酚同分异构体的回收率Fig.9 Recoveries of 12 NP isomers for different NaCl dosages
从图 9 看出,在不同氯化钠用量 10、30、60、90、120 g条件下,12种壬基酚同分异构体回收率分别为62.0% ~68.1%、73.1% ~79.6%、75.1% ~86.3%、88.7% ~101.2、64.0% ~69.8%、62.2% ~72.7%。当氯化钠用量90 g时,壬基酚回收率随氯化钠用量的增加而升高。当氯化钠用量大于90 g时,回收率反而下降。根据电解质平衡理论,盐浓度愈高,盐析效果愈显著,萃取效果应该更好,但本实验未观察到这样的结果,此实验现象和文献[30]中相似,分析原因可能是当氯化钠用量小于90 g时,盐析起主要作用。当氯化钠用量大于90 g时,溶液中起主导的不再是盐析作用,可能是离子强度,复杂的离子效应导致壬基酚回收率下降。至于具体原因,有待进一步深入研究。从图9得出当氯化钠用量为60 g时壬基酚回收率最高,达到88.7% ~101.2%,精密度(RSD,n=3)为10.3% ~13.6%。因此选定60 g作为壬基酚液液萃取的最佳氯化钠用量。
2.5 方法线性范围
配制浓度为 1000、2000、4000、6000、8000 μg/L的壬基酚标准溶液,按照1.4节及1.5节的实验方法,测得壬基酚的线性范围为1000~8000 μg/L,线性回归方程见表1。12种同分异构体的色谱峰峰面积和浓度成线性相关,线性相关系数(R2)均大于0.990。
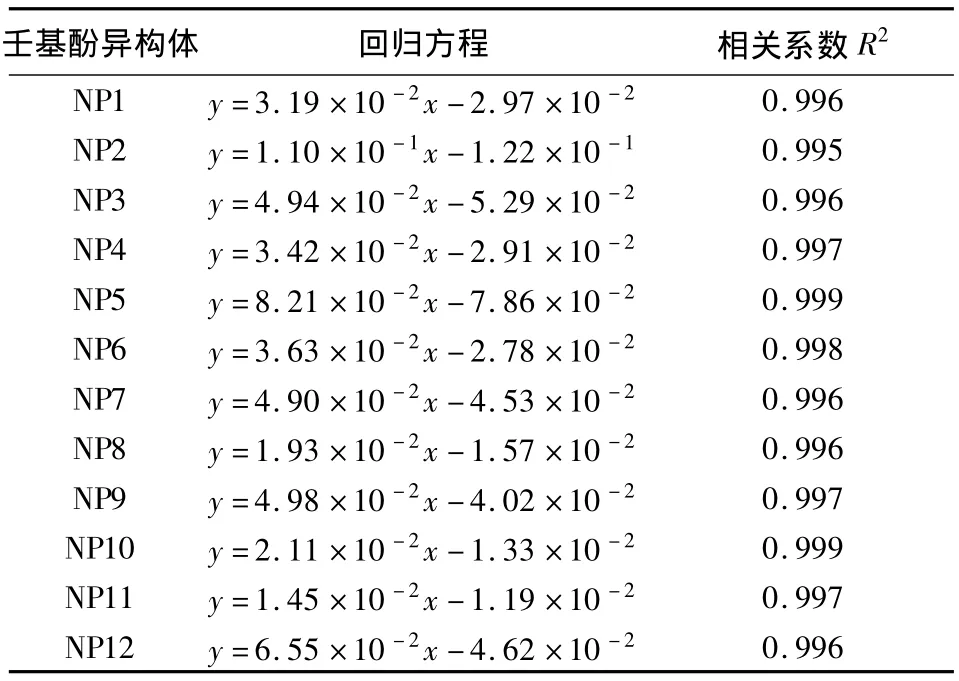
表1 12种壬基酚同分异构体的线性回归方程和相关系数Table 1 Linear regression equations and correlation coefficients of the 12 isomers
2.6 仪器精密度
将壬基酚浓度分别为 500、1000、2000、5000 μg/L的溶液各重复测定5次来衡量仪器的精密度。12种壬基酚同分异构体测定的相对标准偏差(RSD)均小于4.0%,表明仪器的精密度较好。
2.7 方法回收率及精密度
在1 L超纯水中配制壬基酚浓度分别为0.3、0.5、2、6 μg/L 的空白加标样品,每个浓度做 5 个重复样,按照优化的前处理方法制备样品。不同浓度水平的12种同分异构体回收率为69.4%~129.0%,RSD为0.61% ~14%(表2),可以看出,优化的方法回收率满足US EPA规定的70%~130%,且方法精密度良好。
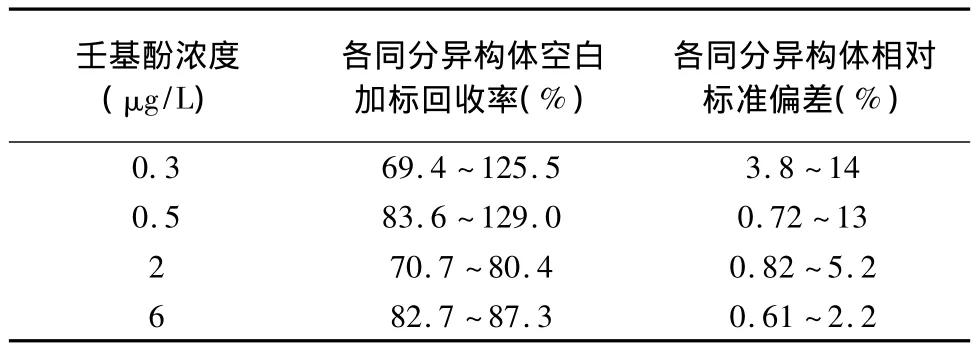
表2 方法精密度及回收率Table 2 Precision and recovery tests of the method
2.8 方法检出限
在1 L超纯水中配制壬基酚浓度为0.3 μg/L的空白加标样品5个,按照前处理方法萃取后进行测试,按照式(1)计算方法检出限(MDL),12种壬基酚同分异构体的方法检出限为9.0~41.4ng/L(表3),对每种异构体给定检出限,较之前只研究总量检出限有创新之处。

式中,tn-1,0.99—置信度为99%,自由度为n-1的双边分布 t值,t4,0.99=4.6;s—n个样品的标准偏差;kf—样品富集倍数,本方法为1000。
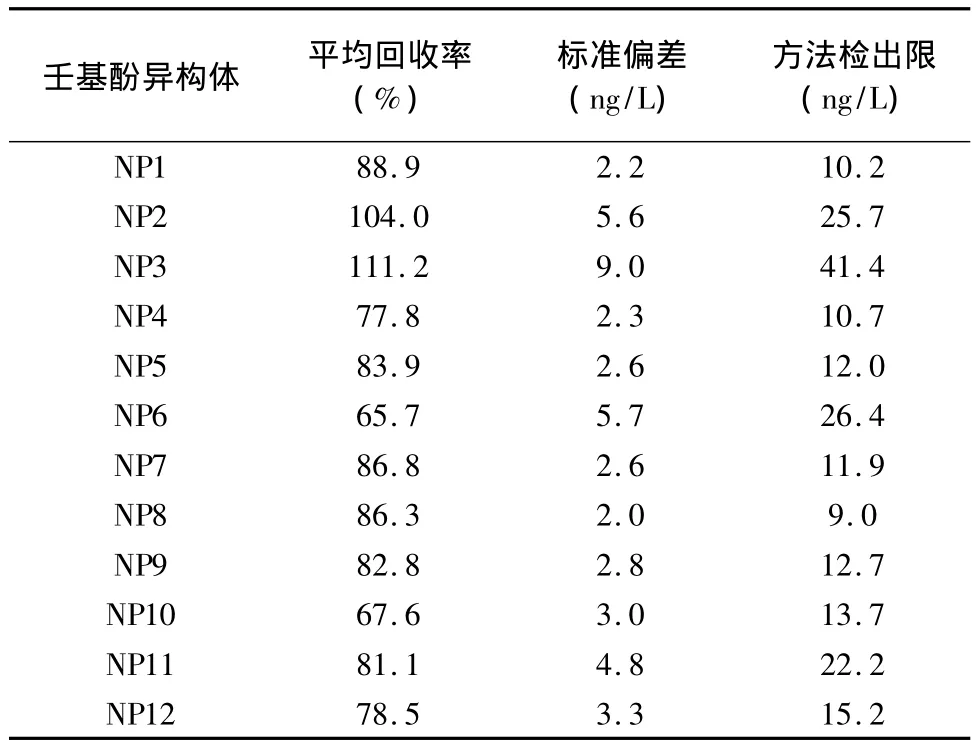
表3 方法检出限Table 3 Detection limits of the method
3 实际水样分析
在北京市大兴区再生水灌区采集河道中的再生水,按照优化的方法处理样品,测试结果见表4。实验室空白中未检出壬基酚,实验室空白加标回收率及北野场平行组的相对标准偏差(RSD)均在USEPA范围内(RSD<30%)。小红门和黄村是灌区内两个污水处理厂,黄村污水厂的水流经新凤河,小红门污水厂的水流经北野场。结果显示,小红门污水处理厂各异构体含量略高于黄村污水处理厂,这与不同的处理工艺及原污水中壬基酚含量有关。而北野场的水全部来自小红门污水处理厂,各异构体含量和小红门相当。新凤河的水来自黄村污水厂,但是沿河道污染源极多,所以各异构体含量较其他河流均高。以上采样点均是地表水,可以看出,地表水中各个异构体含量均较高,其中NP3较其他异构体有较高检出浓度。
4 结语
本文对12种壬基酚单独异构体回收率进行研究,较以往只针对总量的研究是一个进步。结果表明,当萃取溶剂为60 mL二氯甲烷,调节水样pH<1且用60 g氯化钠进行盐析时,12种壬基酚同分异构体回收率达到88.7% ~101.2%,精密度(RSD,n=3)为10.3%~13.6%。此回收率是针对壬基酚每种异构体进行的研究,较之前的针对总量提取较创新。但当氯化钠用量为90 g时每种壬基酚异构体回收率出现转折点,可能原因是液液萃取体质的复杂性,除了盐析作用外,可能还存在离子强度等原因,具体原因有待于进一步研究。本文对12种壬基酚异构体回收率的研究,为以后针对单独壬基酚异构体的研究打下了基础,同时对地下水中壬基酚的监测有重要的实际意义。
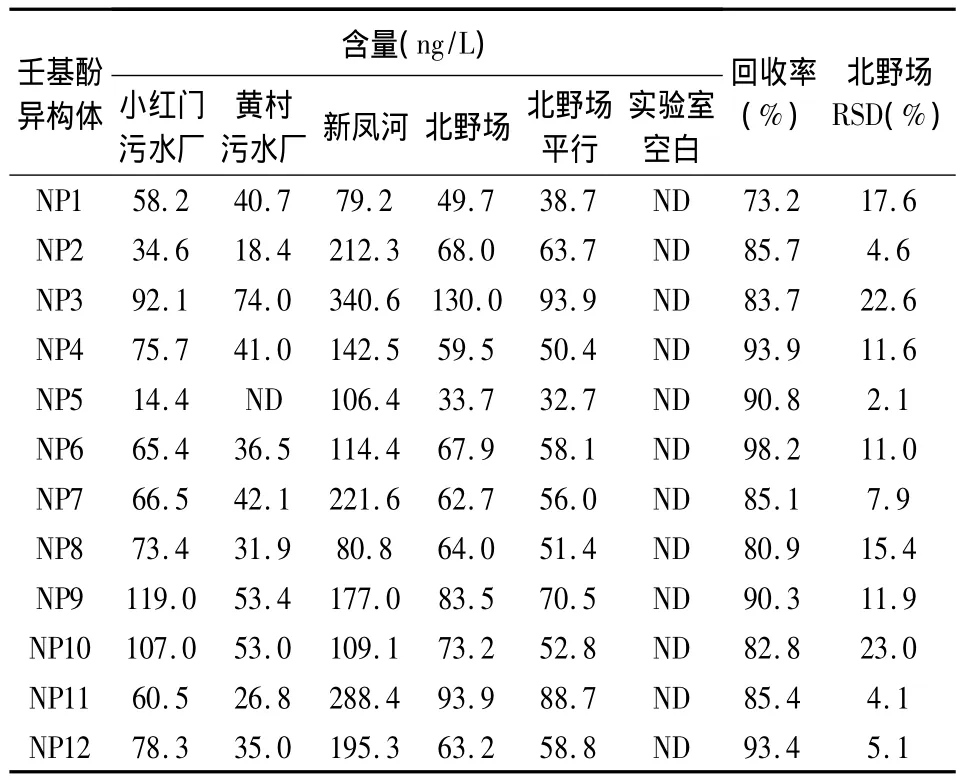
表4 大兴再生水灌区壬基酚含量Table 4 Concentrations of 12 NP isomers in reclaimed water irrigation area in Daxing,Beijing
[1]Arukwe A,Celius T,Walther B T,Goksoyr A.Plasma level of vitellogenin anf eggsh ellzona radiata proteins in 4-nonylphenol and o,p’-DDT treated juvenil Atlantic salmon (Salmosalar)[J].MarineEnvironmental Research,1998,46(1-5):133-136.
[2]Furuichi T,Kannan K,Giesy J P,Masunaga S.Contribution of known endocrine disrupting substances to the estrogenic activity in Tama River water samples from Japan using instrumental analysis and in vitro reporter gene assay[J].Water Research,2004,38:4491-4501.
[3]BS ISO 24293:2009,Water Quality-Determination of Individual Isomers of Nonylphenol-Method Using Solid Phase Extraction(SPE)and Gas Chromatography/Mass Spectrometry(GC/MS)[S].
[4]Lahnsteiner F,Berger B,Grubinger F,Weismann T.The effect of 4-nonylphenol on semen quality,viability of gametes,fertilization success,and embryo and larvae survival in rainbow trout(Oncorhynchus mykiss)[J].Aquatic Toxicology,2005,71:297-306.
[5]Kawahata H,Ohta H,Inoue M,Suzuki A.Endocrine disrupter nonylphenol and bisphenol A contamination in Okinawa and Ishigaki Islands,Japan within coral reefs and adjacent river mouths[J].Chemosphere,2004(55):1519-1527.
[6]沈慧云,徐培渝,余文三,刘玉清,吴德生.对-壬基酚对MCF-7人类乳腺癌细胞雌激素受体表达的影响[J].四川大学学报(医学版),2003,34(4):641-645.
[7]薛光璞,姚朝英.4-烷基酚的GC/MS检测及长江南京段的污染状况[J].环境科学与管理,2010,35(6):1027-1031.
[8]傅明珠,李正炎,王波.夏季长江口及其临近海域不同环境介质中壬基酚的分布特征[J].海洋环境科学,2008,27(6):561-565.
[9]金星龙,江桂斌,黄国兰,周群芳,刘景富.污水处理流程中几种典型酚类化合物的分布[J].环境科学学报,2004,24(6):1027-1031.
[10]李正炎,Li D H.西瓦湖中壬基酚和双酚A的污染特征[J].青岛海洋大学学报,2003,33(6):847-853.
[11]Xian F S,Xin N Z,Guo H X,Qing X Z.Fluorometric determination of nonylphenol in water samples enriched with zirconium doped titanium dioxide nanotubes solid phase extraction[J].Chinese Chemical Letters,2012,23(8):969-972.
[12]Careri M,Elviri L,Mangia A.Development and validation of a method using on-line solid-phase extraction and liquid chromatography with ultraviolet detection for the determination of bisphenol A,octylphenol,and nonylphenol in groundwater[J].Journal of AOAC International,2011,84(5):1383-1392.
[13]Komarek K,Safarikova M,Hubka T,Safarik I,Kandelova M,Kujalova H.Extraction of alkylphenols and nonylphenol mono-and diethoxylates from water using magnetically modified adsorbents [J].Chromatographia,2009,69(1-2):133-137.
[14]Manh H P,Shinji T,Michihiko I,Yayoi K,Kousuke K,Hung V P,Masanori F,Minoru T.Sim L taneous determination of degradation products of nonylphenol polyethoxylates and their halogenated derivatives by solid-phase extraction and gas chromatography tandem mass spectrometry after trimethylsilylation[J].Journal of Chromatography A,2003,1020(2):161-172.
[15]Ding W H,Wu C Y.Determination of estrogenic nonylphenol and bisphenolA in river water by solid-phase extraction and gas chromatography-mass spectrometry[J].Journal of the Chinese Chemical Society,2000,47(5):1155-1160.
[16]郝瑞霞,梁鹏,赵曼,曹可心,周玉文.城市污水再生处理过程中壬基酚的迁移转化行为研究[J].环境污染治理技术与设备,2006,7(2):66-70.
[17]郝瑞霞,梁鹏,赵曼,王俊安,周玉文.固相萃取-气相色谱-质谱-选择离子法检测污水中壬基酚[J].环境科学,2006,27(11):2222-2227.
[18]郝瑞霞,梁鹏,赵曼,王俊安,周玉文.固相萃取法分离富集污水样品中痕量壬基酚[J].环境工程,2006,24(3):71-73.
[19]金士威,徐盈,惠阳,廖涛.污水中8种雌激素化合物的定量测定[J].中国给水排水,2005,21(12):250-254.
[20]刘文萍,石晓勇,王晓波,张传松.北黄海辽宁近岸水环境中壬基酚污染状况调查及生态风险评估[J].海洋环境科学,2009,28(6):664-667.
[21]侯绍刚,徐建,汪磊,孙红文,戴树桂,刘昕宇.黄河(兰州段)水环境中壬基酚及壬基酚聚氧乙烯醚污染的初步研究[J].环境化学,2005,24(3):250-254.
[22]林福华,邱宁宁,黄晓佳,袁东星.搅拌棒固相萃取与液相色谱联用测定水样品中烷基酚类污染物[J].分析化学,2010,38(1):67-71.
[23]陈玲,周海云,刘岚,邓芹英.自动固相微萃取-气相色谱法检测水样中壬基酚[J].中山大学学报,2007,46(5):45-48.
[24]Zhang C,Eganhouse R P,Pontolillo J,Cozzarelli I M,Wang Y.Determination of nonylphenol isomers in landfill leachate and municipal wastewater using steam distillation extraction coupled with comprehensive twodimensionalgas chromatography/time-of-flight mass spectrometry[J].Journal of Chromatography A,2012,12(30):110-116.
[25]Fu X M,Wang L,Dai S G.Mechanism study on the extraction of nonylphenol by ionic liquids in water through IR spectroscopy and quantum chemical calculation[J].光谱学与光谱分析,2011,31(3):625-629.
[26]付新梅,戴树桂,张余.离子液体与传统有机溶剂萃取性能的比较研究[J].分析化学,2006(5):598.
[27]EPA 8270D,Semivolatile Organic Compounds by Gas Chromatography/Mass Spectrometry(GC/MS)[S].2007.
[28]EPA 3520C,Continuous Liquid-Liquid Extraction[S].1996.
[29]王世玉,刘菲,刘玉龙,陈亮.气相色谱-质谱法检测地下水中12种对壬基酚同分异构体[J].分析化学,2013,41(11):1699-1703.
[30]张全争,谢建荣.水中低残留有机物萃取过程的盐析作用及色谱分析[J].环境化学,2001,20(3):286-290.
