金属硫蛋白对热应激下体外培养奶牛淋巴细胞的影响
2014-11-12占今舜吴力专李丽立张彬
占今舜,吴力专 ,李丽立,张彬*
(1.湖南农业大学动物科学技术学院,湖南 长沙410128;2.扬州大学动物科学技术学院,江苏 扬州225009;3.中国科学院亚热带农业生态研究所动物生态营养与健康养殖联合实验室 农业生态工程重点实验室,湖南 长沙410125)
金属硫蛋白(metallothionein,MT)是在1957年研究金属镉的生物学作用时,从马肾中分离出的一类具有分子量低、高巯基且具有与金属离子结合的独特性能的蛋白质。它含有大量的半胱氨酸残基(18~20个),少量或不含芳香族氨基酸和组氨酸,能被金属元素诱导和结合多个金属原子[1-4]。现有研究发现,MT能够通过提高奶牛体内的过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物(GSH-Px)基因的表达来提高奶牛的抗热应激[5-7]。细胞培养技术是在活体内取出与试验相关组织或细胞,在体外模拟体内生理环境,且建立无菌、适温和一定的营养条件,使细胞生长和生存并维持其结构与功能的一种方法。该方法具有易于提供性状相似的试验对象和耗资少,如对于大型经济动物来讲比较经济等特点,被广泛用于医药、农业等领域。利用细胞培养技术来研究MT对奶牛淋巴细胞的影响还尚未见报道。因此,本试验研究在热应激条件下,外源MT对体外培养的奶牛淋巴细胞的影响,目的是从细胞水平研究MT对奶牛的影响,丰富相关理论的研究,为推广MT在奶牛业上的应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 MT的来源 采用本实验室2012年7月诱导合成、分离和纯化的奶牛肝脏锌金属硫蛋白(Zn-MT)[8]。
1.1.2 奶牛淋巴细胞的来源 从湖南省畜牧所购买出生1 d的荷斯坦公奶牛,然后进行屠宰。在无菌条件下取出脾脏放入经过高温灭菌过的PBS(phosphate buffer saline)溶液中。利用无菌的剪刀剪碎脾脏,去掉精膜和脂肪,将其置入胰消化酶中,在恒温气浴锅中37℃,振荡30 min,将组织倒入细胞网筛,用无菌的注射器芯对其碾压、过滤,后将滤液轻轻加入装有牛淋巴分离液的离心管中,1500 r/min,20 min离心,取离心后的第2层乳白色的淋巴细胞层,然后加入4 m L的RPMI 1640进行1500 r/min,15 min洗涤2次,最终得到淋巴细胞,然后用完全培养液进行培养。
1.2 淋巴细胞凋亡的形态学观察
1.2.1 倒置显微镜观察凋亡形态 将提取出来的奶牛淋巴细胞,用完全培养液将细胞稀释成5×105个/m L,随机分为4组,每组细胞培养液中 MT的终浓度分别为0μg/m L(对照组)、70μg/m L(第Ⅰ组)、140μg/m L(第Ⅱ组)、210μg/m L(第Ⅲ组),同时置于细胞培养箱(37℃、5%CO2)中培养20 h,之后同时置于43℃水浴锅中进行热应激处理1 h,再回细胞培养箱中培养3 h,收集每组的细胞在倒置显微镜下进行形态观察。
1.2.2 AO/EB染色观察 取处理过的细胞,调整为5×105个/m L,收集细胞,然后在98μL的细胞悬液中加入2μL的AO/EB荧光染色液,用漩涡混合器将其混匀。用移液枪吸取该液体,将其加在载玻片上,盖上盖玻片后在荧光显微镜下进行观察。
1.3 淋巴细胞内抗氧化指标的检测
检测方法和步骤按照试剂盒上的说明书进行,试剂盒购于南京建成生物工程研究所。
1.4 细胞凋亡相关基因的检测
1.4.1 引物设计 根据GenBank登录序列,以β-actin m RNA作为内参,Primer Premier 5.0设计引物,引物设计结果见表1。引物的合成由上海生物工程股份有限公司完成。
1.4.2 cDNA的合成 根据所购买的Revert AidTMFirst Strand cDNA Systhesis Kit反转录试剂盒中的说明书进行操作。
1.4.3 RT-PCR反应液和反应条件 按表2配制PCR反应液(操作请在冰上进行)。

表1 引物设计Table 1 Primer design
1.4.4 数据的处理 采用Excel软件进行初步处理,然后用SPSS 17.0统计软件进行数据分析,结果以平均值±标准差表示,用LSD方法进行多重比较。
2 结果与分析
2.1 淋巴细胞形态学观察结果

图1 淋巴细胞形态学观察结果Fig.1 Effects of morphological observation on lymphocyte1:对照组Control group;2:试验Ⅰ组Experimental groupⅠ;3:试验Ⅱ组Experimental groupⅡ;4:试验Ⅲ组Experimental groupⅢ.下同The same below.

图2 AO/EB染色观察结果Fig.2 Effects of staining on AO/EB
在倒置显微镜下观察(图1),正常的淋巴细胞悬浮生长并边缘整齐,细胞呈圆形或椭圆形。而本试验结果为奶牛淋巴细胞在43℃热应激下,各组奶牛淋巴细胞出现细胞质的明亮度下降,细胞膜不完整,界限模糊并增强颗粒感,以及细胞肿胀、碎片。说明热应激能够导致奶牛淋巴细胞凋亡和死亡。对照组中细胞肿胀数量和碎片均多于试验Ⅰ~Ⅲ组,试验Ⅰ~Ⅲ组细胞肿胀数量和细胞碎片逐渐增多,且第Ⅰ组最少。说明在细胞培养液中添加低浓度MT可以有效缓解热应激对奶牛淋巴细胞的损伤。但随MT浓度的增加,其缓解作用效果下降。
2.2 AO/EB染色观察结果
淋巴细胞经过AO/EB染色,在荧光显微镜下观察,正常的淋巴细胞会被AO染成绿色,而且荧光染料在细胞内分布均匀;如果经过染色的细胞出现橙色且带有绿色,说明淋巴细胞处在凋亡初期;如果细胞出现橙红色且有凋亡小体的生成,则说明细胞处在凋亡末期。如果细胞坏死,则会被EB染料染成红色。从图2中可以发现,对照组的淋巴细胞大多处在细胞凋亡末期并且大量细胞坏死,而试验Ⅰ组中出现的绿色且带有橙色的细胞,说明细胞处在凋亡初期;试验Ⅱ组中出现较多的橙色细胞,试验Ⅲ组出现部分橙红色和红色细胞,说明细胞从凋亡逐渐转化成坏死。随着MT添加浓度的增加,破裂淋巴细胞出现增加趋势,橙色的数量也在增加,而且出现橙红色和红色。说明热应激下,添加低浓度MT能够改善淋巴细胞的抗热应激作用,较高浓度 MT对奶牛淋巴细胞的凋亡无抑制作用或抑制作用很小。
2.3 淋巴细胞内抗氧化指标的检测结果
从表3中可以看出,试验Ⅰ组和Ⅱ组的奶牛淋巴细胞内的CAT活性显著高于对照组和第Ⅲ组(P<0.01),但试验Ⅰ、Ⅱ组之间差异不显著。细胞内的SOD和GSH-Px的活性,均为试验Ⅰ组显著高于其他3组(P<0.01),对照组的活性最低,且试验Ⅰ~Ⅲ组活性呈逐渐下降的趋势。奶牛淋巴细胞内的丙二醛(MDA)含量,对照组显著高于其他3组(P<0.01),试验Ⅰ~Ⅲ组之间差异不显著(P>0.05),但有随着MT含量的提高MDA含量依次增高的趋势。综合上述结果,可以发现,MT能够通过提高CAT活性、SOD的活性、GSH-Px的活性和降低MDA含量来改善奶牛淋巴细胞的抗氧化性能,进而提高奶牛淋巴细胞的抗热应激能力,且MT提高奶牛淋巴细胞抗氧化能力与其浓度存在密切的联系,添加低浓度的效果优于高浓度。
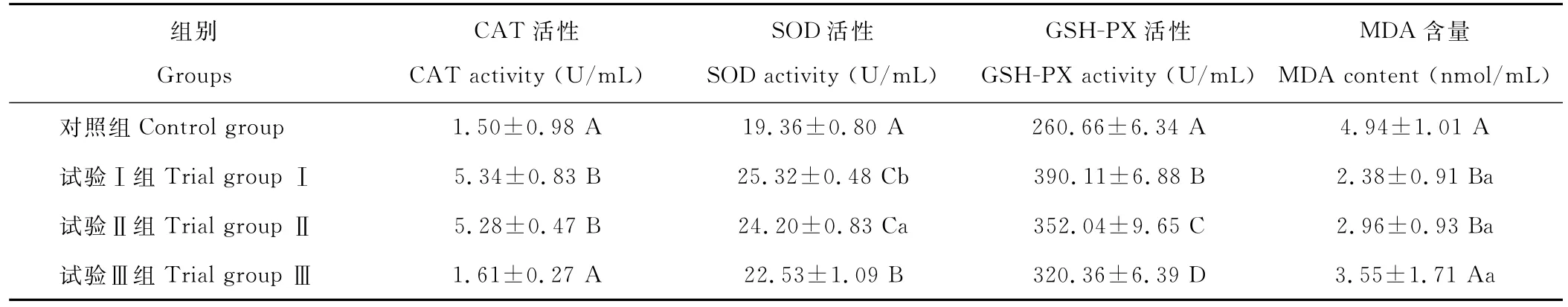
表3 淋巴细胞内抗氧化指标的检测Table 3 Results of the antioxidant indexs of dairy cow lymphocyte
2.4 基因Bax、Bcl-2、p50的RT-PCR检测
从表4可以看到,试验Ⅰ~Ⅲ组的Bax基因相对表达量分别是对照组的0.16,0.34和0.24倍,且均显著低于对照组(P<0.01),其中试验Ⅱ组最高,而试验Ⅰ组最低。说明MT降低了Bax基因相对表达量。对于Bcl-2基因,试验Ⅰ~Ⅲ组表达量显著高于对照组(P<0.01),分别为对照组的2.57,1.78和2.13倍,试验Ⅰ组显著高于试验Ⅱ、Ⅲ组(P<0.01),试验Ⅲ组显著高于试验Ⅱ组(P<0.01)。说明MT能提高Bcl-2基因的表达量,且低浓度的MT效果最好,添加MT浓度的增加,其表达量呈下降趋势。p50基因的表达量为试验Ⅰ~Ⅲ组分别是对照组的0.74,0.65和0.47倍,且各组均显著低于对照组(P<0.01),其中,试验Ⅰ和Ⅱ组显著高于试验Ⅲ组(P<0.01),试验Ⅰ和Ⅱ组之间无显著差异(P>0.01),说明添加MT组的淋巴细胞的p 50基因表达量下降。
3 讨论与结论
3.1 MT对热应激下淋巴细胞形态的影响
热应激是机体在高温环境下对热环境所做出的非特异性生理反应的总和。热应激能够引起乳鼠的心肌细胞、奶牛的外周淋巴细胞和乳腺上皮细胞的凋亡[9-11]。当细胞发生凋亡时,在电镜下观察,可以发现细胞质的密度增加,核质浓缩、核膜核仁破碎,核膜形成小泡,但是细胞膜的结构保持完整。细胞坏死是细胞受到外界因子的刺激引起细胞无序变化的死亡,表现为细胞肿大、胞膜破裂和细胞内容物外溢等。刘庆华等[12]研究热胁迫下淋巴细胞的凋亡情况,发现胞质浓缩,细胞体积缩小,染色体凝集成团,而细胞膜未改变。在本试验中,热应激导致淋巴细胞体积变小,细胞质的明亮度下降,界限模糊并增强颗粒感,出现很多细胞的碎片;淋巴细胞还出现细胞膜不完整、细胞肿胀并溶解的现象,与其研究相一致。王艳凤[13]研究氟对体外培养牛脾脏淋巴细胞凋亡的影响,结果发现,正常的细胞被AO染成绿色,细胞凋亡初期呈橙色,凋亡末期呈橙红色,而坏死细胞则被EB染成红色。从本试验结果来看,说明热应激能够导致体外培养奶牛淋巴细胞的凋亡和坏死。MT是一种分子量低、含有高巯基的蛋白质,具有抗应激的功能。刘颖等[14]研究结果表明,附子多糖能够保护心肌细胞免受损伤的主要原因是其促进MT的合成对抗氧化应激,进而抑制心肌细胞凋亡。在本试验结果中也可以看出,外源MT能够延缓热应激下奶牛淋巴细胞的凋亡,但低浓度的MT效果优于高浓度。研究表明,体外细胞受到应激时,自身能够产生MT来提高体外细胞的存活率[15]。那么,淋巴细胞在热应激情况下,细胞自身应该也会产生一定量的MT来保护淋巴细胞。体外再增加低剂量的MT会协同细胞自身的MT来保护细胞免受热应激的损伤。试验中所用的是Zn-MT,据报道,氧化型物质多,会使MT的分子结构发生变化,导致Zn2+容易从MT中脱离[16]。Zn-MT浓度越高,从其脱离的Zn2+越多,而金属Zn2+对细胞有一定的毒性。因此,高浓度的Zn-MT会使淋巴细胞凋亡和坏死增加。
3.2 MT对热应激下淋巴细胞内抗氧化功能的影响
机体在新陈代谢过程中会产生自由基,自由基具有强氧化性,对机体的组织和细胞具有损伤作用。正常情况下,机体内自由基的产生和清除保持平衡,对机体不会造成伤害,且一定量的自由基对机体有好处。但是,过多的自由基大量积累会因强烈的氧化作用使细胞中的不饱和脂肪酸产生MDA,而MDA能够导致细胞解体,最终促使细胞死亡[17]。机体在受到热应激情况下,会导致活性氧自由基的产生增多,活性氧自由基易与细胞内的大分子进行结合并发生反应,促进细胞或组织的脂质过氧化作用[18]。MT中含有30%的半胱氨酸,且所有的半胱氨酸残基均以还原态出现,容易发生亲和反应。与GSH-Px等相比,自由基更容易攻击MT。因此,MT是一种高效抗氧化剂。MT可提高动物机体的抗氧化物酶活性,从而提高机体的抗氧化能力。李丽立等[19]给仔猪补充外源性Zn-MT,仔猪肝脏SOD、GSH-Px活性得到显著提高。张彬等[7]和李丽立等[8]研究注射外源Zn-MT对奶牛血清的抗氧化性能的影响,结果MT提高了奶牛的SOD、GSH-Px、CAT和T-AOC的活性,且较高剂量的MT改善抗氧化能力的效果优于低剂量,效果表现出一定的时间效应和剂量效应。本试验研究结果发现,在热应激情况下,外源MT能够提高奶牛淋巴细胞的SOD、GSH-Px、CAT活性,降低细胞内的MDA含量,从而改善奶牛淋巴细胞的抗氧化性能,提高奶牛淋巴细胞的抗热应激能力,且MT提高奶牛淋巴细胞抗氧化能力与其浓度存在密切的联系,添加低浓度的效果优于高浓度。Zn是构成CuZn-SOD的组成成分,而CuZn-SOD具有清除氧自由基的作用。另外,Zn是GSH-Px的激活剂,当Zn缺乏时,细胞内的GSH-Px数量会减少,GSH-Px发挥抗氧化作用减弱。在热应激情况下,细胞内产生的自由基会使Zn-MT置换出Zn,从而提高SOD、GSH-Px的活性,增强自由基的清除能力,减少MDA的产生。然而,有报道称,当内环境处于高Zn状态时,能够抑制SOD活性,从而使机体清除氧自由基的功能降低,过氧化脂质堆积。另外,细胞内Zn含量超过生理水平时,就会诱导细胞产生自由基并呈现毒副作用[20]。因此,随着添加Zn-MT的浓度增加,Zn2+的含量增加,使奶牛淋巴细胞内处于高Zn状态,导致抗氧化酶类的活性有所下降,进而促使Zn-MT抗氧化功能下降。
3.3 MT对热应激下淋巴细胞内Bax、Bcl-2基因表达的影响
动物机体在热应激下,机体发生紊乱,其自由基增加以及脂质过氧化,增加活性氧的积累,而活性氧对Bax基因的表达具有促进作用。Bax是促凋亡蛋白,Bcl-2是抑制凋亡蛋白,它们之间通过形成异二聚体来维持细胞凋亡的动态平衡。另外,Bcl-2还通过阻止细胞膜脂质过氧化,抑制线粒体细胞色素C的释放,抑制下游的Caspase活化,进而阻止细胞凋亡[21]。如果自由基清除不及时,导致Bcl-2表达和Bax表达不平衡,会使细胞产生凋亡。谢远杰等[22]发现,热应激后第3天大鼠生精细胞的Bcl-2 m RNA表达明显下降,而第7天Bax m RNA表达明显增加,表明热应激早期导致生精细胞凋亡主要是因为Bcl-2表达减少造成的,后期则由于Bax表达的不断增强,进一步促进生精细胞的凋亡。汪君民和赵阶祥[23]利用免疫组化方法检测热应激组的大鼠外周血淋巴细胞的Bcl-2和Bax基因表达情况,结果与其一致。贾丹等[24]试验结果为热应激下,猪小肠细胞的Bax基因表达升高,Bcl-2基因表达下降,导致小肠绒毛上皮细胞的凋亡增加。蔡亚非等[10]研究热应激对奶牛外周血淋巴细胞Bax-a基因的表达,结果热应激下Bax-a基因的表达量最高,且与淋巴细胞凋亡率呈平行关系。另外,宋学立等[25]通过研究Bcl-2基因转染对热应激心肌细胞保护的作用所得结果认为,在热应激下,Bcl-2基因通过保护心肌细胞线粒体H+-ATPase合成活力,阻抑Caspase 3活化来抑制心肌细胞的凋亡。MT含有大量的巯基基团,还原状态的巯基具有亲核性,自由基容易与其结合,降低体内的氧自由基,进而降低Bax基因的表达。孙忠东等[26]研究发现,用ZnSO4诱导产生的MT能够促使大鼠心肌Bcl-2蛋白的表达增加,Bax蛋白表达下降。罗佳捷等[27]研究Zn-MT对热应激下奶牛淋巴细胞的凋亡基因的影响,结果发现,Bax基因表达量较对照组降低,Bcl-2基因表达增强。另外,Alessandrra等[28]通过试验结果发现MT对Bcl-2蛋白表达有促进作用,认为MT在调控多形性腺瘤细胞凋亡中发挥重要作用。从本试验看,试验组的Bax基因表达显著低于对照组(P<0.01),Bcl-2基因表达量显著高于对照组(P<0.01),Bax/Bcl-2下降,抑制了淋巴细胞的凋亡。说明在一定程度上添加适量外源MT抑制了淋巴细胞的凋亡。Caspase蛋白的级联活动是细胞凋亡的中心环节,由Bcl-2蛋白家族和凋亡抑制蛋白家族(IAPs)联合调控。Zn2+能够与IAPs形成锌指结构,激发其活性,进而抑制细胞凋亡。另外,核酸内切酶中含有相同的Zn2+、Ca2+竞争位点,当Zn2+浓度达到一定程度Zn2+能够和Ca2+竞争与核酸内切酶结合,抑制核酸酶的活性,进而抑制细胞的凋亡。但是,当Zn2+浓度过高时,会导致细胞的DNA降解,促使细胞凋亡进而死亡[29-30]。因此,在本试验中,添加低浓度的Zn-MT,游离出的Zn2+也发挥了抑制细胞凋亡的作用,但是随着添加剂量的增加,Zn2+对淋巴细胞产生了一定的毒性,进而导致抑制细胞凋亡的作用呈下降趋势。在热应激下,机体很容易合成各种热休克蛋白。研究表明,热休克蛋白家族的Hsp70和Hsp40在协同作用下抑制Bax的活化,阻断其促进细胞凋亡;Hsp60能与Bax形成复合物以及增强Bcl-2的作用,进而抑制细胞的凋亡;Bcl-2/Hsp 90β复合物能够抑制细胞色素C和Caspase3的释放[31-33]。罗佳捷等[27]发现MT对热应激下,奶牛血液淋巴细胞的Hsp 70基因的表达具有提高作用。因此,认为在热应激下,MT能通过调控热休克蛋白和细胞凋亡相关基因的表达来抑制细胞凋亡。但是,MT是否是同时调控热休克蛋白和细胞凋亡相关基因的表达还是调控热休克蛋白和细胞凋亡相关基因的表达之间存在先后顺序,需要进一步深入的研究。
3.4 MT对热应激下淋巴细胞内p50基因表达的影响
在哺乳动物中,NF-κB主要由5个相关的转录因子(p65、p 50、p 52、Rel B和c-Rel)之间形成同源或异源二聚体组成的,研究最多的是p50/p65二聚体。据报道,活化的NF-κB对多种与细胞凋亡相关的基因具有转录调节作用,对细胞凋亡具有抑制和促进的作用[34]。NF-κB抑制细胞凋亡是一种多个信号通路转导的过程,通过转导激活IEX-IL、Bcl-2家族等提高机体的抗细胞凋亡的作用[35]。夏钰弘等[36]研究结果表明,NF-κB可能通过抑制Caspase-3的活性进而抑制肝癌细胞凋亡。然而,也有报道称,NF-κB对细胞的凋亡有促进的作用。研究发现,黑色素瘤细胞在紫外线诱导下会因NF-κB的活化而导致细胞凋亡;在H2O2的诱导下,活化的NF-κB能使T细胞发生细胞凋亡[37-38]。另外还发现,活化的NF-κB能够通过抑制抗凋亡基因的表达进而促进细胞凋亡[39]。之前研究结果表明,添加Zn-MT能够提高淋巴细胞Bcl-2基因的表达量,降低Bax基因的表达量,抑制细胞的凋亡。而研究Zn-MT对淋巴细胞p 50基因表达的影响,发现在热应激下,与对照组相比,添加Zn-MT组的奶牛淋巴细胞内的p50基因表达量下降。出现这种现象可能原因如下:在正常情况下,NF-κB由于与其抑制蛋白(IκB)相结合而无活性。当淋巴细胞受到热应激时,促使IκB磷酸化,导致NF-κB激活。研究已发现,NF-κB对细胞凋亡有双向作用,激活的NF-κB具有促进细胞凋亡的作用,因此,本试验的结果说明,MT可能通过抑制p50基因的表达,抑制IκB磷酸化,降低NF-κB的活性,从而降低NF-κB抑制抗凋亡基因的表达,抑制淋巴细胞的凋亡。
在热应激下,添加外源MT能够提高奶牛淋巴细胞的存活率,降低淋巴细胞的凋亡率;提高淋巴细胞内的CAT活性、SOD活性和GSH-Px活性,降低MDA含量,促进淋巴细胞的抗氧化性能;提高淋巴细胞内的Bcl-2基因的表达量,降低Bax基因和p 50基因的表达量,从而抑制淋巴细胞的凋亡。从本试验的结果上看,添加终浓度为70μg/m L的MT抑制热应激下体外培养奶牛淋巴细胞凋亡的效果最好。
