肾上腺素对抗双黄连中药注射剂所致心律失常
2014-11-12李雪华罗卓卡陈可塑王中越
刘 磊,李雪华,王 伟,罗卓卡,陈可塑,王中越,陈 龙,
(1.南京中医药大学科技部规范化中药药理实验室,江苏南京 210046;2.常州市第四人民医院,江苏常州213032;3.南京大学金陵学院,江苏南京 210089;4.泰州中国医药城中医药研究院,江苏泰州 225300)
双黄连中药注射剂(Shuang-huang-lian Injection,SHL)由金银花、黄芩、连翘组成,临床上用于病毒及细菌感染引起的上呼吸道感染,肺炎,扁桃体炎及咽炎等。临床广泛使用后,其不良反应报道也逐年增加,严重者导致死亡[1]。基于其不良反应机制为过敏反应的理论[2-4],临床上常使用抗过敏反应的药物抢救双黄连中药注射液出现的致命性不良反应,如β肾上腺素受体激动剂(肾上腺素),糖皮质激素和 H1受体拮抗剂(异丙嗪)[5-6]。然而,近年来的临床[7-8]及基础研究报道[9-10],双黄连中药注射剂能够导致缓慢性心律失常。同时有研究表明,H1受体拮抗剂异丙嗪加重双黄连的心律失常,应禁止使用异丙嗪[11-12]。本研究用实验证明肾上腺素具有对抗双黄连的致心律失常作用。
1 材料与方法
1.1 试剂及主要仪器
注射用SHL(冻干)(规格:每支600 mg,批号:1210019,哈药集团中药二厂提供),盐酸肾上腺素(规格:每支1 g·L-1,批号:120507,上海禾丰制药有限公司提供)。RM-6240D型四道生理记录仪,SWF-2W型微电极放大器(成都仪器厂);膜片钳放大器(Axon instruments 200B,USA);数字-信号转换器(Digidata 1322A美国Axon公司)。
1.2 动物
豚鼠体质量250~300 g,雌雄不拘。由南京中医药大学实验动物中心提供(实验动物生产许可证:SCXK(苏)2012-0008;实验动物使用许可证:SYXK(苏)2011-0053。
1.3 注射用双黄连和肾上腺素剂量及浓度的计算
(1)在体实验剂量的换算:人体与动物用量的转化是按体表面积系数计算,按每公斤体质量进行比较,豚鼠为人的4.6倍[13]。临床上SHL用量为60 mg·kg-1,换算到豚鼠为 276 mg·kg-1(1 倍临床剂量),10倍临床剂量为2760 mg·kg-1;临床上肾上腺素(盐酸盐)成人极量为皮下注射1 mg,按照正常成人体质量为60 kg计算,成人最大剂量为0.017 mg·kg-1,换算到豚鼠为 0.078 mg·kg-1(1倍临床剂量)。
(2)离体实验浓度的换算:人的细胞外液大约为 200 mL·kg-1(约为20%),临床上 SHL用量为60 mg·kg-1,换 算 到 临 床 上 血 液 的 浓 度 为0.3 g·L-1,因此,实验的组织和细胞灌流液1 倍临床SHL浓度为0.3 g·L-1。临床上肾上腺素(盐酸盐)成人极量为皮下注射1 mg,按照正常成人体质量为60kg计算,人的细胞外液大约为200 mL·kg-1(约为 20%),1 倍临床肾上腺素(盐酸盐)的浓度为0.083 mg·L-1。
1.4 在体实验
豚鼠ip给予20%乌拉坦(5 mL·kg-1)行腹腔注射麻醉,仰卧位固定,分离出颈外静脉,针形电极引导记录Ⅱ导联心电图,经四道生理记录仪采样并存入计算机。
首先,将溶于生理盐水的SHL在5 min内以276 mg·kg-1(1 倍临床剂量)→2760 mg·kg-1(10倍临床剂量)的顺序进行累计静脉缓慢推注,注射后稳定5 min。出现缓慢性心律失常后,顺序给予溶于生理盐水的肾上腺素0.0078 mg·kg-1(1/10临床剂量)和 0.039 mg·kg-1(1/2临床剂量)。于静脉推肾上腺素5 min后记录心电图,分析心率(HR)、P-R 间 期、QTc 间 期。QTc=QT ×(1000)1/3/RR1/3(单位为 ms)[14]。
1.5 离体实验
1.5.1 离体心电图记录
豚鼠ip给予20%乌拉坦(5 mg·kg-1)麻醉,开胸取心,置于0~4℃的无钙灌流液中使之停搏,修剪分离主动脉,行主动脉插管后,结扎固定。采用Langendorf装置,在37℃恒温、充氧(95%O2+5%CO2)条件下,灌流液持续进行逆向灌流,调整流速约为4 mL·min-1,使心脏复跳。同时将3个电极分别置于心尖、右心室游离壁,主动脉根部,引导离体心脏的心电图,经四道生理记录仪采样并存入计算机。
首先按顺序灌流SHL 0.3 g·L-1(1倍临床浓度)→1.5 g·L-1(5 倍临床浓度),诱发缓慢性心律失常后,再灌流 SHL 1.5 g·L-1+ 肾上腺素0.42 mg·L-1(5 倍 临 床 浓 度),最 后 用 SHL 1.5 g·L-1和灌流液依次洗脱。上一浓度灌流结束后随后灌流下一浓度,每一组灌流持续5 min,分别记录各浓度组给药5 min后的心电图。分析HR,P-R,QRS和QTc间期。
心脏灌流液成分如下(mmol·L-1):NaCl 117,KCl 5.7,CaCl21.8,MgCl21.7,NaHCO34.4,NaH2PO41.5,HEPES 20,葡萄糖11,用 NaOH调pH 至7.3。
1.5.2 单个心室肌细胞的分离
按改良的酶解法分离豚鼠单个左心室肌细胞。动物麻醉及离体心脏灌流同上,经主动脉用含95%O2及5%CO2灌流液逆行灌流。用无钙灌流液(37℃)冲洗并使心脏停跳。用含胶原酶Ⅰ型及胰蛋白酶(2及0.1 g·L-1)的无钙灌流液反复灌流5~8 min,至心脏膨大、松弛。取下心脏,将左心室肌组织块置于盛有无钙灌流液中充分剪碎,用直径200 μm 的尼龙网过滤,逐步加钙至2 mmol·L-1,置于室温下备用。灌流液的组成为(mmol·L-1):NaCl 117,KCl 5.7,NaHCO34.4,NaH2PO41.5,MgCl21.7,HEPES 20,葡萄糖 20,牛磺酸 10。用NaOH调节pH至7.3。
1.5.3 动作电位的记录
采用膜片钳全细胞电流钳法,在室温(20~22℃)下进行。用细胞外液灌流,其组成为 (mmol·L-1):NaCl 117,KCl 5.7,NaHCO34.4,MgCl21.7,CaCl21.8,HEPES 20,葡萄糖20,牛磺酸20(NaOH调至pH 7.3)。充灌内液的电极入水阻抗约为 2 ~5 MΩ,电极内液为 (mmol·L-1):KCl 135,EGTA 10,HEPES 10,葡萄糖5,K2ATP 3,Tris-GTP 0.5(KOH 调至 pH 7.1)。在电流钳模式下,调节电流刺激强度,使用能产生完好动作电位的最小电流刺激强度(通常为2~5 nA,100~200 ms),信号的发放和采集均由pClamp 9.0软件完成,并将数据存储于硬盘内。依次灌流SHL 0.3 g·L-1→1.5 g·L-1→3 g·L-1→SHL 3 g·L-1+ 肾上腺素0.83 mg·L-1(10 倍临床浓度),分别记录各浓度组给药5 min后的动作电位。分析动作电位复极于50%及90%水平的时程(APD50及APD90)。
1.6 统计学分析
2 结果
2.1 肾上腺素对双黄连诱发的豚鼠在体心律失常的影响
图1和表1的结果显示,SHL 2760 mg·kg-1(10倍临床剂量)能明显降低豚鼠HR,延长P-R和QRS 间 期 (P<0.05)。 而 给 予 肾 上 腺 素0.0078 mg·kg-1(1/10 临床剂量)和0.039 mg·kg-1(1/2临床剂量)则分别不同程度地提高了 SHL 2760 mg·kg-1临床剂量所致的缓慢心率,同时,明显改善 SHL 2760 mg·kg-1临床剂量引起的 P-R,QRS间期的延长(P<0.05)。
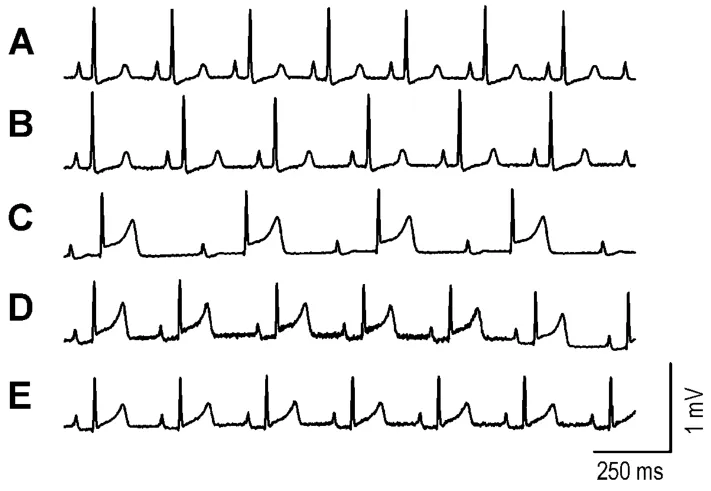
Fig.1 Representative traces of ECG before and after administration of Shuanghuanglian Injection(SHL)alone or SHL combined with adrenaline(Adr)in guinea pigs.A:before adminstration;B:SHL 276 mg·kg -1;C:SHL 2760 mg·kg -1;D:SHL 2760 mg·kg -1+Adr 0.0078 mg·kg -1;E:SHL 2760 mg·kg -1+Adr 0.039 mg·kg -1.
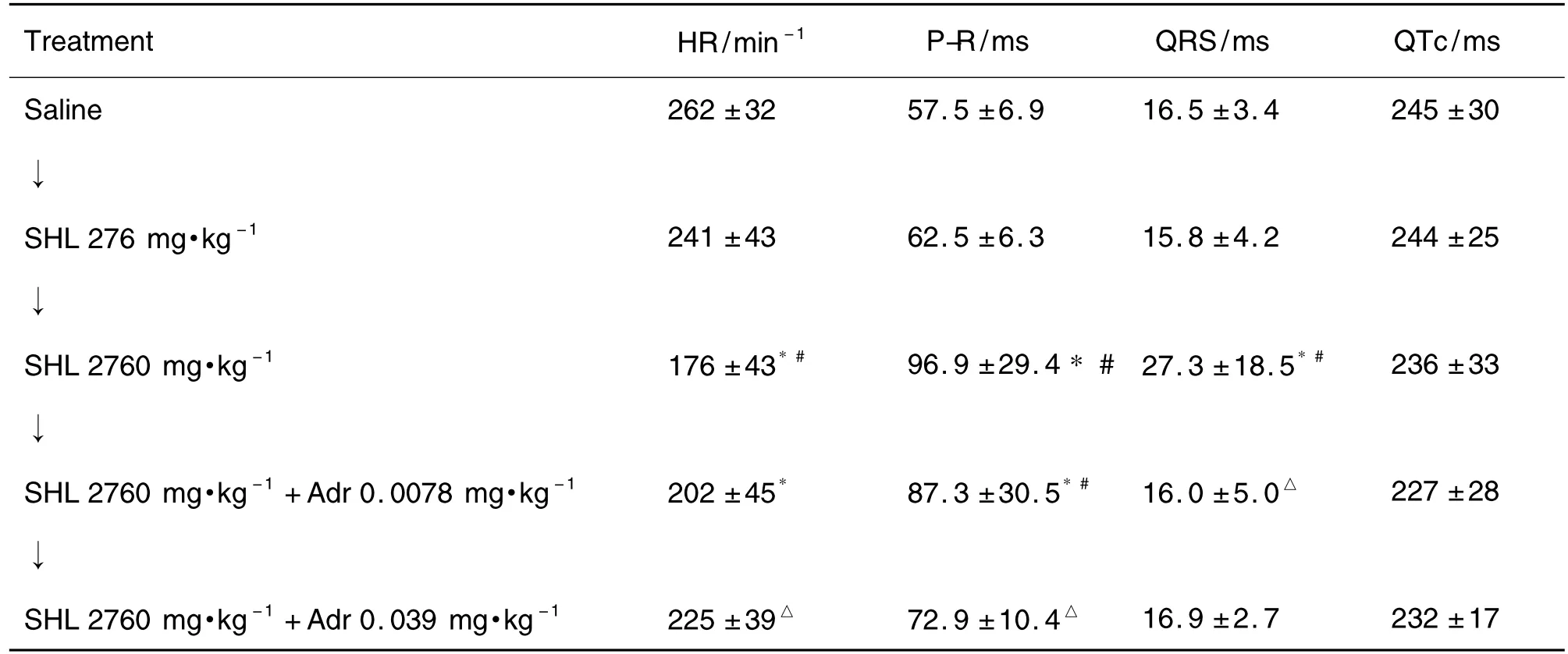
Tab.1 Effects of SHL alone and SHL plus Adr on heart rate(HR),P-R,QRS and QTc intervals in anesthetized guinea pig hearts in vivo
2.2 肾上腺素对双黄连诱发的豚鼠离体心律失常的影响
图2和表2的结果显示,SHL 1.5 g·L-1(5 倍临床剂量)能明显减慢 HR(P <0.05)。SHL 1.5 g·L-1(5倍临床剂量)+肾上腺素0.42 mg·L-1(5倍临床剂量)能明显加快SHL 1.5 g·L-1所致的缓慢心率(P <0.05),同时明显缩短 QTc(P <0.05)。SHL 1.5 g·L-1(5倍临床剂量)进行洗脱,可明显减慢心率,并延长QTc(P<0.05)。最后用灌流液进行洗脱,各参数基本能恢复至给药前的水平。

Fig.2 Representative traces of ECG before and after perfusion of SHL alone or combined with Adr in isolated guinea pig hearts.A:before drug perfusion;B:after SHL 0.3 g·L -1perfusion;C:after SHL 1.5 g·L -1perfusion;D:after SHL 1.5 g·L -1+Adr 0.42 mg·L -1perfusion;E:after SHL 1.5 g·L-1 washout;F:after washout.

Tab.2 Effect of SHL alone or SHL combined with Adr on HR,P-R,QRS and QTc intervals in isolated guinea pig hearts
2.3 肾上腺素对SHL作用的豚鼠心肌细胞动作电位的影响
表3及图3显示,SHL 3 g·L-1(10倍临床剂量)显著延长电位复极于50%及90%水平的时程(APD50及 APD90)(P < 0.05),SHL 3 g·L-1(10倍临床浓度)+肾上腺素0.83 mg·L-1(10倍临床浓度)明显缩短已延长的APD50或APD90(P<0.05),接近于正常对照水平。

Tab.3 Effect of SHL alone or SHL combined with Adr on action potential durations at 50%(APD50)or APD90in cardiomyocytes from guinea pig hearts

Fig.3 Representative traces of action potentials before and after perfusion of SHL alone or combined with Adr from cardiomyocytes of left ventricles of guinea pigs.
3 讨论
本研究结果表明,在体豚鼠心电图实验显示,SHL 10倍临床剂量(2760 mg·kg-1)能明显减慢豚鼠心率,延长P-R,QRS间期;1/10倍临床剂量的肾上腺素(0.0078 mg·kg-1)和1/2倍临床剂量的肾上腺素(0.039 mg·kg-1)能不同程度地对抗SHL的上述作用。离体豚鼠心电图实验显示,5倍临床浓度SHL 1.5 g·L-1显著减慢豚鼠心率并延长P-R 间期,5 倍临床浓度肾上腺素(0.42 mg·L-1)明显对抗SHL的上述作用,并能缩短QRS间期。豚鼠心室肌细胞动作电位实验表明,10倍临床浓度SHL(3 g·L-1)显著延长 APD50及 APD90,而 10 倍临床浓度肾上腺素(0.83 mg·L-1)明显缩短APD50及APD90,对抗双黄连的延长作用。
本课题组前期研究也表明,SHL能通过抑制hNav1.5,L 型 Ca2+及 hERG 电流[10]降低豚鼠心率,延长P-R、QRS和QTc间期。而肾上腺素能增加 Na+[15]、L 型 Ca2+[16]、Ikr[17-18]及 Iks[19-20]电流,缩短豚鼠心肌细胞的动作电位时程,能有效地对抗SHL引起的缓慢性心律失常。
因此,临床上当SHL引发严重不良反应又无法判断其发生机制时,应采用肾上腺素抢救,既可以对抗其可能的过敏反应,又可以对抗其可能的缓慢性心律失常。
[1]Wang DC,Zhang L,Li AZ.Document analysis of 39 death cases induced by traditional Chinese medicine injection[J].Chin J Pharmacoepidemiol(药物流行病学杂志),2004,13(2):77-80.
[2]Zhang LP.Analysis of adverse reactions of TCM injections[J].Chin J Clin Rational Drug Use(临床合理用药),2011,4(10A):83-84.
[3]Chen Y.Analysis of adverse reactions of TCM injections and their rational use[J].China Mod Doctor(中国现代医生),2011,49(1):6-7.
[4]Li TQ.Avoiding adverse drug reactions to Chinese medicine injections[J].Chin J Evid-based Med(中国循证医学杂志),2010,10(2):111-115.
[5]Zhang SQ.Analysis of clinical applications of SHL injection[J].J Changchun Univ Tradit Chin Med(长春中医药大学学报),2012,28(1):127-128.
[6]Wang LN.Analysis of 66 cases of allergic shock caused by Shuanghuanglian injection[J].Eval Anal Drug-Use Hosp China(中国医院用药评价与分析),2010,10(4):368-370.
[7]Du DC,Shen AZ,Jiang L.Analysis of adverse reaction time of traditional Chinese medicine injection[J].Chin Hosp Pharm J(中国医院药学杂志),2011,31(10):864-866.
[8]Tang CY,Zeng LW,Lin H,Qin ZB.Analysis on ADR/ADE reports induced by Shuanghuanglian injection in Guangxi of 2009[J].China Pharm(中国药房),2010,21(16):1501-1504.
[9]Shi Z,Xu Y,Zhou SY,Peng GP,Chen L.Electrophysiological effects of Shuang-huang-lian intravenous injection on guinea pig hearts[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2010,24(6):455-459.
[10]Chen L,Titch T,Luo Z,Xu Y,Li X,Huang F,et al.Confirmation of a proarrhythmic risk underlying the clinical use of common Chinese herbal intravenous injections[J].J Ethnopharmacol,2012,142(3):829-835.
[11]Li XH, Luo ZK, Liu L, Sheng XB,Wang ZY,Chen L.Promethazine aggravates arrhythmia induced by Qing-kai-ling injection[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(4):691-697.
[12]Luo ZK, Li XH, Liu L, Sheng XB,Wang ZY,Chen L.Promethazineaggravatesproarrhythmia effect induced by Chinese herbal intravenous injection of Shuanghuanglian[J].Chin J New Drugs Clin Rem(中国新药与临床杂志),2013,32(3):217-221.
[13]Reagan-Shaw S,Nihal M,Ahmad N.Dose translation from animal to human studies revisited[J].FASEB J,2008,22(3):659-661.
[14]Li J,Qu LH,Jiang HL,Kiorpes A,Xu J.Anesthetic guinea pig model for QT interval prolongation evaluation[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2010,24(2):146-149.
[15]Wang HW,Yang ZF,Zhang Y,Yang JM,Liu YM,Li CZ.Beta-receptor activation increases sodium current in guinea pig heart[J].Acta Pharmacol Sin,2009,30(8):1115-1122.
[16]Skeberdis VA,Jurevicius J,Fischmeister AR.Beta-2 adrenergic activation of L-type Ca2+current in cardiac myocytes[J].J Pharmacol Exp Ther,1997,283(2):452-461.
[17]Heath BM,Terrar DA.Protein kinase C enhances the rapidly activating delayed rectifier potassium current,IKr,through a reduction in C-type inactivation in guinea-pig ventricular myocytes[J].J Physiol,2000,522(Pt 3):391-402.
[18]Harmati G,Bányász T,Bárándi L,Szentandrássy N,Horváth B,Szabó G,et al.Effects of β-adrenoceptor stimulation on delayed rectifier K+currents in canine ventricular cardiomyocytes[J].Br J Pharmacol,2011,162(4):890-896.
[19]Szentandrássy N,Farkas V,Bárándi L,Hegyi B,Ruzsnavszky F,Horváth B,et al.Role of action potential configuration and the contribution of Ca2+and K+currents to isoprenaline-induced changes in canine ventricular cells [J]. Br J Pharmacol,2012,167(3):599-611.
[20]Stengl M,Volders PG,Thomsen MB,Spätjens RL,Sipido KR,Vos MA.Accumulation of slowly activating delayed rectifier potassium current(IKs)in canine ventricular myocytes[J].J Physiol,2003,551(Pt 3):777-786.
