弓形虫分泌蛋白ROP2的原核重组表达与免疫反应性鉴定*
2014-11-10黄敏君洪彩玲杨英超甘绍伯谷俊朝
薛 峰 黄敏君 洪彩玲 杨英超 甘绍伯 谷俊朝
(1.首都医科大学附属北京友谊医院,北京热带医学研究所,北京 100050; 2.热带病防治研究北京市重点实验室,北京 100050; 3. 中国食品药品检定研究院,生物制品检定所,寄生虫疫苗室,北京 100050)
刚地弓形虫Toxoplasmagondii是细胞内寄生原虫,可引起人兽共患弓形虫病。我国人群平均感染率为4.0%~9.0%,孕妇感染率高达6.6%~32.9%(谷俊朝和甘绍伯,2008)。孕妇弓形虫病可引发胎儿先天感染,导致流产、死胎、畸形、智力障碍等(Weissetal., 2009)。免疫力低下的病人,如器官移植和AIDS患者等,感染后可导致严重脑炎。弓形虫感染早期临床症状不明显且特异性差,尚未有特异有效的药物,所以及时准确的诊断方法和有效的疫苗对于该病防控和治疗尤为重要(甘绍伯,2001)。目前,筛选免疫反应性较强的抗原并应用于改进免疫学诊断方法和疫苗研制仍是研究热点(卢致民和张进顺,2011)。
棒状体蛋白(Rhoptry protein)是弓形虫主要分泌抗原之一,在弓形虫侵入宿主细胞时经虫体前端棒状体释放,参与纳虫泡(Parasitophorous vacuole,PV)形成和维稳(Sibley, 2004)。我们先前通过生物素标记技术结合蛋白质组学方法研究表明,ROP2蛋白是弓形虫速殖子表达量最高的分泌蛋白(刘媛等,2013)。ROP2同源基因构成一个较大的基因家族,包括ROP2、ROP4、ROP5、ROP7、ROP8、ROP18等棒状体蛋白基因(El Hajjetal., 2006)。该家族蛋白在弓形虫入侵宿主细胞早期均能分泌至纳虫泡膜(Parasitophorous vacuole membrane,PVM)。基因敲除或沉默研究表明,ROP2家族蛋白大多是弓形虫重要的入侵和毒力作用因子,且往往具有酶活性(Sinaietal., 2001; Nakaaretal., 2003; Weilhammeretal., 2011)。另外,ROP2家族蛋白具有良好的免疫反应性和免疫保护性,对改进免疫学诊断方法和研制亚单位重组疫苗具有重要意义(Labesseetal., 2009; Gatkowskaetal., 2010)。
本研究克隆了弓形虫RH株ROP2基因,构建了全基因原核表达载体,在大肠杆菌工程菌中诱导表达了含GST和6×His标签的融合重组蛋白,并采用免疫印迹实验初步评价了rROP2的免疫反应性,为进一步研究基于弓形虫棒状体蛋白的免疫诊断方法,以及分泌蛋白与宿主细胞的相互作用奠定了基础。
1 材料与方法
1.1 材料
1.1.1弓形虫株系: 国际标准强毒株刚地弓形虫RH株,由中国农业大学国家动物寄生原虫实验室惠赠。本实验室绿猴肾Vero细胞体外传代速殖子保种。
1.1.2宿主细胞系: 非洲绿猴肾Vero细胞,购自中国协和医科大学基础医学研究所基础医学细胞中心。
1.1.3载体和工程菌株: pET-41 Ek/LIC快速连接原核表达试剂盒购于Novagen公司,大肠杆菌NovaBlue测序菌株和RosettaTM(DE3) pLysS 工程菌株感受态由本实验室制备。
1.1.4酶和相关试剂: DMEM培养基、胎牛血清、Trizol试剂、Superscript III 逆转录酶购自Invitrogen公司。质粒提取试剂盒、EX-Taq 高保真DNA聚合酶、pd(N)9逆转录随机引物购自大连TaKaRa公司。ProteinaShow-G250蛋白快速染色试剂、高灵敏度化学发光检测试剂盒、琼脂糖凝胶回收试剂盒、IPTG、Western Midview Western中分子量蛋白Marker、以及BCA蛋白定量试剂盒购自北京康为世纪生物技术有限公司。Anti-6×His tag小鼠单抗、Goat anti-Mouse IgG (H+L) HRP和Goat anti-Human IgG (H+L) HRP购自Abcam公司。蛋白酶抑制剂购自Amresco公司,层析柱、Ni-NTA琼脂糖凝胶等购自上海源叶生物技术有限公司。弓形虫IgG抗体检测试剂盒(酶联免疫法,内含标准人源弓形虫混合抗血清)购自珠海海泰生物制药有限公司。其他化学试剂为国产分析纯。
1.2 方法
1.2.1弓形虫速殖子体外培养: 用含8%胎牛血清的DMEM培养基培养Vero细胞,传代6 h后接种弓形虫速殖子(速殖子:宿主细胞=1:1),4 d后收集纯化弓形虫,约1×109个虫体采用Trizol方法提取总RNA。
1.2.2引物设计与合成: 根据Uniprot数据库公布的弓形虫ROP2基因序列(Q27007,B9QMZ1等)全长,设计一对特异性引物,用以克隆ROP2基因全长。
上游引物P1: 5′-GACGACGACAAGATGG-AAAACTGTGCGTCGGTCAGA-3′,下游引物P2: 5′-GAGGAGAAGCCCGGTCATGCCGGTTCTCCAT-CAGTTTG-3′。其中下划线部分为载体重组序列,其余部分为ROP2基因特异性序列。引物由北京赛百盛基因技术有限公司合成。
1.2.3生物信息学分析: 序列处理、蛋白二级结构预测、亲水性预测、抗原表位预测等分析分别采用DNAStar软件包中的Editseq和Protean软件。蛋白跨膜结构域预测采用TMpred在线分析软件。信号肽预测采用SignalP-4.1在线分析软件。
1.2.4逆转录与基因克隆: 使用Trizol试剂提取弓形虫总RNA,以TaKaRa pd(N)9随机引物逆转录合成cDNA,以特异性引物进行PCR扩增。PCR反应条件为:94 ℃ 预变性3 min;94 ℃ 变性30 s,58 ℃ 退火30 s,72 ℃ 延伸2 min,进行30个循环;最后72 ℃延伸10 min。取5 μL PCR产物。于1 %琼脂糖凝胶中电泳。采用QIAquick Gel DNA Extraction Kit纯化回收PCR产物。
1.2.5表达质粒的构建与鉴定: 将纯化后的PCR产物与pET-41 Ek/LIC载体于22 ℃重组连接, 按常规方法转化至感受态大肠杆菌NovaBlue测序菌株,置于不含抗生素的SOC培养基中37 ℃振荡1 h,将菌体平铺含卡那霉素(30 μg/mL)的LB平板,挑取10个单菌落,培养后提取质粒后将其转入大肠杆菌RosettaTM(DE3) pLysS重组表达菌株中。挑取单个菌落,以RT-PCR扩增引物进行菌落PCR鉴定,保存阳性克隆,并将质粒送上海生工公司,采用载体通用测序引物进行测序鉴定。
1.2.6重组蛋白诱导表达与鉴定: 在37 ℃,300 r/min摇培养菌至OD600=0.6时,加入IPTG至终浓度为1 mmol/L,诱导表达6 h后离心收集菌体,裂解后进行SDS-PAGE 电泳。阳性克隆扩大至500 mL,诱导表达6 h后裂解并超声粉碎,Ni-NTA凝胶柱进行纯化。纯化后的蛋白进行SDS-PAGE电泳,查看纯化效果,并采用BCA法进行蛋白定量。进一步采用6×His标签单抗进行Western blotting鉴定。一抗6×His标签单抗稀释度为1:2500,二抗HRP标记的山羊抗小鼠IgG稀释度为1∶2000,ECL化学发光法曝光。
1.2.7鉴定重组蛋白免疫反应性: 珠海海泰生物制药有限公司生产的弓形虫IgG抗体检测试剂盒(酶联免疫法)备有一份标准人源弓形虫混合抗血清阳性对照,为多份确诊弓形虫病患者血清的混合稀释样品。本研究以该抗血清为一抗,1∶20倍稀释孵育,二抗HRP标记的山羊抗人IgG稀释度为1∶2000,采用Western blotting免疫印迹评价rROP2免疫反应性。
2 结果
2.1 RT-PCR结果与质粒构建
本研究扩增DNA片段长度为1 713 bp(含上下游核酸重组序列30 bp),其中ROP2基因全长1 683 bp。PCR产物经1%琼脂糖凝胶电泳,分子量大小与预期值相符(图1)。DNA片段与pET-41 Ek/LIC载体重组连接后转化大肠杆菌NovaBlue测序菌株涂板。阳性克隆的菌落PCR 显示,扩增DNA 片段与预期片段大小一致, 说明重组质粒含有目的基因(图略)。
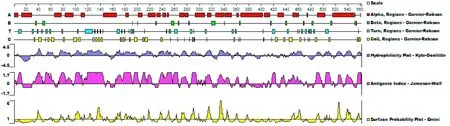
图2 ROP2蛋白二级结构、亲水性、抗原表位和蛋白表面结构域预测Fig. 2 Prediction of secondary structure, hydrophilicity, antigenic index, and surface plot of the ROP2 protein
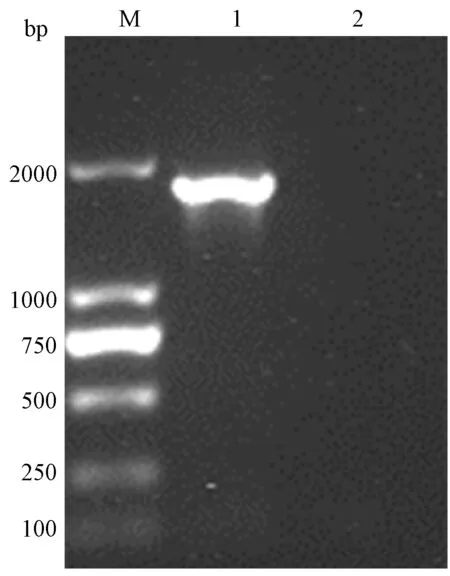
图1 采用RT-PCR克隆ROP2基因的结果Fig. 1 RT-PCR amplification of ROP2 geneM:DNA分子量DL2000;1:ROP2 基因RT-PCR产物;2:空白对照。M: DNA marker DL2000; 1: RT-PCR product of ROP2 gene; 2: Blank control.
2.2 测序验证与序列分析
将2个阳性质粒送上海生工公司以载体通用测序引物进行测序,测序结果显示,克隆的靶基因序列长度为1 713 bp,含有完整的ROP2开放阅读框(1 683 bp,编码561个氨基酸,序列与NCBI-GenBank公布序列相符。DNAStar软件包中Protean蛋白序列分析表明,ROP2蛋白二级结构以alpha螺旋为主,亲水性结构域多于疏水性结构域,蛋白表面结构域多于内部结构域,且抗原表位占蛋白序列的比例较高,应该具有较好的免疫反应性(图2)。另外,TMpred跨膜蛋白结构域预测表明,ROP2蛋白在前段和后段分别含有2个跨膜结构域(12-29,445-465)(图略)。SignalP 4.1信号肽预测表明,ROP2蛋白前段26个氨基酸为信号肽序列(图略)。
2.3 重组蛋白电泳诱导表达
目的重组蛋白经IPTG诱导表达后采用SDS-PAGE电泳进行初步验证,考马斯亮蓝-G250染色结果如图3所示。诱导表达的目的蛋白与与预期分子量(约98 kDa)相符。其中,ROP2蛋白相对分子质量为64 kDa,前端融合1个GST标签和1个6×HIS标签约34 kDa。
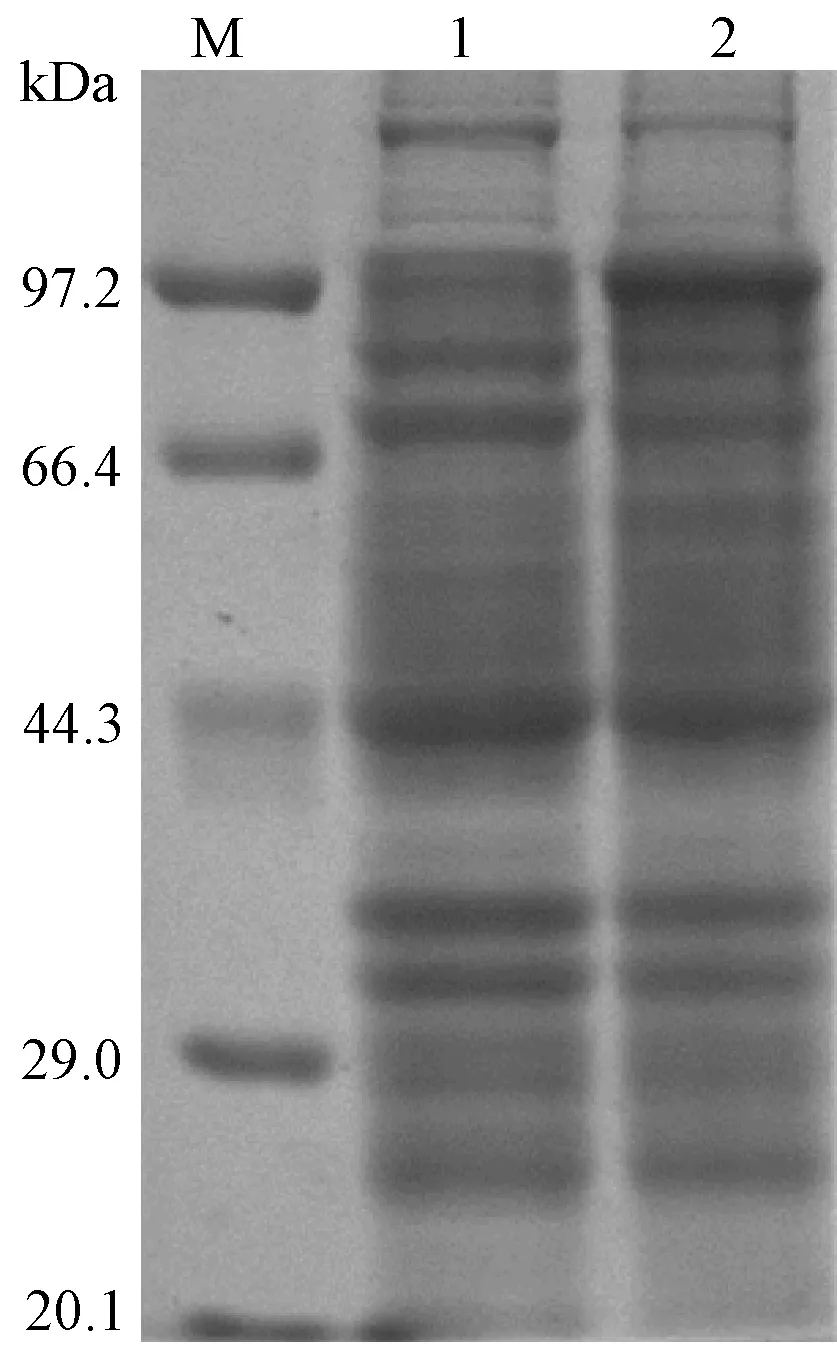
图3 ROP2重组融合蛋白SDS-PAGE电泳检测结果Fig. 3 SDS-PAGE analysis of ROP2 recombinant fusion proteinM:低分子量蛋白标准分子量;1:IPTG未诱导的重组大肠杆菌; 2:IPTG诱导6 h后ROP2融合蛋白表达。M: Protein low molecular weight marker; 1: Protein profile not induced by IPTG; 2. ROP2 fusion protein expressed after 6 h induction by IPTG.
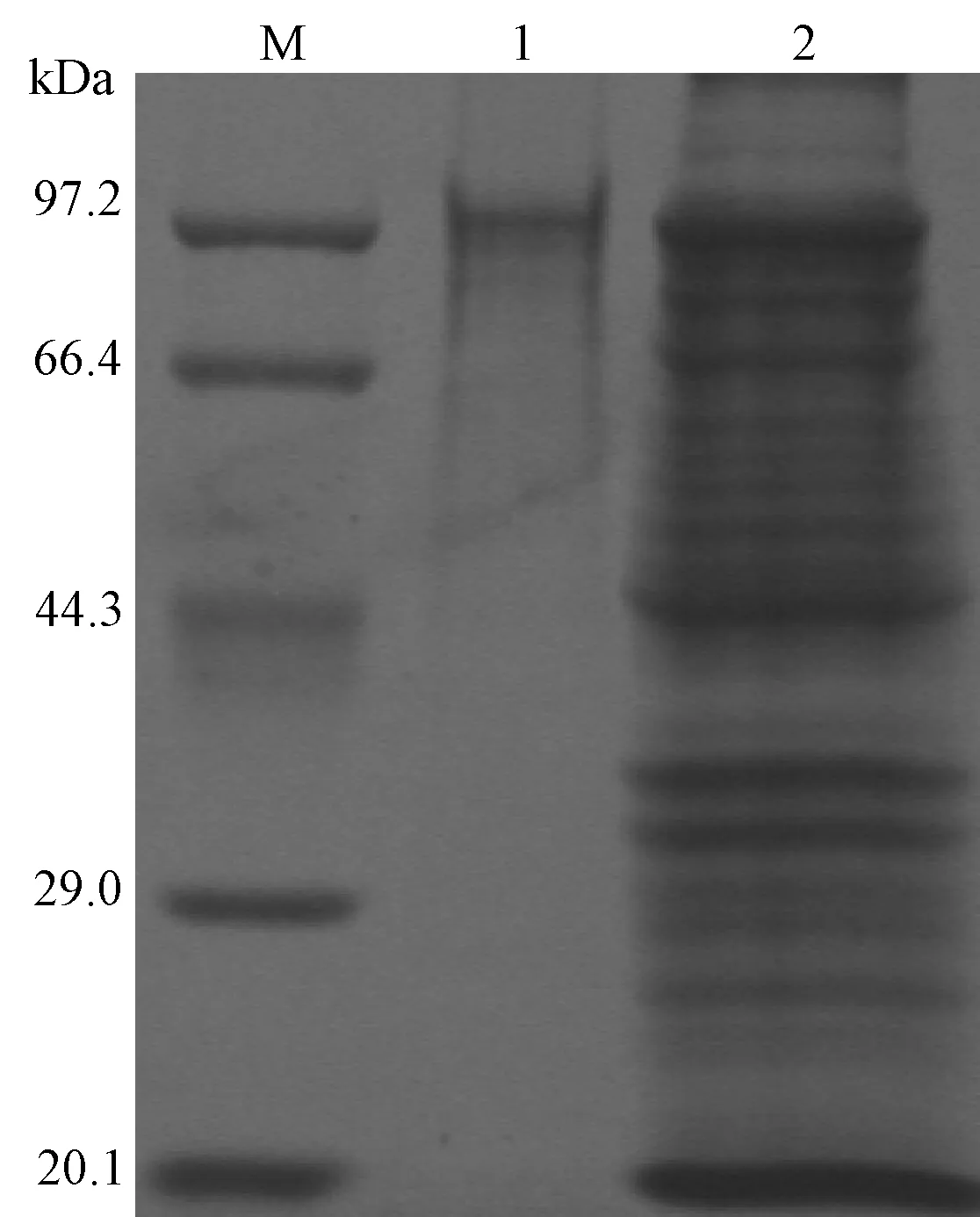
图4 ROP2重组融合蛋白Ni-NTA琼脂糖凝胶纯化效果Fig 4 Purification of recombinant ROP2 fusion protein using Ni-NTAM:低分子量蛋白标准分子量;1: 纯化后的ROP2重组融合蛋白;2: 未纯化的ROP2重组蛋白对照。M: Protein low molecular weight marker; 1: Purified rROP2 fusion protein; 2: Unpurified rROP2 protein control.

图5 ROP2重组融合蛋白的Western blotting鉴定Fig. 5 Verification of the recombinant ROP2 fusion protein using Western blotting.M:蛋白标准分子量;1: ROP2重组融合蛋白。M: Protein weight marker; 1: ROP2 recombinant fusion protein.
2.4 目的蛋白纯化与Western blotting鉴定
采用Ni-NTA琼脂糖凝胶柱纯化目的重组蛋白,并以SDS-PAGE电泳初步检测。结果显示98 kDa目的蛋白回收效率较高,纯化效果较好(图4)。Ni-NTA琼脂糖凝胶柱纯化后的ROP2重组融合蛋白经电泳转膜后,用小鼠6×His单抗进行Western blotting 鉴定。结果显示98kDa特异性蛋白条带,证明该目的蛋白为6×His 融合蛋白(图5)。
2.5 重组蛋白免疫反应性初步鉴定
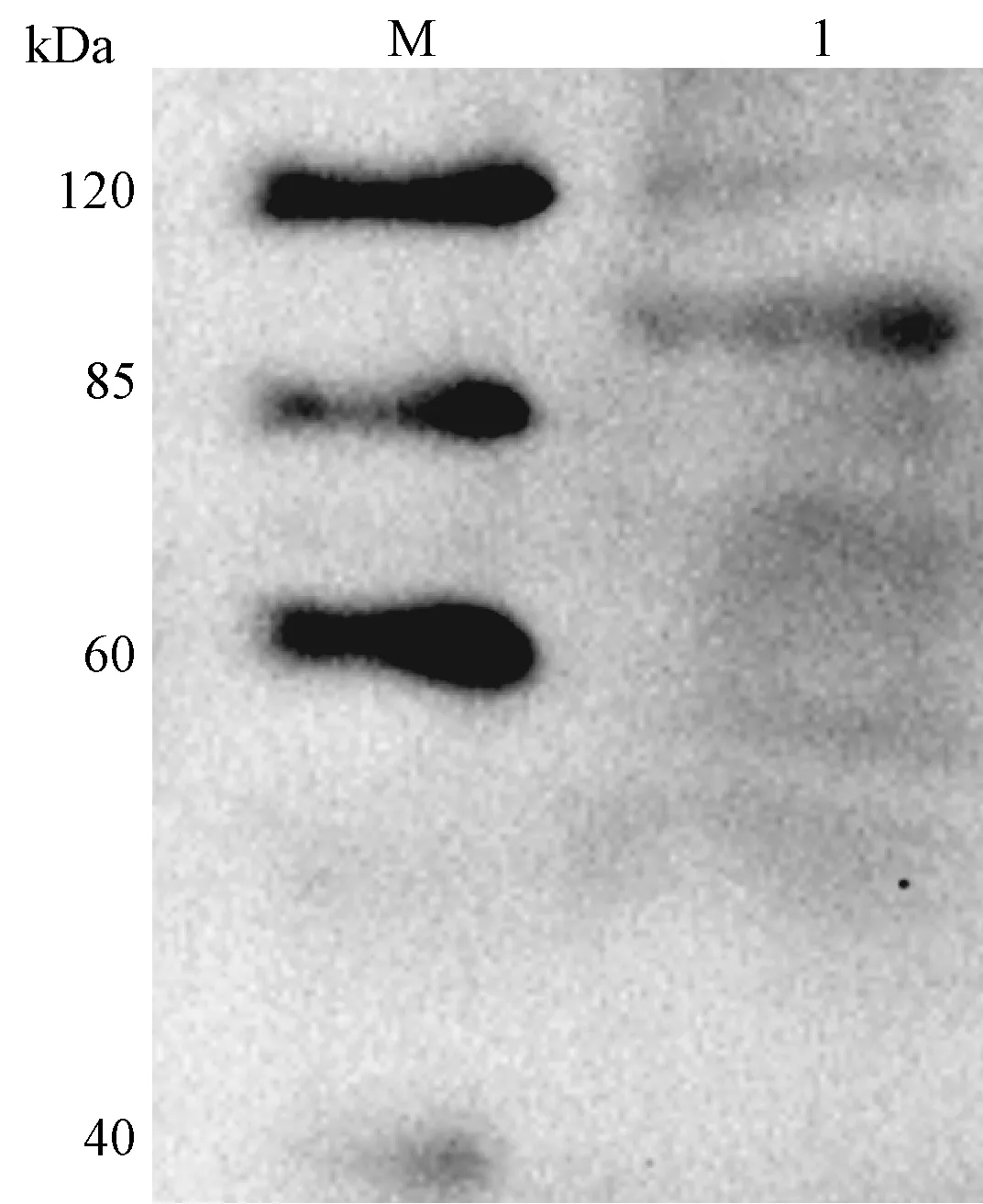
图6 ROP2重组融合蛋白与人源免疫抗血清的免疫反应Fig. 6 Immunological reaction between rROP2 and human anti-T. gondii serumM:蛋白标准分子量; 1: ROP2重组融合蛋白。M: Protein weight marker; 1: ROP2 recombinant fusion protein.
以rROP2重组蛋白为抗原,以标准人源弓形虫感染混合血清为一抗,Western-blotting免疫印迹实验结果表明,尽管来源于弓形虫病现症患者的人源抗血清背景复杂,但98 kDa的rROP2重组蛋白与抗血清有显著免疫印迹反应。(图6)。
3 讨论
弓形虫棒状体蛋白2(ROP2)的编码基因全长约1.7 kb,第98~465位氨基酸序列中富含脯氨酸。ROP2蛋白存在翻译后加工,由66 kDa蛋白切除信号肽和70多个氨基酸序列后仅剩余55 kDa。ROP2蛋白是弓形虫毒力因子,参与调节纳虫泡膜功能调节,且能与宿主乳铁蛋白互作,可能有助于弓形虫获取生长必需的铁元素。另外,ROP2与宿主线粒体和内质网均有显著相互作用,可能广泛参与弓形虫的物质和能量获取和代谢过程。
本研究通过RT-PCR克隆ROP2基因全长,并原核表达了GST-6×His-ROP2重组融合蛋白。本研究采用的pET41-EK/LIC表达载体与传统的限制性酶切和连接反应操作策略不同,该载体为线性载体,插入位点为LIC结构,无需限制性内切酶和连接酶就可以通过基因重组进行载体构建,不仅方便易操作,而且能够高效、定向地克隆,阳性重组率>95%。该表达载体带有GST和6×His两个纯化标签序列,便于表达后的纯化,还具有在纯化后以蛋白酶将载体的N端标签序列完全切除的优点。
该重组蛋白N端双标签封闭了ROP2酶活性,易获得高表达量重组蛋白。通过选择工程菌株,优化诱导条件,原核系统也可以重组表达98 kDa大分子量蛋白。重组蛋白与人源弓形虫感染血清有显著免疫印迹反应。但人源弓形虫感染血清成分较为复杂,免疫印迹反应中非特异性杂带较多。由于蛋白免疫反应性主要决定于蛋白一级序列,rROP2的免疫反应性可以反映弓形虫ROP2蛋白的免疫反应性。另外,本研究通过重组表达带有GST标签的ROP2全长融合蛋白,为进一步采用GST Pull-down等技术研究ROP2蛋白与宿主之间的相互作用,揭示弓形虫的感染机理奠定了基础。
