臭氧水-H2O2-金属离子联合液相氧化SO2的实验研究
2014-11-07刘彦飞李光岩佟姝霖
刘彦飞, 李光岩, 佟姝霖
(黑龙江科技大学环境与化工学院,哈尔滨150022)
臭氧水-H2O2-金属离子联合液相氧化SO2的实验研究
刘彦飞, 李光岩, 佟姝霖
(黑龙江科技大学环境与化工学院,哈尔滨150022)
为探讨金属离子浓度、液气比与SO2质量浓度对SO2脱除效果的影响,采用液相氧化方法吸收氧化烟气中的SO2,提出臭氧水-H2O2-金属离子联合液相氧化烟气中SO2的方法。分别研究臭氧水、金属离子、H2O2溶液、液气比、pH和SO2质量浓度等参数下SO2脱除效率。在臭氧质量浓度为1.32 g/m3的臭氧水中分别加入Mn2+、Al3+、Zn2+、Fe2+、Cu2+五种离子与H2O2溶液构成吸收氧化剂,结果表明:臭氧水-H2O2-Mn2+吸收氧化剂的SO2的脱除率明显高于其他类型。在Mn2+浓度0.01 mol/L、H2O2浓度0.01 mol/L、液气比7 L/m3、pH=7的条件下,SO2的去除率为94.7%。
烟气脱硫;吸收塔;臭氧水;湿氧化
0 引 言
烟气臭氧脱硫脱硝氧化技术分为气相和液相两种方法。气相氧化过程中,由于受高温烟气影响,臭氧易发生分解,所以SO2的氧化脱除效率较低。近年来,臭氧液相氧化技术得到广泛关注。最先将臭氧应用于烟气处理的是美国的BOC公司开发的Lo-TOxTM技术,它利用臭氧氧化脱除烟气中的SO2,并结合尾部CaCO3/NaOH的两级碱液吸收装置实现脱硫,脱硫率达到90%以上[1]。在国内,马双忱等研究了鼓泡反应器中臭氧液相氧化脱硫,在n(O3): n(SO2)为0.5、催化剂Mn2+浓度为1.2×10-4mol/L时,脱硫率达到70%[2]。姜树栋等探讨了臭氧液相氧化SO2的结果,当n(O3):n(SO2)为1.0时,可达到70%左右的产率[3]。聂美园研究了臭氧协同催化剂氧化脱硫,结果表明当Mn2+浓度为6.45× 10-4mol/L及n(O3):n(SO2)为1.0时,脱硫率达到99.7%[4]。在众多研究的基础上,笔者提出臭氧水-H2O2-金属离子联合液相吸收氧化SO2的方法,探讨金属离子浓度、H2O2、pH、液气比与SO2质量浓度对其脱除效果的影响。
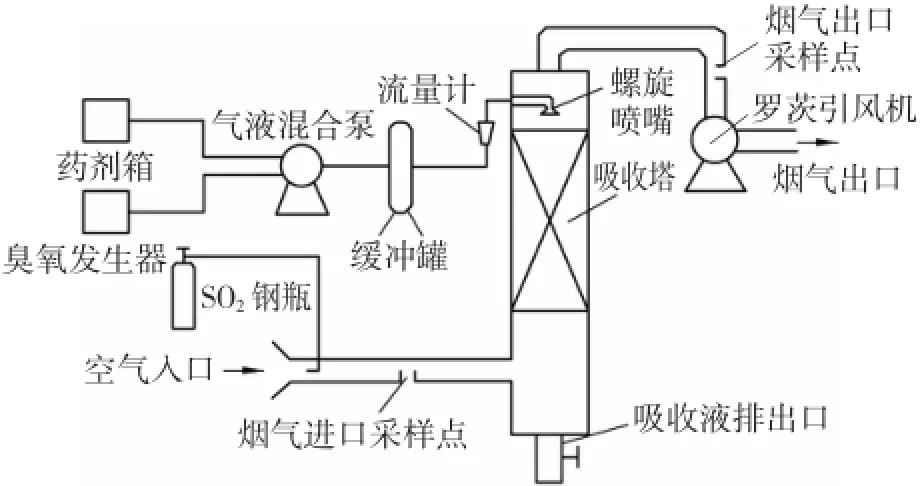
图1 实验装置示意Fig.1 Diagram of experimental devices
1 实 验
1.1实验装置及药剂
自行组装脱硫实验装置如图1所示。反应装置由吸收塔、臭氧发生器、气液混合泵、烟尘采样器、缓冲罐、药剂箱等部分组成。在吸收塔的进气口和出气口分别设置两处烟气采样点,用来测量烟气中SO2的初始浓度和反应后浓度。为了增强吸收塔的脱硫效果,使用螺旋喷嘴进行喷淋。螺旋喷嘴产生撞击式分散喷雾,水流通过撞击螺旋的分层界面,产生分层喷淋,雾化效果更佳。由于喷嘴没有内部结构,所以不会发生堵塞。
实验药剂主要有MnSO4、Al2(SO4)3、ZnSO4、CuSO4、FeSO4、H2O2(质量分数为30%)、浓H2SO4(质量分数为98%)。
1.2实验条件及过程
1.2.1实验参数
吸收塔内气体流速为1 m/s,吸收液金属离子浓度为10-5~10-1mol/L,吸收液的pH为2~7,液气比(吸收液流量与烟气流量的比值,L/m3)为3~7,SO2的质量浓度为500~5 000 mg/m3,吸收液中H2O2浓度为0.01 mol/L。
1.2.2臭氧水质量浓度
臭氧水可以和蓝色的靛蓝二磺酸钠(IDS)水溶液定量反应生成无色的靛红磺酸钠,利用分光光度计测量溶液的退色程度定量测定水中臭氧含量。实验测得水中臭氧的质量浓度为1.32 g/m3。
1.2.3脱硫效率
通过烟气测定仪测量进口与出口的SO2质量浓度,脱硫效率为
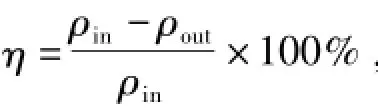
式中:η——脱硫效率;
pin——初始质量浓度,mg/m3;
pout——反应后质量浓度,mg/m3。
1.2.4实验过程
检查各个连接点的密封性,打开SO2钢瓶阀门,启动罗茨引风机。模拟烟气从进气口进入吸收塔内,利用进口阀门控制其流量,使吸收塔内气体流速稳定在1 m/s,同时打开臭氧发生器和气液混合泵,产生的臭氧和药剂箱中的吸收液共同进入气液混合泵,混合后的溶液直接进入缓冲罐,打开烟尘采样器,检测两处采样点SO2的浓度变化。
2 结果与讨论
2.1臭氧水与H2O2对脱硫效果的影响
实验条件:SO2质量浓度1 000 mg/m3,pH=7,液气比为3 L/m3,吸收液流量460 m3/h。
实验考察在吸收液为水、0.01 mol/L的H2O2溶液、臭氧水、臭氧水-H2O2组合对烟气中SO2的去除效果。实验结果见图2。
从图2中可以看出,随着设备运行时间的增加,四组实验脱硫率η的变化相对稳定,水对SO2的去除为吸收过程,平均脱硫率为51.2%,说明单一的吸收过程脱硫效果不佳。在臭氧水与H2O2溶液两种氧化剂单独进行脱硫实验时其平均脱硫率分别为60.7%和56.7%,相对于水的脱硫率有小幅提高,说明臭氧水和H2O2脱硫过程中不单有吸收作用,同时存在液相氧化作用。四组实验中臭氧水和H2O2组合对SO2的去除效果较好,平均去除率达到了68.9%,在臭氧水溶液中加入H2O2会加速臭氧分解产生更多的·OH[5],故提高了脱硫效率。
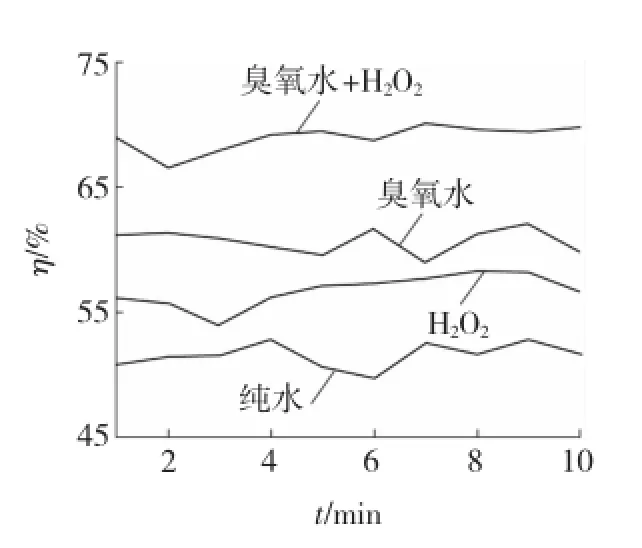
图2 臭氧水与H2O2对SO2去除效果的影响Fig.2 Influences of ozone water and H2O2on SO2rem oval effect
2.2金属离子对脱硫效果的影响
实验条件:SO2质量浓度1 000 mg/m3,pH=7,液气比为3 L/m3,吸收液流量为460 m3/h。
实验分别考察Mn2+、Al3+、Zn2+、Fe2+、Cu2+五种不同金属离子吸收液在不同浓度c下对烟气中SO2的去除效果。实验结果见图3。
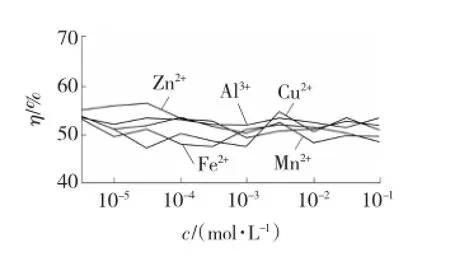
图3 金属离子对SO2去除效果的影响Fig.3 Influence of metal ions on SO2removal effect
从图3中可以看出,随着金属离子溶液浓度的逐渐增加,系统的脱硫率并没有明显的变化,平均去除率在51.6%,脱硫效果不佳。这说明在没有氧化剂的作用下,单独的金属离子不能达到催化氧化脱硫的效果,仅有水的吸收作用。
2.3H2O2与金属离子联合对脱硫效果的影响
实验条件:SO2质量浓度1 000 mg/m3,pH=7,液气比为3 L/m3,吸收液流量为460 m3/h。
实验考察Mn2+、Al3+、Zn2+、Fe2+、Cu2+五种不同金属离子分别与H2O2混合后的吸收液液相氧化去除SO2的效率。实验结果见图4。
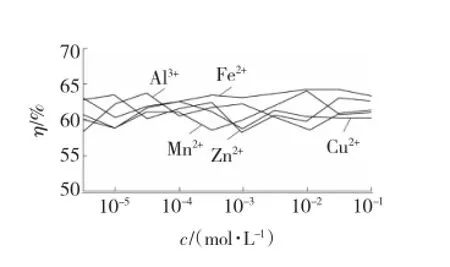
图4 H2O2-金属离子溶液对SO2去除效果的影响Fig.4 Influences of H2O2-metal ion solution on SO2removal effect
从图4中可以看出,H2O2-金属离子溶液液相氧化脱硫的效果较五种金属离子溶液和H2O2单独氧化脱硫略有提高,平均去除率在61.3%。这说明金属离子与H2O2联合湿氧化过程中,金属离子起到了一定的催化作用。其中Fe3+与H2O2组成的Fenton溶液的脱硫效果优于其他四种溶液,这是因为Fe2+被H2O2氧化成Fe3+过程中产生了·OH。Fenton氧化技术中,氧化作用的关键因素即是·OH,只有促进大量·OH的产生,才能达到理想的效果[6-7]。上述五种溶液脱硫效果的区分度不明显,说明在溶液中金属离子的催化效果不佳。
2.4臭氧水与金属离子联合对脱硫效果的影响
实验条件:SO2质量浓度1 000 mg/m3,pH=7,液气比为3 L/m3,吸收液流量460 m3/h。
实验考察Mn2+、Al3+、Zn2+、Fe2+、Cu2+五种不同金属离子分别与臭氧水组成的吸收液对烟气中SO2的去除效果。实验结果见图5。
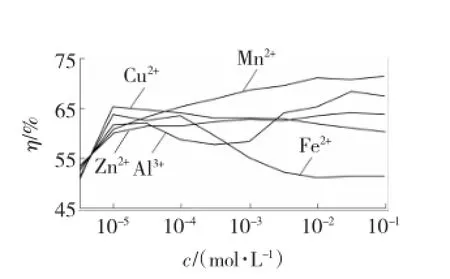
图5 臭氧水与金属离子组合对SO2去除效果的影响Fig.5 In fluences of combination of ozone w ater and metal ions on SO2removal effect
从图5中可以看出,在臭氧水中添加Cu2+、Zn2+对脱硫率基本影响不大,对反应催化作用不明显。Fe2+随着浓度的增加系统脱硫率明显降低,说明在臭氧水中添加Fe2+,使得水中的臭氧与Fe2+反应生成Fe3+,溶液中的臭氧浓度降低,故液相氧化的效果不佳。Al3+的脱硫率随浓度升高而出现波动,可以用盐的水解理论解释,当Al3+浓度为10-4mol/L时,在中性水溶液发生一系列的多级水解反应,此时水中Al3+形态以单体羟基络离子为主,如Al(OH)2+等[8],释放H+导致溶液pH降低,因为酸性吸收液对脱硫过程有抑制作用,所以脱硫率降低。当Al3+浓度为10-3mol/L时,水解程度减弱,溶液pH为中性,所以脱硫率升高。Mn2+随着离子浓度的增加脱硫率逐渐提高,催化氧化效果较好,当浓度为10-2mol/L时,脱硫率达到71.2%,继续增大Mn2+浓度到10-1mol/L时,脱硫率为71.4%,脱硫率提高不显著。同时在脱硫反应过程中吸收液的颜色从无色透明变成棕色液体,最终变成棕褐色液体,并附着在气液混合泵出口流量计的壁上,用清水冲洗不能去除,但是用稀硫酸溶液很容易将其清洗干净。将反应后的废液取出装入烧杯中静置1 h,观察到烧杯底部有絮状沉淀,这说明Mn2+在脱硫反应中发生了价态变化。
2.5臭氧水-H2O2-金属离子联合对脱硫效果的影响
实验条件:SO2质量浓度1 000 mg/m3,pH=7,液气比为3 L/m3,吸收液流量460 m3/h。
实验考察五种不同H2O2-金属离子溶液与臭氧水组成的吸收液对液相氧化去除SO2效率的影响。实验结果见图6。
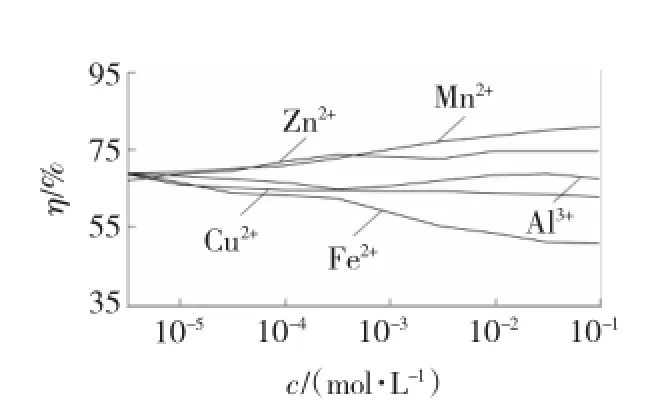
图6 臭氧水-H2O2-金属离子溶液组合对SO2去除效果的影响Fig.6 Influences of ozone water-H2O2-metal ion solution combination on SO2removal effect
从图6中可以看出,Fenton溶液的脱硫效果随着溶液中Fe2+浓度的升高而降低。这是由于溶液中的臭氧与Fe2+发生氧化反应生成Fe3+,阻止了Fe2+和H2O2之间发生的Fenton效应,进而溶液中臭氧与·OH的含量降低,即氧化性能降低影响脱硫效率。Mn2+浓度增加对脱硫率有着较大的影响,当浓度达到10-1mol/L时,脱硫率达到81.1%。催化氧化效果优于其他金属离子,溶液中有可能存在着类似Fe2+与H2O2之间产生的Fenton效应。即
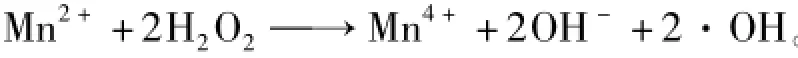
·OH的氧化性较强,可以迅速氧化SO2提高脱硫效率。从上述各实验可以得出,在各种氧化剂单独或者搭配使用中,臭氧-H2O2-Mn2+溶液组合的脱硫效果较好。
2.6液气比和吸收液pH对脱硫效果的影响
实验条件:SO2质量浓度1 000 mg/m3,Mn2+浓度0.01 mol/L。
实验考察系统运行的液气比和吸收液pH变化对烟气中SO2的去除效果。实验结果见图7,图中五条折线是液气比分别为3~7 L/m3的变化情况。
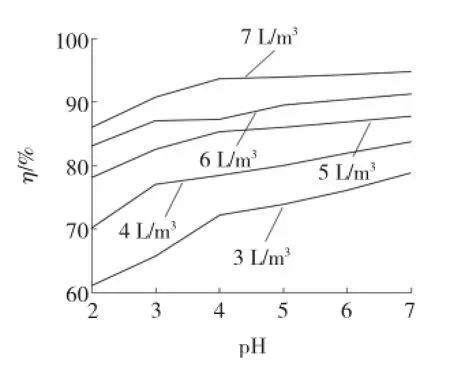
图7 液气比和pH对SO2去除效果的影响Fig.7 Influences of liquid-gas ratio and pH value on SO2removal effect
从图7可以看出,随着pH升高,脱硫率逐渐升高,当pH从2上升到4,期间脱硫率提升得很快。因为pH小于4时,吸收液中的臭氧分解十分迅速[9],所以臭氧水很不稳定,吸收液氧化效果较差,脱硫率较低。当pH从4上升到7,脱硫率增幅比较平稳。液气比的升高使脱硫率也显著提高,在液气比小于5 L/m3时,脱硫率随液气比的增加有较大幅度的提高,当液气比大于5 L/m3时,脱硫效率增幅逐渐减小。
2.7SO2质量浓度对脱硫效果的影响
实验条件:Mn2+浓度0.01 mol/L,液气比为3 L/m3,吸收液流量为460 m3/h,pH=7,填料层高度为60 cm。
通过调节SO2钢瓶阀门控制入口浓度,实验考察SO2质量浓度变化对系统脱硫率的影响。实验结果见图8。
实验过程中逐渐提高烟气中SO2质量浓度p,从图8可见,当SO2质量浓度从500增加到2 000 mg/m3时,脱硫率逐渐升高,并在SO2质量浓度为2 000 mg/m3时,达到了最大值,即97.5%。因为增大入口处SO2质量浓度,相当于增大了气相主体中SO2的分压,从而增大了气液传质的推动力,增强了传质效果,所以脱硫率升高。当SO2质量浓度从2 000增加到5 000 mg/m3时,脱硫率逐渐降低,出现此现象的原因是SO2质量浓度升高会降低其溶解速率,并且SO2没有和吸收液充分的接触,导致脱硫率降低。
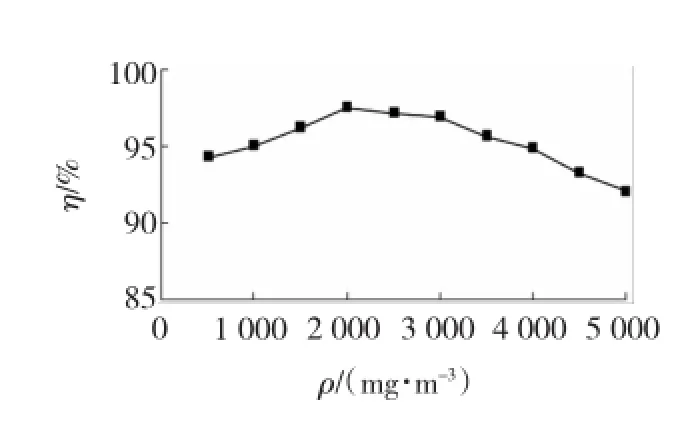
图8 SO2质量浓度对脱硫率的影响Fig.8 In fluences of SO2mass concentration on desulfurization degree
3 结 论
(1)在各种氧化剂单独或者搭配使用,进行脱硫效果的实验中,臭氧-H2O2-Mn2+溶液组合脱硫效果较好,脱硫率为81.1%。
(2)pH和液气比的增加能提高脱硫率,在Mn2+浓度0.01 mol/L,H2O2浓度0.01 mol/L,pH为7、液气比为7 L/m3时,脱硫率达到94.7%。
(3)SO2质量浓度变化会对脱硫率产生影响,在SO2低于2 000 mg/m3时,随质量浓度的增加脱硫率增加,当SO2质量浓度继续增加,高于2 000mg/m3时,由于溶解速率的降低,导致脱硫率降低。
[1] 王 静.臭氧烟气多脱技术中SO2氧化脱除的试验研究[D].杭州:浙江大学,2008.
[2] 马双忱,苏 敏,马京香,等.锰离子催化臭氧液相烟气脱硫实验研究[J].环境科学,2009,30(11):3173-3175.
[3] 姜树栋,周俊虎,王智化,等.O3液相氧化脱除SO2实验研究[J].中国电机工程学报,2008,28(32):57-60.
[4] 聂美园.臭氧脱除烟气中二氧化硫和一氧化氮的实验研究[D].上海:华东理工大学,2012.
[5] WILLIAN H,GLAZEA,KERW IN L,etal.The chemistry ofwater treatment processes involving ozone,hydrogen peroxide and ultraviolet radiation[J].Ozone:Science&Engineering,1987(9):335-352.
[6] 万俊锋,李光明.Fenton试剂在污水处理上的发展与展望[J].江苏环境科技,2005,18(3):36-39.
[7] CHAMARRO E,MARCO A,ESPLUGAS S.Use of fenton reagent to improve organic chemicalbiodegradability[J].Water Res,2001,35(4):1047-1051.
[8] 胡 芳.铝盐絮凝剂水解聚合形态的研究进展[J].造纸科学与技术,2007,26(3):36-39.
[9] 方 敏,沈月新,方 竞,等.臭氧水稳定性的研究[J].食品科学,2002,23(9):39-43.
(编辑徐 岩)
Experiment on combination of ozone water-H2O2-metal ion w ith SO2in liquid-phase oxidized sm oke
LIU Yanfei, LIGuangyan, TONG Shulin
(School of Environmental&Chemical Engineering,Heilongjiang University of Science&Technology,Harbin 150022,China)
This paper gives an improvedmethod of combining ozonewater-H2O2-mental ion with SO2in liquid-phase oxidized smoke as part of the efforts to study the effect ofmetal ion concentration,liquidgas ratio,and SO2mass concentration on SO2removal effect.Themethod works by using the liquid-phase oxidation method to absorb SO2in oxidized smoke.The study looks at SO2removal efficiency,as conditioned by such parameters as ozonewater,metal ion,H2O2solution,liquid-gas ratio,pH values and SO2mass concentration,etc.The addition of five ions consisting of Mn2+,Al3+,Zn2+,Fe2+and Cu2+into ozone waterwith ozonemass concentration of 1.32 g/m3to produce an absorption oxidizing agentwith the H2O2solution points to the obvious advantage of the SO2removal rate of ozone water-H2O2-Mn2+absorption oxidizing agent over those of other types.The SO2removal rate of 94.7%is afforded by the presence of Mn2+concentration of0.01 mol/L,H2O2concentration of 0.01 mol/L,and liquid-gas ratio of 7 L/m3and pH=7.
flue gas desulfurization;absorption tower;ozone water;wet oxidation
10.3969/j.issn.2095-7262.2014.05.016
X701.3
2095-7262(2014)05-0512-05
A
2014-04-15
刘彦飞(1968-),男,安徽省宿县人,教授,博士,研究方向:大气气溶胶、大气污染控制技术,E-mail:usthcn@163.com。
