酸提香菇多糖的抗氧化活性研究
2014-11-06梅光明张小军郭远明朱敬萍
梅光明,张小军,郝 强,郭远明,朱敬萍
(1.浙江海洋学院海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021; 2.北京海燕药业有限公司,北京 102206)
酸提香菇多糖的抗氧化活性研究
梅光明1,张小军1,郝 强2,郭远明1,朱敬萍1
(1.浙江海洋学院海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021; 2.北京海燕药业有限公司,北京 102206)
以香菇柄为材料,利用稀盐酸浸提得到粗香菇多糖SP和净化分级后的香菇多糖SP2,在化学发光体系下研究两种多糖在清除超氧阴离子、清除经基自由基、清除过氧化氢和抑制DNA氧化损伤方面的作用;用可见光比色法比较SP和SP2与VC和VE的还原能力大小;同时研究了两种多糖对H2O2诱导小鼠红细胞氧化溶血和小鼠红细胞自氧化溶血的影响以及在小鼠体内抗氧化效果。结果表明香菇多糖SP和SP2对超氧阴离子、经基自由基和过氧化氢均具有清除作用和抑制DNA氧化损伤作用,从SC50值看出,香菇多糖经过纯化后作用减弱,这可能是因为香菇多糖之间或与其它物质有协同作用有关;可见光比色法表明SP和SP2具有还原能力,为表现抗氧化活性的可能提供了基础;SP和SP2对H2O2诱导小鼠红细胞氧化溶血以及小鼠红细胞自氧化溶血均有抑制效果;体内抗氧化试验表明SP和SP2可以减少小鼠体内肝组织丙二醛的生成,提高血清中超氧化物歧化酶的活力。研究为开发酸提香菇多糖功能性食品和香菇柄资源综合利用提供理论基础。
香菇;多糖;抗氧化
香菇Lentinus edodes在分类上属担子菌纲,伞菌目,侧耳科,香菇属[1]。香菇味道鲜美,营养丰富,是著名的食用兼药用真菌,其中主要成分为香菇多糖,研究证实香菇多糖具有抗肿瘤、抗氧化和提高人体免疫力等多种生理活性功能[2-5]。从1969年日本学者CHIHARA等[6]首先利用热水浸提法从香菇子实体中分离出一种能抑制肿瘤的β-(1→3)葡聚糖多糖以来,香菇多糖就引起了各国科学家的研究兴趣,因提取方式和纯化方法的不同,得到的香菇多糖结构特点也不同[7-11]。目前研究较多的香菇多糖主要采用热水浸提法、碱提取法、超声波或微波辅助热水提取法和酶解辅助提取法[12-14]。水浸提提取香菇多糖的得率较低,课题小组前期通过研究建立了从香菇加工废弃物—香菇柄中用稀盐酸溶液提取香菇多糖的方法[15],提高了香菇多糖的提取效率。本研究对得到的酸提香菇多糖进行抗氧化活性进行研究,考察其在化学模拟体系、体内及体外抗氧化活性大小,可为开辟一种新的活性香菇多糖来源和香菇资源的综合利用提供理论基础。
1 材料与方法
1.1 主要材料与试剂
香菇柄由湖北房县华榕香菇加工厂提供;试验小鼠为SPF级昆明种小白鼠,雌性,体重(20.0±2.0)g,湖北省实验动物研究中心提供,生产许可证号SCXK(鄂)2003-0005,使用许可证号SYXK(鄂)2003-0014;VE、小牛胸腺DNA和鲁米诺均为生化试剂,美国Sigma公司生产;牛血清蛋白为电泳纯,中科院新疆化学所生化试剂厂生产;MDA、SOD试剂盒,南京建成生物工程研究所生产;其它试剂均为分析纯,国药集团化学试剂有限公司生产。
1.2 主要试剂配置
0.5 %小鼠红细胞悬浮液:小鼠眼眶取血,加入EDTA抗凝剂(4%的EDTA水溶液)后,以3 000 r/min离心10 min,分离得到红细胞,冷生理盐水洗涤红细胞3次,再以生理盐水制备成0.5%小鼠红细胞悬浮液,备用。
小鼠10%肝匀浆:取新鲜的小鼠肝组织以冰冷的生理盐水洗净血渍,用滤纸吸干水分后称重,按1:9取相应体积的冷生理盐水于冰浴中分步将肝组织剪碎、在玻璃组织匀浆器中匀浆制成匀浆液,以3 500 r/ min离心20min,上清液即为10%肝组织匀浆液。
小鼠肝线粒体悬浮液:取新鲜的小鼠肝组织以冷的生理盐水洗净血渍吸干表面水分后,按1:9的比例加冰冷的pH 7.4等渗磷酸盐缓冲液(PBS)剪碎后用玻璃匀浆器在冰浴中匀浆制成10%肝组织匀浆液,然后在4℃下以1 000 r/min离心15min,收集上清液,再以10 000 r/min离心15min,收集沉淀并以等渗磷酸盐缓冲液洗涤沉淀2次,接着以等渗磷酸盐缓冲液将沉淀分散制成肝线粒体悬液,用考马斯亮蓝法[16]测定该悬浮液的蛋白质含量,调整成蛋白质含量为0.5mg/mL的线粒体悬浮液,备用。
1.3 主要试验仪器
AL204分析天平,上海梅特勒公司;S22分光光度计,上海棱光技术有限公司;HH-系列恒温水浴锅,常州市国华仪器厂;BPCL-I型超微弱化学发光测量仪,中国科学院生物物理所;5424R型台式微量高速冷冻离心机,Eppendorf公司;5810R型台式高速冷冻离心机,Eppendorf公司;玻璃匀浆器,武汉市民权玻璃仪器厂。
1.4 实验方法
1.4.1 酸提香菇多糖的制备
称取烘干粉碎并经40~60目筛分后的香菇柄样品100 g,经300mL石油醚(30~60℃沸程)提取3 h进行脱脂,用滤布过滤后,滤渣用80%乙醇300mL再回流提取2次,每次2 h,除酚类色素、单糖和低聚糖,过滤后固体残渣经70℃烘干备用。参照文献[15]中的方法提取得到酸提粗香菇多糖SP。粗多糖经鞣酸法脱蛋白[17]、双氧水脱色[18]后,经醇沉、离心后纯水复溶。利用不同分子量大小的多糖在乙醇-水溶液中溶解度不同的原理将其进一步分离纯化。在乙醇-水溶液终浓度分别为50%、70%、90%的条件下,得到3个级分多糖,分别命名为SP1、SP2、SP3,三个级分多糖的得率分别为25.58%、64.77%、9.64%。
1.4.2 清除超氧阴离子
采用邻苯三酚-鲁米诺化学发光体系,鲁米诺用0.05 M的NaOH溶液配成0.05 M浓度的溶液,在避光处保存,临用前用双蒸水稀释成1mM的溶液,邻苯三酚用1mM HCl配成0.01 M的溶液,4℃冰箱中保存,临用前用双蒸水稀释16倍得6.25×10-4M溶液。0.05 M pH 10.2的Na2CO3-NaHCO3缓冲液(含0.1 mM EDTA)用前现配,实验前与1mM鲁米诺以体积比为2∶1混合成鲁米诺和碳酸盐缓冲液混合物。测量时,向发光池中注入10.0μL不同浓度的样品(以样品缓冲液为对照),然后注入6.25×10-4M邻苯三酚0.05 mL,最后加入鲁米诺和碳酸缓冲液混合物0.94 mL启动反应(30℃),间隔2 s记数发光强度,测定300 s的总发光积分强度。本底发光强度为未添加邻苯三酚时的发光值。以样品浓度对的清除率作图,就可以得到清除50%的时所需各样品的SC50值。清除率计算公式为:清除率(%)=(对照组发光强度-样品组发光强度)/对照组发光强度[19-22]。
1.4.3 清除经基自由基
采用CuSO4-Phen-Vc-H2O2化学发光体系,取50μL样品于样品池(以样品缓冲液为对照)中,分别加入1.0 mM CuSO4溶液50μL,1.0 mM邻菲啰啉溶液50μL,0.05 M硼砂溶液700μL(pH 9.0),充分混匀,然后再加入100μL 1.0mM抗坏血酸溶液和50μL 0.15%H2O2溶液(本底不加双氧水),立即启动化学发光系统,间隔2 s记数,记录300 s内化学发光动力学曲线[19-22]。
1.4.4 清除过氧化氢
采用双氧水-鲁米诺化学发光体系,取待测样品各50μL于样品池中,加入50μL 0.15%H2O2和900 μL 0.1mM鲁米诺-pH 9.4 0.05M碳酸盐缓冲液混合液(体积比为1:17),启动发光系统,间隔2 s记数,记录180 s内发光强度[19-22]。
1.4.5 抑制DNA氧化损伤
采用CuSO4-Phen-Vc-H2O2-DNA化学发光体系,分别用去离子水配制0.1 M CH3COOH-CH3COONa缓冲液,4.2×10-3M抗坏血酸溶液,3%H2O2,及DNA-Cu2+-Phen体系(DNA浓度为3μg/mL,CuSO4·5H2O浓度为7.5×10-5M,Phen 5.25×10-4M)。在发光池中依次加入100μL样品溶液,800μL DNA-Cu2+-Phen体系溶液,100μL抗坏血酸溶液,轻轻振荡混匀后,置于发光装置中,打开记录系统后,立刻注入200μL的双氧水,立刻启动发光装置,每隔2 s记录数据1次,记录540 s内的动态发光过程[23-24]。
1.4.6 还原能力测定
取1 mL样品溶液加入0.2 mL 0.2 M PBS(pH 6.6)和0.5 mL 1%K3[Fe(CN)6]于试管中50℃水浴20 min,取出后流水冷却,加入1mL 10%三氯乙酸,以3 000 r/min离心10min,取1.5 mL上清液,加0.2mL 1%FeCl3和3 mL蒸馏水摇匀,放置5 min,以蒸馏水作为无还原能力的样品对照调零,700 nm处测定吸光值。A700越大,表示还原能力越强。除VE用40%(v/v)乙醇溶解外,其他样品均用蒸馏水溶解。VE及VC作为有还原能力的样品对照[25-26]。
1.4.7 H2O2诱导小鼠红细胞氧化溶血的影响
取1mL红细胞悬浮液,加入0.2mL样品溶液混匀后,加0.1 mL 100 mM H2O2溶液,混匀,37℃温育1 h后,以生理盐水稀释6倍,1 000 r/min离心10min,取上清液,以生理盐水调零,于415 nm处比色测定吸光度。正常对照组以等体积生理盐水代替样品液和H2O2溶液,其余同样品组。H2O2诱导对照组以等体积生理盐水代替样品溶液,其余同样品组。分别以吸光度计算溶血度和抑制率。溶血度(%)=(样品管吸光度/H2O2诱导对照组吸光度)×100,抑制率(%)=1-溶血度(%)。
1.4.8 对小鼠红细胞自氧化溶血的影响
取红细胞悬浮液5 mL与0.2mL不同浓度的样品混合,于37℃温育24 h(对照管以蒸馏水代替样品液),然后以生理盐水稀释5倍,1 000 r/m离心10min取上清液,于540 nm处比色,根据吸光度计算抑制率,公式如下:溶血抑制率(%)=(1-样品管吸光度/对照管吸光度)×100。
1.4.9 体内抗氧化
昆明种小鼠70只,小鼠随机分成7组(正常对照组、SP和SP2试验组),每组10只。正常对照组小鼠喂养按常规条件进行,SP和SP2试验组分别以高、中、低三个样品剂量(100、50、25mg/kg)每日定期灌胃1次,连续灌胃20 d后,眼眶取血处死小鼠,分离血清,按照试剂盒的方法测定血清的SOD;取新鲜小鼠肝组织制备成10%肝匀浆液,再按MDA测定试剂盒说明书测定A532,并计算MDA含量。
1.4.10 统计学分析
所有实验数据采用SPSS17.0软件进行统计学分析,并用均数±标准差±s)表示。单独两组计量数据比较采用t检验,多组计量数据比较采用方差分析(ANOVA)。
2 结果与分析
2.1 清除超氧阴离子测定
邻苯三酚在碱性条件下自氧化产生超氧阴离子,以鲁米诺为发光剂,超氧阴离子与化学发光剂鲁米诺反应使之氧化,产生一个电子激发态的中间物,当其返回到基态时可发出化学冷光。从图1可知,在1.25~20 mg/mL浓度范围内,SP和SP2对超氧阴离子均有清除作用,并表现出一定的量效关系,且SP对超氧阴离子清除作用要好于SP2,SP、SP2清除率拟合曲线分别为y=25.203 ln(x)+30.57(相关系数R2=0.986)和y=24.777 ln(x)+ 14.304(相关系数R2=0.950),根据拟合曲线计算出SP、SP2的SC50值分别为2.5 mg/mL和10 mg/ mL。2.2清除羟基自由基测定
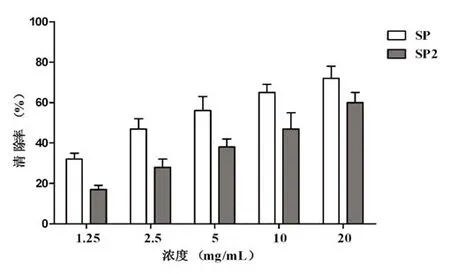
图1 香菇多糖SP和SP2对超氧阴离子的清除作用Fig.1 The scavenging activity on superoxide anion of SP and SP2
体系中Cu2+被VC还原成Cu+,Cu+与H2O2在Fenton反应中产生·OH,·OH使邻菲啰啉激发,邻菲啰啉退激时产生化学发光。从图2可知,在0.075~1.2 mg/mL浓度范围内,粗多糖SP和香菇多糖SP2对经基自由基均有清除作用,并随着其浓度的增加,对经基自由基的清除率增加。粗多糖SP对经基自由基的清除率从 24.77%增加到79.85%。香菇多糖SP2也表现出抑制该体系发光的趋势,在浓度为1.25 mg/mL时,清除率为62.28%。SP、SP2清除率拟合曲线分别为 y= 33.432 ln(x)+23.023(相关系数R2=0.989)和y= 31.599 ln(x)+9.6344(相关系数R2=0.988),根据拟合曲线计算出SP、SP2的SC50值分别为0.15 mg/mL和0.3mg/mL。
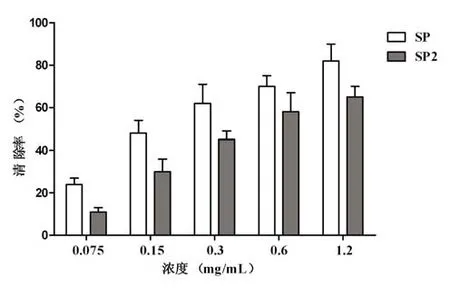
图2 香菇多糖SP和SP2对羟基自由基的清除作用Fig.2 The scavenging activity on hydroxyl radical of SP and SP2
2.3 清除过氧化氢测定
基于H2O2能在有氧和碱性条件下氧化鲁米诺产生化学发光。从图3可知,粗多糖SP和香菇多糖SP2在该体系中均表现出一定的清除过氧化氢作用,并随着其浓度的增加,对过氧化氢的清除率增加。SP、SP2清除率拟合曲线分别为y=29.3 ln(x)+ 17.87(相关系数R2=0.968)和y=28.134 ln(x)+9.804(相关系数R2=0.970),根据拟合曲线计算出SP、SP2的SC50值分别为7.8 μg/mL和15.6μg/mL。
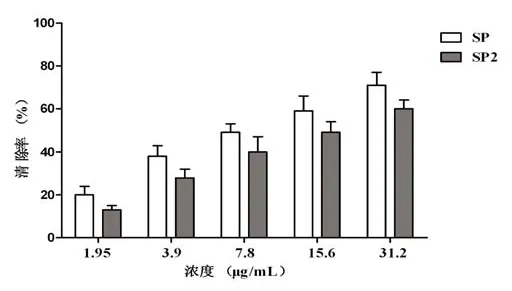
图3 香菇多糖SP和SP2对过氧化氢的清除作用Fig.3 The scavenging activity on hydrogen peroxide of SP and SP2
2.4 抑制DNA氧化损伤测定
利用CuSO4-Phen-Vc-H2O2体系产生· OH,·OH引起DNA损伤断裂,产生延迟于Phen本身氧化发光的滞后的化学发光。抗氧化剂的加入能够明显影响DNA损伤发光的形成。从图4可知,粗多糖SP对DNA损伤的抑制率随浓度增加,而成直线上升趋势,当粗多糖SP浓度为1.25 mg/mL时,抑制率为90.45%。香菇多糖SP2同样在0.078~1.25mg/ mL浓度范围内呈上升趋势抑制经基自由基引起DNA损伤断裂,在浓度1.25mg/mL时,抑制率为66.08%,SC50为0.625 mg/mL。SP、SP2抑制率拟合曲线分别为y=46.67 ln(x)+ 11.512(相关系数R2=0.970)和y=34.385 ln(x)+ 3.630(相关系数R2=0.953),根据拟合曲线计算出SP、SP2的SC50值分别为0.312 5 mg/mL和0.625mg/mL。

图4 香菇多糖SP和SP2抑制DNA氧化损伤的作用Fig.4 The inhibiting activity on DNA oxidative damage of SP and SP2
2.5 还原能力测定
从图5可见,粗多糖SP的还原能力随着多糖溶液浓度的增加呈增长趋势,并表现出一定的量效关系,在0.5mg/mL的浓度以下,还原能力低于30μg/mL Vc体系和2μL/mL VE体系,在0.5 mg/mL浓度以上,还原能力超过30μg/mL Vc体系和2μL/mL VE体系。而香菇多糖SP2的还原能力明显低于粗多糖,随着浓度的增加,还原能力也呈较好的增长趋势,也表现出一定的量效关系,在2 mg/mL的浓度,还原能力已超过30μg/ mL Vc体系和2μL/mL VE体系。推测其原因可能是因为脱蛋白的过程中粗多糖的某些氢键断裂造成糖蛋白空间结构的改变,导致香菇多糖SP2的还原能力减弱。结果表明,香菇多糖具有还原能力,具有表现抗氧化活性的可能。
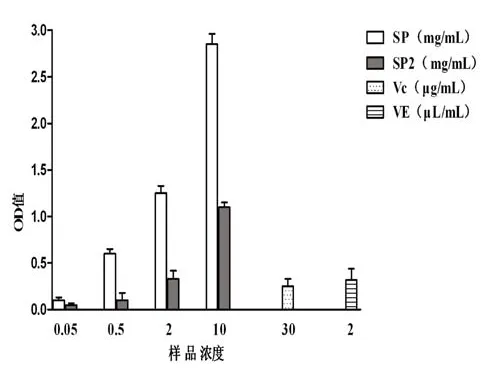
图5 香菇多糖SP和SP2的还原能力Fig.5 The reducing power of SP and SP2
2.6 对H2O2诱导小鼠红细胞氧化溶血的影响
实验通过H2O2诱导氧化,根据体系中加入不同浓度的香菇多糖,抑制红细胞诱导氧化溶血。香菇多糖对H2O2诱导小鼠红细胞氧化溶血的影响见表1。

表1 香菇多糖对H2O2诱导的体外小鼠红细胞溶血的影响(n=3)Tab.1 Effects of SP and SP2 onmice erythrocyte hemolysis caused by H2O2-induced oxidation(n=3)
由表1可知,随着多糖浓度的增加,粗多糖SP和香菇多糖SP2在抑制H2O2诱导的小鼠红细胞溶血时,都表现为一定的量效关系。但粗多糖SP在浓度0.05~2.00mg/mL范围内是随着浓度的增加,对于H2O2诱导小鼠红细胞氧化溶血的抑制效果是逐步增加,但在浓度10.00mg/mL下,抑制小鼠红细胞氧化溶血能力下降。可能是样品不纯净或浓度过高,使反应体系渗透压超出了红细胞的生理渗透压所致。香菇多糖SP2对H2O2诱导的小鼠红细胞溶血的抑制效果要好于粗多糖SP,随着浓度的增加,抑制效果也是逐步提高,有明显的剂量-效应关系。由此可知,香菇多糖对与H2O2诱导小鼠红细胞氧化溶血的抑制有一定效果。
2.7 对小鼠红细胞自氧化溶血的影响
香菇多糖对小鼠红细胞自氧化溶血的影响见表2。

表2 香菇多糖对小鼠红细胞自氧化溶血的影响(n=3)Tab.2 Effects of SP and SP2 onmice erythrocyte hemolysis caused by autoxidation(n=3)
由表2可知,粗多糖SP随着多糖浓度的增加,对小鼠红细胞自氧化溶血有抑制作用,但没有明显的剂量-效应关系。香菇多糖SP2在浓度0.05~10.00mg/mL范围内的最高抑制率低于粗多糖SP,但随着浓度的增大,抑制率在逐步增加,表现出明显的剂量-效应关系。在10.00 mg/mL的浓度时,香菇多糖SP2的抑制效果已接近粗多糖SP的最高抑制率。
2.8 体内抗氧化效果
香菇多糖SP和SP2在小白鼠体内抗氧化结果见表3。
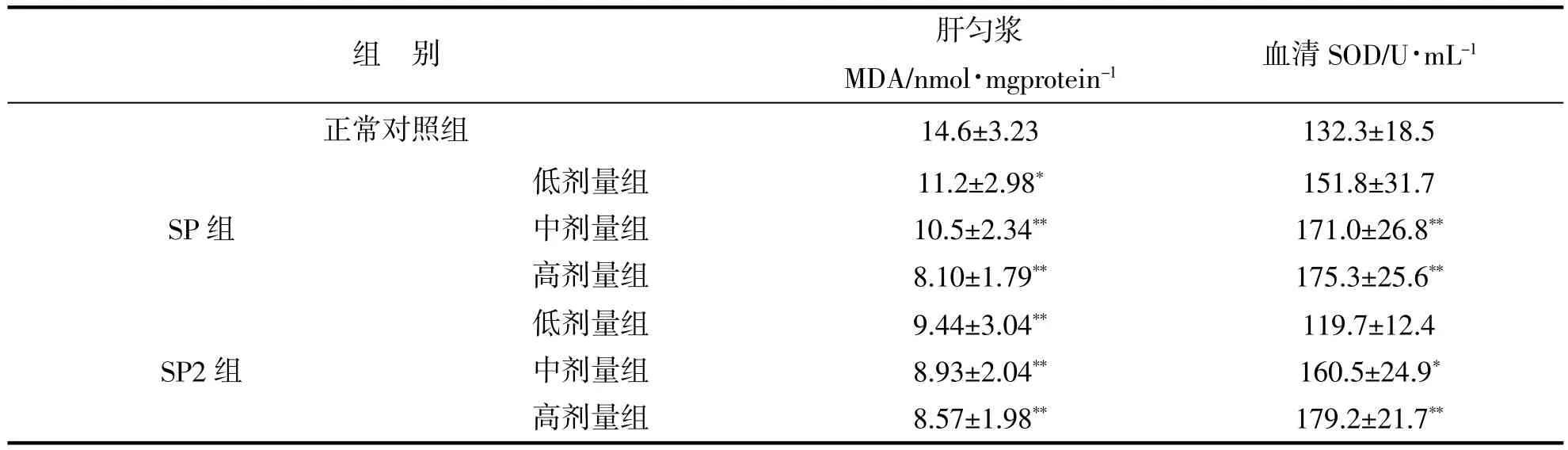
表3 香菇多糖在小鼠体内抗氧化试验结果Tab.3 Antioxidant results of SP and SP2 onmice in vivo
结果表明在肝匀浆MDA测定中,SP低剂量组与正常对照组相比较有显著差别(P<0.05),中剂量组和高剂量组MDA含量明显降低,有极显著差别(P<0.01),SP2高中低3个剂量组与正常对照组相比较均有极显著差别(P<0.01),SP和SP2都表现出一定的量效关系;在血清SOD测定中,SP组中剂量和高剂量组与正常对照组相比较,SOD活力明显提高,有极显著差别(P<0.01),SP2组中剂量组与正常对照组相比较有显著差别(P<0.05),高剂量组有极显著差别(P<0.01),SP和SP2也都表现出一定的量效关系。结果表明香菇多糖SP和SP2可以降低肝组织MDA的生成,提高小鼠血清SOD的活力。
3 结论
化学发光体系评价表明香菇多糖SP和SP2均具有抗氧化活性及DNA损伤保护作用,从SC50值看出,香菇多糖经过纯化后,清除超氧阴离子、经基自由基、过氧化氢和抑制DNA损伤的作用减弱,这可能是因为香菇多糖之间或与其它物质有协同作用。化学模拟体系实验表明,酸提香菇多糖具有还原能力,为表现抗氧化活性的可能提供了基础。体外抗氧化试验表明,酸提香菇多糖对与H2O2诱导小鼠红细胞氧化溶血以及小鼠红细胞自氧化溶血都有一定抑制效果。体内抗氧化动物试验表明,酸提香菇多糖可以减少小鼠体内肝组织MDA的生成,提高超氧化物歧化酶的活力。本研究为开辟一种新的活性香菇多糖来源和香菇资源的综合利用提供理论基础。
[1]申进文,冯雅岚,庄庆利,等.香菇子实体多糖提取工艺优化研究[J].河南农业科学,2010(3):90-92.
[2]INA K,KATAOKA T,ANDO T.The use of lentinan for treating gastric cancer[J].Anti-cancer Agents in Medicinal Chemistry,2013,13(5):681-688.
[3]ATTIA SM,HARISA G I,ABD-ALLAH A R,et al.The influence of lentinan on the capacity of repair of DNA damage and apoptosis induced by paclitaxel in mouse bonemarrow cells[J].Journal of Biochemical and Molecular Toxicology,2013,27(7):370-377.
[4]ISODA N,EGUCHIY,NUKAYA H,et al.Clinical efficacy of superfine dispersed lentinan(beta-1,3-glucan)in patients with hepatocellular carcinoma[J].Hepatogastroenterology,2009,56:437-41.
[5]BISEN PS,BAGHEL R K,SANODIYA B S,et al.Lentinus edodes:amacrofunguswith pharmacological activities[J].CurrentMedicinal Chemistry,2010,17(22):2 419-2 430.
[6]CHIHARA G,MAEDA Y Y,HAMURO J,et al.Inhibition ofmouse sarcoma 180 by polysaccharides from Lentinus edodes[J]. Nature,1969,222:687-688.
[7]SASAKIT,TAKASUKA N.Further study of the structure of lentinan,an anti-tumor polysaccharide from Lentinus edodes[J]. Carbohydrate Research,1976,47(1):99-104.
[8]ZHANG P,ZHANG L,CHENG S.Chemical structure and molecular weights ofα-(1→3)-D-glucan from Lentinus edodes[J]. Bioscience,biotechnology,and biochemistry,1999,63(7):1 197-1 202.
[9]TOMATIU,BELARDINELLIM,GALLIE,et al.NMR characterization of the polysaccharidic fraction from Lentinula edodes grown on olivemillwastewaters[J].Carbohydrate research,2004,339(6):1 129-1 134.
[10]ZHENG R,JIE S,HANCHUAN D,et al.Characterization and immunomodulating activities of polysaccharide from Lentinus edodes[J].International Immunopharmacology,2005,5(5):811-820.
[11]CARBONERO E R,GRACHER A H P,KOMURA D L,et al.Lentinus edodes heterogalactan:Antinociceptive and antiinflammatory effects[J].Food chemistry,2008,111(3):531-537.
[12]CHIHARA G,HAMURO J,MAEDA Y Y,et al.Fractionation and purification of the polysaccharides with marked antitumor activity,especially lentinan,from Lentinus edodes(Berk.)Sing.(an edible mushroom)[J].Cancer Research,1970,30(11):2 776-2 781.
[13]游丽君,邹林武,梁彦豪,等.超声-高温热水提取香菇多糖及其产物特性研究[J].现代食品科技,2013,29(9):2 167-2 172.
[14]张楷正,杨跃寰,李光辉,等.香菇多糖提取方法研究进展[J].四川理工学院学报:自然科学版,2009,22(6):63-66.
[15]郝 强,刘晓宇,冯 睿,等.香菇多糖的提取数学模型研究[J].食品科技,2008,32(11):87-89.
[16]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[17]余 华.海带多糖中蛋白质去除方法的对比研究[J].成都大学学报:自然科学版,2006,24(4):265-268.
[18]高石花,黎国庆,覃江克,等.油茶枯多糖的水提工艺及纯化研究[J].食品科技,2013,37(4):191-195.
[19]邓乾春,陈春艳,田斌强,等.化学发光法测定白果白蛋白的体外抗氧化活性[J].中草药,2007,38(5):685-690.
[20]梁 静,刘晓宇,邓碧云,等.红枣粗多糖的提取及抗氧化活性评价[J].食品科技,2012,36(1):177-181.
[21]王 悦,刘晓宇,邓碧云,等.用化学发光法研究红枣乙醇提取物的抗氧化活性[J].食品工业科技,2012,33(9):120-122.
[22]ZHAO Yaping,YUWenli,WANG Dapu,et al.Chemiluminescence determination of free radical scavenging abilities of‘tea pigments'and comparison with‘tea polyphenols'[J].Food Chemistry,2003,80(1):115-118.
[23]MAW,CAO E H,ZHANG J,etal.Phenanthroline-Cu complex-mediated chemiluminescence of DNA and its potential use in antioxidation evaluation[J].Journal of Photochemistry and Photobiology B:Biology,1998,44(1):63-68.
[24]GUO S,DENG Q,XIAO J,etal.Evaluation of antioxidantactivity and preventing DNA damage effect of pomegranate extracts by chemiluminescencemethod[J].Journal of agricultural and food chemistry,2007,55(8):3 134-3 140.
[25]程水明,刘 莹,梅光明,等.羧甲基获苓多糖的抗氧化活性研究[J].食品研究与开发,2013(3):1-5.
[26]WU J,CHEN S,GE S,et al.Preparation,properties and antioxidant activity of an active film from silver carp(Hypophthalmichthysmolitrix)skin gelatin incorporated with green tea extract[J].Food Hydrocolloids,2013,32(1):42-51.
Antioxidant Activity of Polysaccharide from Lentinus edodes Extracted by Acid Solution
MEIGuang-ming1,ZHANG Xiao-jun1,HAO Qiang2,et al
(1.Marine and Fishery Research Institute of Zhejiang Ocean University,Marine Fishery Research Institute of Zhejiang Province,Zhoushan 316021;2.Beijing Haiyan Pharmaceutical Co Ltd,Beijing 102206,China)
In this research,the foot body of Lentinus edodes was used as experimentalmaterial to extract crude polysaccharide SP and purified polysaccharide SP2 by dilute hydrochloric acid.The ability of SP and SP2 in scavenging activity against superoxide anion,hydroxyl radical,hydrogen peroxide and inhibiting oxidative damage of DNA were studied under chemiluminescence system.The reducing power of SP and SP2 was detected using VIS spectrophotometry,compared with VCand VE.Influence of SP and SP2 on mice erythrocyte hemolysis caused by H2O2-induced oxidation and autoxidation and antioxidant effects onmice in vivo were also studied.The results showed that SP and SP2 had good effects on scavenging superoxide anion,hydroxyl radicalsand hydrogen peroxide and inhibiting DNA oxidative damage.From the SC50values,the above effects for SP2 were weaker than SP,probably because of synergistic effect between polysaccharides with other sustances. With the ability of reducing power,it provided a basis for SP and SP2 with the antioxidant activity.SP and SP2 had inhibitory effects on mice erythrocyte hemolysis caused by H2O2-induced oxidation and autoxidation. The experiments in vivo showed SP and SP2 could reduced forming ofmalondialdehyde in liver tissue and enhanced the activity of superoxide dismutase in serum.The results provided a theoretical basis for development of functional foods of polysaccharide and comprehensive utilization of L.edodes.
Lentinus edodes;polysaccharide;antioxidant
TS201.4
A
1008-830X(2014)05-0406-08
2014-06-04
浙江省科技计划项目(2012F20026)
梅光明(1984-),男,湖北黄冈人,硕士,工程师,研究方向:食品加工与质量安全控制.
