关于改进作业设计的看法和建议之一
2014-11-04宋心琦
宋心琦

摘要:认为改进学生作业是一个值得着力解决的问题。列举了几个在初等化学教学中曾经和现在仍然存在的问题,依据化学学科的特点和基本概念介绍了一些看法,以丰富作业设计改革的内容和途径。
关键词:作业设计;物理变化;分散系;金属
文章编号:1005–6629(2014)9–0007–06 中图分类号:G633.8 文献标识码:B
继化学实验改革研讨之后,《化学教学》编辑部继而把改进学生作业问题的探讨提上了日程,我认为这是一个非常有远见的创议。由于作业是一个不可缺少的教学环节,同时又是存在着诸多差强人意的教学环节,因而是一个值得认真研讨的问题。虽然在广大教师中对此关注并不断进行研讨者不在少数,遗憾的是,由于缺乏有效的和研讨式的交流平台,老师们各自积累的丰富资料和有益经验,却因具有很高的分散性和局域性,难以实现更广范围的交流与共享。因此,有效地进行提炼和整合,是一个值得着力解决的问题。虽然在已颁布的中学化学(包括初中和高中化学)课程标准中,对学生作业的基本要求均有所提及,但是内容和要求却不像对学科知识和技能内容的要求那样具体,这和作业本身的特点有关,难以求全责备,从另一方面来看,也因此给广大教学研究人员和教师留下了深入研讨、创造和实践的空间。通过这个研讨活动,可以进一步激发广大教师的教学改革热情,更有效地实现师生互动,从而进一步地体现出教学改革的生命力和有效性,故而应当得到化学界及广大师生的支持和关注。
就中学化学教育来说,课堂教学和课(内)外作业,是相互依存和相互补充的不可分割的两个方面,但是二者的教育功能并不等同。这是因为课堂教学往往以教师的引导和启发为主,由于受到课时和学生人数的限制,学生的主动性难以充分发挥;作业的内容与预设要求虽然基本上也必须由课程标准、教材和任课教师设定,但是学生在完成作业时(特别是课外作业时),所需时间、思考方向、参考与问询的深度与广度等,均具有更大的自主性,因材施教的可能性和选择性都能够较好体现。如果允许学生在指定的学习或探索方向下具有更大的自由度,学生的兴趣和创新意识将得以提升。我们期望的所谓“举一反三”和通常说的“师傅引入门,修行在个人”将有可能成为现实。由此可见,作业的设计和学生完成作业过程的重要性不言而喻。
近期在《化学教学》上连续发表了多篇理论性文章[1,2,3,4],比较系统地阐述了在研讨有关问题时的几个主要方向,起了很好的指导引领作用,值得认真阅读和思考。学习之余,我认为在研讨这个问题时,还有一个方面的工作值得兼顾,那就是结合课程标准和教学来研讨和认定中学化学学科的核心概念和基本原理,并且主要在这个基础上进行作业设计和改革,也能有利于提高课程教学的有效性。根据个人的了解,就中学化学教学中的学科概念问题提出几个有关的看法和建议作为引玉之砖,希望经过老师的研讨和修正之后,能够为探讨作业设计改革提供一点参考。
1 化学物质物理变化的认识误区
什么是物理变化?指的是物质的物理性质(包括聚集状态)的变化,本来是一个简单的问题,但是由于过度思考,超越了化学学科,竟然成了一个模糊不定、众多争议的问题。以至于种种似是而非的习题进入了教材和教辅,甚至成为中考试题之一。它的后果是,使得刚刚接触化学的初中学生感到莫衷一是,有如陷入概念迷宫之中!虽然物理变化本身并非最重要的化学概念,而且化学教材在对物质的物理性质下定义时,并没有把物体所处的时间、空间,人为改变后的形状、质量或数量列入物理性质之中,但是并不表示大家对这个概念的界定达成了共识,这是一个值得澄清的学科概念。
化学是通过物质的性质以及在给定条件下性质的变化(包括物理变化和化学变化)来识别物质的,而且是在原子分子水平上来进行的。所以,化学认为水的三态间的互相变化属于“纯粹的”物理变化,因为水分子的组成和结构没有改变。而木料做成桌子、玻璃盆子摔成碎片等等诸如此类的事件在化学学科的视角下,都不能视为化学物质的物理变化。
试想,如果木材做成桌子、玻璃盘子摔成碎片都属于物理变化,那么火车开动、伸腿弯腰也都是物理变化了。其实这些仅仅包含着人为地改变物体形状、大小、单个物体的质量以及空间位置的事例,因为没有改变所涉及物质基本微粒的组成和结构,亦即木料的材质、玻璃的成分和内部结构都没有发生变化,因此它们的基本性质,包括物理性质和化学性质都不会发生变化。也就是没有发生化学变化和物理变化。其实在人们对“红木”家具、纯“棉”织物、“不锈钢”炊具等等的叙述中,已经隐含着材质不因加工而改变的认识啊。
产生这种争议的原因在于脱离了化学,忘记了化学是在原子分子水平上来认识、识别和鉴别物质的一门科学,当我们介绍物质的物理性质时,难道要附加它存在的空间位置和数量的多少吗?我们会认为在进行化学实验时所取试样的数量或形状会对认识物质的性质产生影响吗?会认为微型实验、常规实验以及工业规模下的同一种化学物质,以及它们在同一种反应中的化学本质应该有所不同吗?
物理变化概念的超越化学,不利于初学者牢固地把握与化学密不可分的微粒观的建立。何况微粒观对于初学者来说,因为无法亲身感知原本就感到抽象难懂啊!
最近见到一则介绍氧单质颜色的报告,可以说明科学技术的发展,能够不断地扩展人们对物质物理性质的认识范围,并且有效地弥补了依靠自身感知来认识物质的物理性质和变化能力的不足。供老师们参考。
附:多彩的氧(该信息取自《Scientific American》2012年的一篇报道)
我们知道空气中的氧是无色的,也许听说过液氧呈浅蓝色,但是不一定知道或想到氧还可以呈现为粉红色、橙黄色、红色、黑色,甚至于金属态。在常压下,液氧经冷却转化为固态时,晶体呈蓝色。当增加或降低所施压强时,由于发生相变,固态氧的结构和颜色随之而变。固态氧的物相目前已知的有6种:
(1)α-相:浅蓝色,形成于1 atm低于23.8K时,单斜晶系。
(2)β-相:淡蓝至粉红色,形成于1 atm低于43.8K时,斜方晶系(于室温和高压下转变为氧4分子tetraoxygen,O4)。
(3)γ-相:淡蓝色,形成于1 atm低于54.36K时,立方晶系。
(4)δ-相:橙黄色,形成于室温和压强为9 GPa时。
(5)ε-相:暗红至黑色,形成于室温和压强高于10 GPa时。
(6)ζ-相:金属态,形成于压强大于96 GPa时。
(7)O4为过渡态;O8是稳定的,呈红色;氧的金属态具有超导性。
2 为什么溶液成为初等化学中的一个重要知识点
有关溶液的知识点包括了溶液的形成、溶液的浓度、一定浓度的溶液的配制方法(包括配料计算和配制,以及容量瓶和天平的使用等),并延伸到化学物质的溶解度和饱和溶液(包括溶解度和温度的关系——溶解度-温度曲线的应用等),溶解过程和结晶过程等一系列知识点和实验。形成了一个知识结构完整、逻辑关系明晰的“知识板块”。只有明确了这个知识板块内知识点之间的逻辑关系,同时充分认识到有关溶液的知识在化学学科的学习和应用中的重要性,才能真正地组织好教学过程,而且其中有很多认知过程必须配合实验或实际生活中的体验才能真正地完成。
就一般的化学反应而言,在选定反应物之后,常用以调控反应进程(包括速率和产物)的手段,不外乎压强、温度、浓度和催化剂。由于催化剂需要通过繁复的筛选过程才能确定,并非唾手可得,而且目前还没有发现对于全部或大部分化学反应过程都有作用的催化剂,所以催化剂不能归入初学者经常使用的调控手段之列。于是在初等化学中,由于仪器设备的原因,能够演示压强对化学反应过程和结果的影响的体系寥寥无几,更多的时候是通过实际的事例(如氨的合成)和化学平衡计算研习来体现压强的作用。只有温度和浓度才是中学化学实验中最常用到的调控手段。依靠酒精灯或其他简单方法加热时,对温度的调控一般不要求精确,也不容易做到精确,唯有浓度,特别是溶液的浓度,才是比较容易实现、而且能够较为精确地对反应进程加以调控的因素。应当通过作业强化对浓度重要性的认识,不仅止于计算和换算。
其次,把体积庞大、容易因扩散而泄漏的气态反应物,和因接触面积小密度差别大、需要不断地进行强力搅拌的固态反应物,用适当的溶剂把它们转化为溶液后,既具有流动性,又可以使反应物以分子(或离子)状态,均匀地分散在溶剂之中,而且在溶液内的任何一处发生的反应,都可以代表整个体系,与所取溶液的体积无关(这就是在做实验时,更应当关注的是反应物的大致比例,而不是所取试剂溶液的体积。实验讲义上建议的用量,除考虑到反应物的计量关系外,还要求初学者逐步养成用尽可能少的试剂来完成实验的习惯,做到物尽其用)。因为溶液中的化学反应是反应物以分子或离子状态参加的反应,所以只有溶液的浓度才能最直接地反映出它们在发生反应时的有效浓度。以溶液状态进行反应时,反应体系的体积不是由所在容器决定,而是由溶液的体积决定的。在反应的整个过程中,虽然反应物和生成物的浓度一直在改变,但是每个瞬间的平均浓度将都有确定值。在研究反应的动态过程时,这是一个非常重要的特点,它意味着在所涉及的瞬间,浓度不仅可知,而且可以视为“不变量”。变量的减少,有助于减少实验结论的不确定性。
由溶液浓度延伸出来的溶解过程的自发性和溶解度概念,是化学中极为重要的概念。前者属于自然界的一个普遍存在的现象,它不仅是水源组成和所处地理环境密切相关的必然结果,也是半导体掺杂、合金热处理等工艺的理论依据。表现为溶质溶解和通过扩散达到在溶剂内均匀分布自发性(在高中化学选修模块“化学反应原理”中会把这个现象的本质理论化)。
在配制一定溶质质量分数的溶液时,要反复提醒学生注意观察和思考固体溶质溶解的自发性现象和液体溶质在溶剂中的自动溶解、混合、扩散和均一化现象,这是溶液和气体分散系以外的其他分散系(如悬浊液、乳浊液、胶体溶液,包括现实生活中遭遇的阴霾、雾霾、沙尘暴等)的基本区别。后者的形成,不仅往往要借助外力,而且形成的分散系属于热力学不稳定体系。在放置过程中,它们的分散均匀程度会自动下降(例如沙尘暴可以成为某个地域的环境问题,却不会成为全球性的污染源)。通过溶液和其他分散系在形成过程和稳定性的比较,可以加深对溶液的认识和了解溶液与其他分散系的根本区别。
在选定适当的溶剂后,物质的溶解过程虽然具有自发性,但是不同的物质在同一种溶剂中的“最大”溶解量并不相同,亦即存在着饱和现象[能够像水和乙醇、乙二醇、甘油(丙三醇)、乙酸等这样无限混溶的体系在初等化学中不是很多,可暂不考虑],于是根据溶液达到饱和时溶剂和溶质的数量(体积或质量,或物质的量)比率关系,演化成为溶解度的概念,并进一步得出溶解度与体系温度间的依变关系。有趣的是,从温度溶解度曲线可以看到,不同物质在水中溶解度和温度之间的关系及变化趋势并不完全相同,从而使得这种差别可用于物质分离和提纯,并成为一种普遍采用的方法。从溶解度概念到结晶法成为一种应用广泛的分离提纯方法,其间的逻辑关系和认知发展途径的脉络,十分清晰。这种思维训练,在初等化学教学中,是非常难得的学科载体之一。如果只关注溶液浓度换算、溶解度计算和容量瓶配制一定质量浓度的溶液实验中的基本操作,而不是把它们之间的逻辑关系理顺,学生可以学到一个个孤立的知识,却难以真正领会这个知识板块所包含的极为丰富的学科内容和科学教育的内涵。应当承认,以往的作业设计和要求在这方面是需要进一步关注和强化的。
3 关于分散系的识别问题
分散系在初等化学阶段,并不是一个重要的化学知识点。但却是一个和学生日常生活密切相关的知识点,因而也是一个便于设计学科作业的知识点。
在介绍关于分散系的基本知识时,如果注意到通过加强对溶液知识的学习与理解,同时通过溶液和其他分散系的根本区别来强化对溶液体系的认识,反而有利于对其他分散系的了解。如若不能做到这点,不能厘清它们以及它们和溶液体系之间的差别与联系,各类分散系便会成为一个个孤立的知识点。日常生活中存在的分散系很多,形式和种类丰富而且便于感知,当学生在学习有关知识后,能够从化学的角度来认识和分析周围有关的分散系,如有关气象、大气污染、污水净化到生活中经常遇到的悬浊液、胶体溶液等。包括墨水、胶水、泥浆以及膨化制品和食品等。通过对它们的制备、应用和存放条件等的分析和了解,将有助于获得科学技术源于生活但又高于生活的体验。
从分散系形成时的自发性和非自发性来区分真溶液和其他分散系,属于化学学科的基本要求,也是选择或了解制备目标分散系工艺方案的基础。建议强化这方面的作业(包括实验、习题以及有针对性的讨论和探究)。溶液之外的其他各类分散系,基于它们的不稳定性(或介稳性),有关加速破坏或延缓其“稳定性”的方法和效率,都可以成为学生作业的内容。包括学习有关资料和动手进行探究等方面。
丁达尔效应是胶体溶液(包括气溶胶在内)因分散质粒子对入射光的散射而产生的光学效应。是否出现光柱和光柱的颜色,取决于分散质粒子的直径大小和分布。由于胶体分散系中胶粒产生的散射光频率恰好处于可见光的范围,当粒度分布范围较广时,多种频率并存的散射光最后合成为白光。如果能够使得胶体溶液中的胶粒粒度局限在某个较窄的范围内,散射光可以成为有色光,甚至散射出较纯的单色光。当溶液体系中的溶质分子具有类似于胶粒的粒径(例如聚合度适当的高分子化合物在溶剂中形成的分子溶液,常见的如聚乙烯醇的水溶液)也可以观察到丁达尔效应。而且已经发展成为测定高分子化合物平均分子量的有效方法。所以丁达尔效应不能作为分散系是否一定是胶体溶液的依据,就这个问题,可以设计出多种形式的饶有趣味的作业。
附:美国加州大学Riverside分校的三位华人化学家发现,可以利用外磁场强度的变化,改变纳米Fe3O4(用聚丙烯酸修饰后带有负电荷)胶体溶液中胶粒的聚集状态,从而显示出不同的色彩[5]。据认为有可能成为一种工艺和结构都非常简易的显示器件。丁达尔效应成为实现磁致变色体系的核心技术,不仅非常有趣,而且可能发展成为能耗和维护成本极低的一种新技术。图1为该研究小组提供的试验结果。
由这则科技信息,可以提高学生对分散系和胶体溶液的学习质量和兴趣,也可以为设计不同层次的化学作业提供事实依据和实验探究方案的参考。
(1)为什么Fe3O4胶粒的聚集状态可以用外磁场强度来调控?
(2)为什么这种体系必须是胶体体系?
(3)胶粒的聚集状态改变为什么能够改变体系在高亮度白光照射时所显示的颜色?
4 化学反应激烈程度和金属化学活泼性关系没有必然的相关性
初等化学的主要任务是进行化学学科的启蒙教育,它之所以必不可少,在于它的研究对象、研究方法和学生已经学过的物理学、生物学,以及不太系统的天文学和自然地理学有所不同。化学以和人类社会的物质生活紧密相关的化学物质为主要研究对象。这里所说的化学物质,不仅包括已经存在于自然界的化学物质,还包括自然界并不存在的,由化学家以现有物质为原料制造出来(或可能制造出来)的新物质,而且后者的数量和所能体现的功能可能远远超出前者。所以化学研究不仅着力于发现,还致力于创造,最能体现出人类的智慧和创造力!更为令人感到神奇的是,对于数量近于天文数字的化学物质,其组成和结构的研究可以归结为对总数百个左右化学元素性质的认识和反应性能的调控。化学元素之间的结合规律-化学键理论并不复杂,当化学物质的组成比较复杂时,组成元素原子之间的空间排布对原子之间相互作用的影响,化学结构理论,也不很复杂。化学键理论和化学结构理论可以帮助我们认识或预见化学物质间存在差异性的物理因素,但是至今尚无法对这种差异导致的物理性质和化学性质的差别做出比较完备而且可靠的判断或推测。所以化学的学科研究工作中除去理论方法的研究外,无不依赖实验工作来完成,这是化学至今仍然是一门实验性科学的原因。
基于以上的原因,由于化学物质数量庞大,反应类型虽然屈指可数,但是反应过程及产物却对外界条件甚至反应物本身的状态(例如固体的分散程度、溶液的浓度等)十分敏感,甚至近乎无规律可循的情况。这从另一个角度表明了化学是一门正在发展中的科学,是一门基于百十个化学元素而作为研究对象的化合物却可能达到1014量级[6](目前已知的化合物数仍在107的量级)的科学,因此从组成结构和性质间都存在差异的近乎天文数字的研究对象中,探索具有普适性的客观规律是一项正在进行且远未完成的艰巨任务。众多的机会和严峻的挑战,意味着化学是一门正在蓬勃发展的基础科学,也正是化学引人入胜之处。对于初学者而言,涉及的化学知识和化学物质并不很多,可是很难做到像初等物理学那样依据为数不多的基本定律,就可以认识并探究大量相关的物理现象。这是初等化学教学中应当着重研究和力求解决的问题。也许是为了减轻学生学习时出现的困惑,很多没有经过大量实验证实的、以偏概全或概念模糊的所谓“规律”,在正式教材中虽然罕见,但在坊间出版的教辅一类学习材料之中却屡见不鲜,甚至于自诩为“应试宝典”。这种做法,不仅不能真正解决初等化学教学中的困惑,由于模糊了对化学学科任务和方法的认识,对于化学教学特别是后继课程的学习将会导致不必要的困扰。把“例外”作为某些“规律”失效时的借口和师生们此时感到尴尬的心态,只会留下事与愿违的遗憾。我认为在解决这个问题的过程中,厘清学科概念和某些规律的理论或实验依据是关键的一步,应当引起我们的重视。只要我们肯面对问题,有关的实例并不难找到。不要把金属活泼性和反应激烈程度理所当然地直接相关联,就是其中的一例。
金属活动性顺序在初等化学中是一个有趣、而且运用时比较容易得心应手的重要知识点。首先因为元素周期表中金属元素的数目远远超过非金属元素,除汞之外,它们的单质在通常条件下均呈固态,可以直接观察和测量;其次因为它们的盐溶于水中后大都会发生电离,这时将以离子形式存在。用简单的试管实验,就可以通过A金属元素的单质是否能够对B金属元素的离子发生置换反应来比较A和B金属的氧化还原性(或曰金属活动性)的强弱。置换反应发生时,产物首先沉积在金属性较强的金属表面上,底物表面和置换产物的形貌、颜色,甚至于变化过程都可以清晰地观察到,足以引起实验者极大的兴趣。由此扩展得出的包括十几个常见金属元素的金属活动性顺序,不仅应用起来得心应手,读来更是琅琅上口,便于记忆。因而成为初中化学中最为师生喜爱的一个知识点。
在综合几个典型的金属置换反应的实验现象时,教学中把金属活动性和置换反应发生时的“激烈程度”相关联的做法很普遍,甚至认为二者存在必然的相关性。虽然实验中确实可以观察到金属钠和水作用时的“激烈”和锌、铁置换硫酸铜或硝酸银中的铜或银时的“平静和缓”,以及在和盐酸作用时,锌片上产生氢气的“激烈程度”可能高于铁等等。似乎上述的关联并没有什么问题,反而有利于学生强化对金属活动性顺序的记忆。但是从化学学科概念来看,尽管上述实验现象都是事实,仍然应当承认这种关联在基本概念上是不存在的,即反应激烈程度和金属化学活动性没有必然的相关性。先入为主的错误认识,会对后继学习产生负面的影响。值得引起我们的注意。
从实验中得出的金属活动性顺序,在电化学完成了对氧化还原电势的理论构建和实验测量方法的规范化之后,得到了证实和完善。不仅对原有顺序作了必要的调整,而且使得一些无法通过简单置换反应进入金属活动性顺序的金属元素找到了它们在序列中的“位置”。此外还可以通过简单的计算确定金属离子浓度、温度和介质酸碱性对金属元素在序列中位置的影响。
氧化还原电势的差别,是推动电子发生定向转移的推动力,相当于初等化学中所说的“活动性”。但是反应速率(反应激烈程度)却是由单位时间内氧化剂从还原剂得到的电子数量决定的。亦即和固态反应物的表面状态(包括少量外来或内含杂质的种类及分布,产物形态等)有关,二者并不存在必然的相关性,例如(还原)铁粉不仅在酸中能够迅速溶解,甚至在空气中可以自燃,改用质量相同的铁片或铁屑时,在相同的条件下就观察不到类似的现象)。和电池放电情况相似,两极间的电流值的大小是由外电阻的高低决定的。并非电池两极电势差越大,电流值就一定越大。所以应当严格区分决定金属元素的氧化还原电势差的热力学因素,和影响反应速率的动力学因素。类似的情形在日常生活中也可以找到,由此可见,区分事物的起因和过程,分别采取不同处理方法的思维训练,有利于提高学生的科学素养。三维教育目标在此也得以体现。
如果对于金属活动性顺序的认识,仅限于比较金属单质及其离子氧化还原能力的强弱,以及对给定的置换反应是否能够实现做出判断,是不够的。它还可以用于无机制备方案的设计,例如利用金属置换反应制备氢气时,什么时候可以选择水作为氢源,什么时候可能要用盐酸或稀硫酸,以及哪些金属是无法实现这个反应的等,都和金属在活动性顺序中的位置直接相关。其次,初中化学对金属单质的制备方法是分别进行的,如水溶液中实现的置换法(水法冶金工艺之一);用碳在高温下还原金属氧化物的方法(火法冶金工艺之一);以及在水溶液或非水溶液中通过电解制备金属的方法,前者如电解硫酸铜溶液制铜,后者如电解溶于冰晶石熔融液中的氧化铝制铝或电解熔融氯化钠制钠等(电冶金工艺),大致涵盖了制取金属的几类基本方法。如果把这些个例和金属活动性顺序相关联,不仅可以对零散知识进行整合,还可以对这几种方法还原能力的强弱获得初步的认识。在遇到那些在金属活动性顺序表中没有列入的金属元素时,由制备工艺可以推测它的活动性和表中哪些金属大致相近;反之,从某个金属元素在周期表中的位置,其单质的制备方法可以由邻近元素的制备方法获得启示。应当注意到,在上述制备方法中,电解法是一种普遍适用的方法。电解方法的氧化还原能力源于与化学物质无关的外加电势,它并非来自“天赐”,而是人类智慧的产物。科学技术对社会进步的价值在此体现得最为突出。由此可见,金属活动性顺序的学习对氧化还原反应的理解应用,可以起到以纲举目张的作用。
5 AB合金的熔点不一定比A金属和B金属都低,钢比铸铁更容易发生电化学腐蚀
在初等化学课程标准中,合金是一个附属于金属概论中的知识点,要求很低,通常限于初步认识的水平。但是在实际生产和日常生活中,直接用于生产与生活的纯金属制品很少,合金却占了主要的份额。所以这又是一个不可或少的知识点,而且经常出现于作业之中。
两种或两种以上的金属元素(或以金属为基添加其他非金属元素)通过合金化工艺(熔炼、机械合金化、烧结、气相沉积等等)形成的金属材料叫做合金。有些合金可能只含有一种金属元素,如钢(钢是对含碳质量百分比介于0.02%至2.00%之间的铁合金的统称)。
确有很多种合金熔点低于组成金属单质,例如大家熟知的锡铅合金,但是这不是所有合金的通性。比较合适的说法应该是多数合金熔点低于其组分中任一种组成金属的熔点。以偏概全的问题,值得注意。
由金属元素以及金属元素和部分非金属元素(如硼、碳和硅)形成的合金相,共有3种基本的形式,即:低共熔体(混合物)、固体溶液和金属间化合物。三者之中只有形成低共熔体的合金相,才具有熔点低于组成金属单质的特点(例如用于焊丝和熔断丝制造的锡铅合金)。当组成金属元素的原子半径相近,单质的晶格相近,组成元素的化学性质相近时,它们可以形成固体溶液形式的合金相。固体溶液形式的合金相,熔点介乎组成金属单质熔点之间(例如银铜合金、铋镉合金等),其数值因组成比率而改变。形成金属间化合物的合金相,熔点往往高于组成金属的单质(铜、锌组成的黄铜)。最突出的如具有高熔点、高硬度的过渡金属元素与碳、硼或硅形成的金属间化合物相(在材料科学中归于金属陶瓷类)。铁水急冷生成的白口铸铁的高硬度和脆性以及碳素钢的机械强度远高于纯铁,都和其中含有由Fe3C组成的渗碳体相有关。
合金材料中有的只包含上述3种物相中的一种,包含两种或三种合金相的金属材料则更为普遍,所以合金的性质虽然和组成中的金属元素有关,却主要决定于它们的相组成和相结构。虽然在叙述上和化学物质的性质取决于组成和结构相似,二者却存在着宏观与微观之间的差别。也许二者在探究角度上有相通之处,但是视角与着眼点却相去很远。这是学习过初等化学甚至大学化学的学生,在学习材料科学时容易感到难以跨越的主要原因。我认为在中学化学教学中,包括在作业中不应当对此有所要求,但是不能用简单的、以偏概全的结论来阐述合金的性质。作为教师,也许对与钢铁有关的铁碳相图有初步的了解是有益的。这样在讲述钢铁的冶炼、基本类别和性质时,比较容易做到恰如其分。
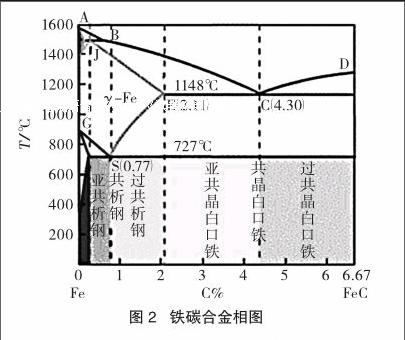
图2是一张经过适当简化的铁碳合金相图。
ABCD曲线上方为铁与碳形成的液相区,可以看成是碳在铁水中的溶解度曲线。通过E点的竖线是钢和铁的分界线(此时碳含量为2.11%)。BC曲线与JEC构成的相区是铁与碳形成的固体溶液相。当C含量为4.30%时,合金具有最低熔点(1148℃)冷凝时形成低共熔相,此时铁与碳各自形成自己的晶体,前者为相(体心立方晶格),后者为石墨,断口呈灰白色,即灰口铸铁。如果铁水急冷,上述结晶来不及完成,得到的是Fe(面心立方晶格)和碳形成的渗碳体(Fe3C)相。因为没有生成石墨相,所以材料断口呈银灰色,即白口铸铁。过S点竖线的钢水熔点约1480℃,冷却至727℃时,形成和渗碳体两相共存的共析组织。
相图内容极其丰富,难以尽述。但是至此可以得出一个结论,那就是钢中不存在石墨相,所以在推测与比较钢和铁的电化学腐蚀时,不能用含碳量作为依据,误认为铸铁比钢更容易腐蚀。事实上铸铁比钢更耐腐蚀,合理的解释应当是Fe-Fe3C电对和Fe-C电对的差别所致。
有兴趣的老师不妨找本金属学、炼铁炼钢学一类的教科书或科普小册子作为参考。材料的性质往往可以通过相组成和相结构来调制(形状记忆合金只是一个例子),这种情况不只限于金属材料,在陶瓷和高分子材料科学技术中都可以找到实例。有关思路和改变物质的性质可以通过改变组成和结构来实现的化学观点如出一辙,只不过一个立足于宏观(材料),另一个则立足于微观(原子分子)而已。学习科学和科学地学习有益于提高人的智慧,由此再次得到有力的证明。
参考文献:
[1]吴俊明.进一步研究和搞好练习设计的几点思考[J].化学教学,2014,(2):3~6.
[2]吴俊明,吴敏.为什么要关注科学观念—关于科学观念和科学观念教育的思考之一[J].化学教学,2014,(4):3~6.
[3]吴俊明,吴敏.化学课程中的科学观念教育—关于科学观念和科学观念教育的思考之二[J].化学教学,2014,(5):3~6.
[4]吴俊明,吴敏.元素概念的演变与化学元素观的教学—关于科学观念和科学观念教育的思考之三[J].化学教学,2014,(6):3~7.
[5] Philip Ball. What Chemists Want to Know [J]. Nature,2006:500~502.
[6] Jianping Ge,Yongxing,and Yadong Yin. Highly Tunable Superparamagnetic Colloidal Photonic Crystals [J]. Angew. Chem. Int. Ed. 2007,(46):7428~7431.
