单核细胞增多性李斯特菌对人、鼠脑微血管内皮细胞黏附、侵袭、增殖差异性分析
2014-11-02邓兴梅魏丽马勋蒋建军于佳佳吴学林
邓兴梅,魏丽,马勋,蒋建军,于佳佳,吴学林
(石河子大学动物科技学院预防兽医学重点实验室,石河子 832003)
李斯特菌(Listeria)是一种胞内食源性人畜共患致病菌,目前国际上公认的李斯特菌共有7个种,即单核细胞增多性李斯特菌 (Listeria monocytogenes,LM)、默氏李斯特菌(L.murrayi)、伊氏李斯特菌(L.iuanuii)、无害李斯特菌(L.innocua)、威尔斯李斯特菌(L.welshimeri)、塞氏李斯特菌(L.seeligeri)、格氏李斯特菌(L.grayi)[1],其中LM是最常见也是最重要的食源性人畜共患病病原,临床上该菌主要引起人和动物严重的败血症、脑炎、脑膜脑炎、流产等症状,L.seeligeri主要引起反刍兽的感染,常表现为败血症和流产,一般不引起脑炎,其余种均被认为是非致病种,但 L.seeligeri[2]、L.seeligeri[3]也可引起人严重菌血症、化脓性脑膜炎。
LM除可在吞噬细胞内增殖外,还在其他细胞中增殖,其入侵方式主要靠LM与细胞之间的相互作用,从而进入细胞内[4]。LM进入非吞噬细胞是通过一种拉链模式来实现,在这一过程中LM表面蛋白与细胞膜表面蛋白相互作用,使LM逐渐陷入到细胞内,形成一种胞囊结构[5]。由于LM可以侵入不同组织细胞,因此有学者推测其表面存在着不同的配体,这些配体可以与不同细胞上受体相结合,从而使细菌侵袭细胞,完成入侵过程。血脑屏障是LM引起脑膜炎、脑炎必须穿越的屏障[6],目前对于LM跨越血脑屏障的研究主要通过建立感染小鼠脑炎模型观察病变特征[7],体外血脑屏障研究则主要是脑微血管碎段模型、脑微血管内皮细胞模型、脑微血管内皮细胞和星形胶质细胞共同培养模型[8],而培养脑血管内皮细胞是目前国内外常用的血脑屏障模型。
本实验通过LM感染脑微血管内皮细胞,体外模拟LM穿过血脑屏障,测定其对脑微血管内皮细胞黏附、侵袭力及胞内增殖速度,以期为研究LM跨越血脑屏障机制提供参考,同时为探究李斯特菌引起人和动物脑炎、脑膜脑炎机理奠定基础。
1 材料与方法
1.1 材料
LM90SB2为本实验室分离鉴定的致新疆绵羊脑炎分离株,LM3、LM4、L.seeligeri(LS)为实验室保存,L.innocua为购自 ATCC 菌株 (ATCC33090),鼠脑微血管内皮细胞(MBMEC)购自广州吉妮欧生物科技有限公司,培养液高糖DMEM购自Hyclone,FBS购自Gibco,原代人脑微血管内皮细胞(HBMEC)及培养液(ECM)购自ScienceCell,细菌培养基BHI购自北京路桥公司。
1.2 方法
1.2.1细菌悬液制备
将-80℃保存的菌种解冻后,划线接种于BHI平板,置于37℃恒温培养箱,24 h后挑取单个菌落,接种于含5 mL BHI液体培养基试管内,37℃恒温180 r/min摇床增菌。16 h后取出,放入1.5 mL无菌离心管 6000 r/min,离心 2 min,灭菌 1×PBS 洗涤 2 遍,调整 OD600至 0.12 左右(约 1×108cfu/mL),用细胞培养液DMEM进行10倍稀释。
1.2.2细胞培养
在无菌操作台内将脑微血管内皮细胞置于25 mL细胞瓶,加入5 mL完全培养液(鼠脑微血管内皮细胞:高糖 DMEM,1%P/S,15%FBS;人脑微血管内皮细胞:ECM,1%ECGS,1%P/S,5%FBS),细胞置于37℃,5%CO2隔水式恒温培养箱中培养。2次传代,计数后将细胞稀释至4×105个/mL,加入24孔细胞培养板,每孔加入细胞稀释液0.5 mL,5%CO2培养箱中培养,细胞长至约80%时进行粘附侵袭等试验。
1.2.3侵袭、黏附、增殖试验
1.2.3.1 细菌黏附试验
将长至80%左右的细胞用PBS洗涤2遍,每孔加入 300 μL 1.0×107cfu/mL 细菌悬液,每个菌株做3个重复,空白对照加入无细菌细胞培养液。37℃和5%CO2条件下感染1 h。灭菌PBS洗3遍,每孔加入100 μL 0.5%Triton X-100,裂解10 min反复吹打,吸取裂解悬液至1.5 mL离心管后,再加100 μL PBS冲洗孔内残留细菌,将收集裂解液做10倍递增稀释,BHI平板法细菌计数,试验重复3次。
1.2.3.2 细菌侵袭试验
用以上相同方法感染细胞1 h,灭菌PBS洗3遍后,每孔加入加入 300 μL 100 μg/mL 庆大霉素细胞基础培养液作用40 min以杀灭细胞外细菌,PBS洗涤3次后,按以上方法裂解细胞,BHI平板法计数,试验重复3次。
1.2.3.3 胞内增殖试验
按照1.2.3.2中的方法,经100 μg/mL庆大霉素处理后,PBS洗涤2次后,再换含10 μg/mL庆人霉素的DMEM培养液(2%胎牛血清)继续培养,分别在 2、4、6、8、10 和 24 h 裂解细胞,收集裂解液做平板计数,试验重复3次。
1.2.4数据处理
统计每组BHI平板计数结果,细菌黏附力计算公式为:(胞内细菌数+胞外细菌数)/加人孔内的细菌数×100。
侵袭率计算公式为:胞内细菌数/加入孔内的细菌数×100。
细胞内增殖则用不同培养时间段(2、4、6、8、10和24h)细胞裂解计数结果取对数表示。
采用t检验对5株菌黏附、侵袭率和细胞内增殖数据进行统计学分析。
2 结果与分析
2.1 不同菌株的脑微血管内皮细胞黏附率
由表1、图1可见:所有测试的菌株/种其黏附HBMEC的能力(7.83%~2.45%)均大于黏附MBMEC(4.48%~1.59%), 但统计学检验差异不显著 (P>0.05)。3个 LM菌株的黏附能力均大于 LS、ATCC33090 参考菌种,其中 LM90SB2、LM3、LM4 黏附MBMEC的能力与 ATCC33090差异显著 (P<0.05),LM90SB2 与 LS 差异显著(P<0.05),其他菌株与LS差异不显著,但是3个LM菌株黏附HBMEC的能力与ATCC33090和LS差异均不显著。
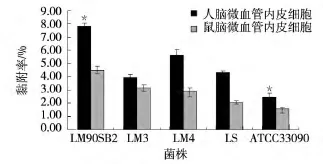
图1 不同菌株对脑微血管内皮细胞黏附率Fig.1 Adhesion rate of different listerial strains with BMEC
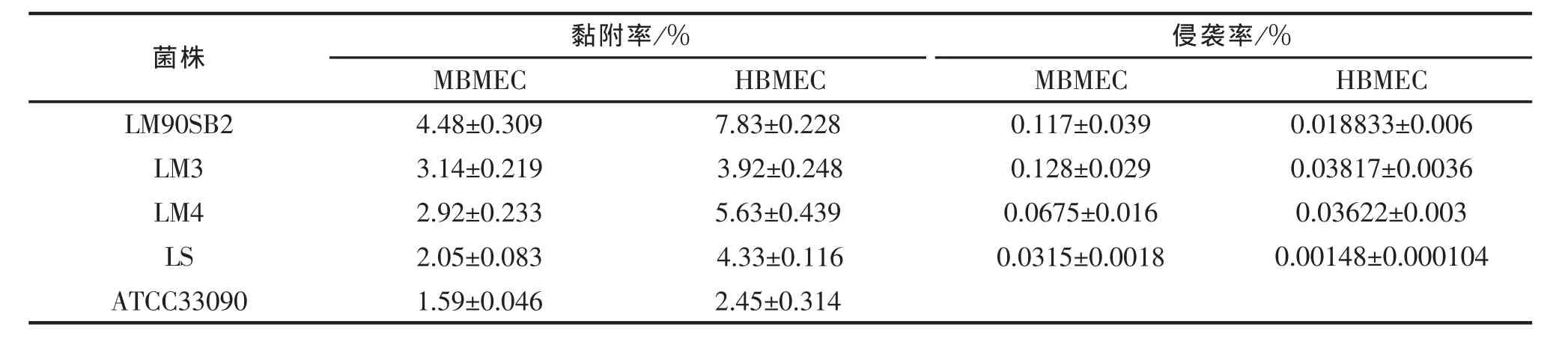
表1 李斯特菌菌株对脑微血管内皮细胞黏附、侵袭率Tab.1 Adhesion and invasion rates of listerial strains with BMEC
2.2 不同菌株对脑微血管内皮细胞侵袭率
由图 2可见:LM90SB2、LM3、LM4对 MBEC 侵袭率从0.0188%到0.128%不等 (表2),ATCC33090不 侵 袭 MBEC。 LM90SB2、LM3、LM4 对 MBMEC/HBMEC侵袭率均大于LS, 且差异显著 (P<0.05),LM90SB2、LM3、LM4之间细胞侵袭率差异不显著,但同株LM对人/鼠脑微血管内皮细胞侵袭率均差异显著(P<0.05)。
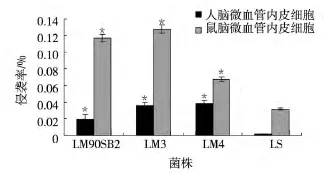
图2 李斯特菌不同菌株对脑微血管内皮细胞侵袭率Fig.2 Invasion rate of different listerial strains with BMEC
2.3 LM不同菌株在脑微血管内皮细胞内增殖差异情况
2.3.1 LM在鼠脑微血管内皮细胞内增殖
由图3可见:菌株进入MBMEC 2 h后开始出现增殖趋势,其中LM90SB2在4 h时细菌菌量迅速升至1.2×102CFU/mL,所有菌株大约在8 h时细胞内菌量达到峰,菌量分别为LM90SB2:1.67×104CFU/mL、LM3:1.33 ×104CFU/mL、LM4:4.4 ×103CFU/mL,之后菌量开始呈下降趋势,LM3、LM4下降趋势较为明显,LM90SB2则缓慢下降。LS在整个增殖过程中趋势平稳,菌量未增加。
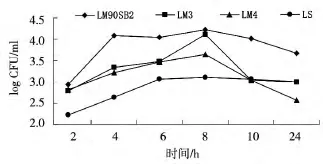
图3 不同菌株在鼠脑微血管内皮细胞内不同时间段增殖Fig.3 The intracellular proliferation of different listerial strains in MBMEC at different time
由图4可见:在细胞内整个增殖过程中,不同菌株都能产生一定的细胞病变,细胞变圆,细胞内出现空泡,细胞边缘不整齐,细胞漂浮直至裂解,但各个菌株在同一时间MBMEC病变无明显差异。
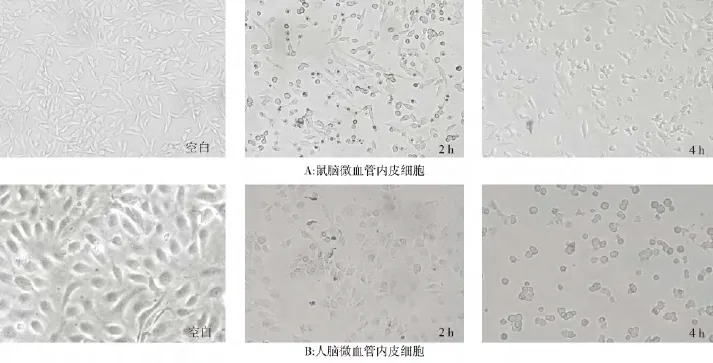
图4 LM90SB2不同时间段对人/鼠脑微血管内皮细胞病变图Fig.4 The typical picture of CPE for LM90SB2 invading HBMEC/MBMEC at different time
2.3.2 LM在人脑微血管内皮细胞内增殖
由图5可见:菌株进入HBMEC内4 h后开始出现增殖趋势,时间比在MBMEC中出现增殖趋势推迟2 h,各菌株在约6 h时达到最大菌量,峰值菌量分别为 1.34×104CFU/mL (LM90SB2)、4.57×103CFU/mL(LM3)、1.48×103CFU/mL(LM4),之后 LM90SB2 菌量处于平稳趋势,LM3、LM4的菌量下降。LM4菌量下降后在10 h时出现第2次峰值,但该菌在同一时间段产生细胞病变能力远小于其它菌株。
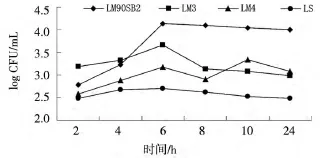
图5 李斯特菌不同菌株在人脑微血管内皮细胞内不同时间段增殖Fig.5 The intracellular proliferation of different listerial strains in HBMEC at different time
3 结论与讨论
本实验用 2种 BMEC:HBMEC (原代细胞)、MBMEC(传代细胞)体外建立LM穿过血脑屏障模型,用L.seeligeri、L.innocua做参考,在细胞水平检测单增李斯特菌LM90SB2、LM3、LM4黏附、侵袭BMEC能力差异及在细胞内增殖能力。
LM90SB2、LM3、LM4各菌株对BMEC黏附率虽有不同,但差异并不显著;同一菌株对HBMEC黏附率大于MBMEC,差异也不显著,该结果表明LM各菌株对BMEC黏附率并无差异,这一结果与Olivier Moroni等[9]用15种来源不同LM以及L.ivanovii LSD5、L.seeligeri LSD11、L.welshimeri LSD12、L.murrayi LSD14黏附HT-29(结肠癌细胞)、Caco-2 cells(人克隆结肠癌细胞)实验结果基本一致。目前普遍认为黏附是细菌与细胞相互作用的第一步,细菌主要通过纤维连接蛋白介导与细胞黏着,这一过程无种间及细胞间差异性[10]。
细菌与细胞作用的第2步则是侵袭,侵袭细胞能力是细菌毒力大小的有效外在表现[9]。虽然L.innocua(ATCC33090)黏附 BMEC,但其并不侵袭 BMEC;LS黏附并侵袭BMEC,但其侵袭能力小于LM90SB2、LM3、LM4,且差异显著。伊娜娜等[11]在分析LM菌种重要毒力因子分子特征和遗传变异时指出,不同来源LM毒力基因同源性各异,毒力基因进化关系不一致。这可能是导致本实验中LM不同菌株其黏附能力和侵袭能力存在一定差异的原因之一。LM90SB2、LM3、LM4虽然黏附HBMEC的能力大于黏附MBMEC的能力,但是侵袭试验结果显示,LM侵袭MBMEC的能力远大于HBMEC,且差异显著。侵袭试验结果不仅表明黏附率与侵袭率无正相关性,而且提示LM对不同来源的同种类型细胞的侵袭率不同。Jaradat等[12]在用25株LM对Caco-2 cells(人克隆结肠癌细胞)黏附力与侵袭力相关性试验中指出,LM对Caco-2 cells黏附力与侵袭力相关性较低,并指出LM在侵袭宿主细胞的过程中,涉及到更多细菌毒力因子以及细菌表面蛋白——内化素与决定宿主细胞特异性相互作用的不同受体。有研究[13-14]表明LM在侵袭宿主细胞的过程中,涉及很多细菌表面蛋白和宿主细胞特异性受体。鉴于这种机制,我们推测:同株LM对不同BMEC侵袭率的差异可能和不同动物脑微血管内皮细胞表面与细菌表面蛋白相互作用的受体数量或类型不同有关。比如,上皮细胞钙粘蛋白E-cadherin是内化素蛋白InlA的主要受体,在许多细胞如肝细胞、树突状细胞、脑部毛细血管、上皮细胞以及胎盘绒毛膜上皮细胞的表面都存在该受体[15];C-Met是InlB细胞表面受体[16]。
李斯特菌不同菌株进入BMEC后均有不同程度增殖,菌量达到高峰后会下降,其原因可能是细菌自身通过某种机制控制在细胞内的数量,使细胞仍保持一定活力,从而使细胞作为LM的载体,协助细菌的扩散和进一步繁殖。LM各菌株在BMEC内增殖速度及最大菌量不同,临床分离致病株LM90SB2在BMEC内增殖速度和菌量明显高于其它菌株,这可能与其不同毒力因子在细胞中的表达不同有关,同时也有可能和不同动物源细胞内与毒力因子互作的蛋白有差异有关。这点需要进一步进行LM90SB2重要毒力因子分子特征和遗传变异,以及细胞表面相应受体类型和数量以及细胞内信号转导的研究。
[1]陆承平.兽医微生物学[M].3版.北京:中国农业出版社2011:303-305
[2]Perrin M,Bemer M,Delamare C.Fatal case of Listeria innocua bacteremi a[J].Journal of Clinical Microbiology,2003,41(11):5308-5309.
[3]Rocourt J,Hof H,Schrettenbrunner A,et al.Acute purulent Listeria seelingeri meningitis in an immunocompetent adult[J].Schweizerische Medizinische Wochenschrift,1986,116(8):248-251.
[4]崔焕忠,乔立桥,王义冲.单核细胞增生性李斯特菌的主要毒力因子及其致病机理[J].中国畜牧兽医,2010,37(1):128-133.
[5]Pizarro Cerda J,Cossart P.Bacterial adhesion and entry into host cells[J].Cell,2006,124(4):715-727.
[6]LecuitM.Understanding how Listeria monocytogenes targets and crosses host barriers[J].Clinical Microbiology and Infection,2005,11(6):430-436.
[7]郑德良,马勋.单核细胞增多性李斯特菌人工感染小鼠致其脑炎模型的建立及优化[J].中国兽医学报,2013,33(7):1032-1036.
[8]李珺,彭亮,黄胜和,等.体外血脑屏障模型的建立及发展[J].广东医学,2009,30(4):647-648.
[9]Moroni O,KheadrE,BoutinY,etal.Inactivationofadhesionand invasionoffood-borneListeriamonocytogenesbybacteriocinproducing Bifidobacterium strains of human origin[J].Applied and Environmental Microbiology,2006,72(11):6894-6901.
[10]Gilot P,AndréP.Listeria monocytogenes possesses adhesins for fibronectin[J].Infection and Immunity,1999,67(12):6698-6701.
[11]伊娜娜,李巍,张子群,等.三株不同毒力单增李斯特菌第一毒力岛基因全序列的克隆及遗传变异分析[J].中国兽医科学,2013,43(6):565-571.
[12]Jaradat Z W,Bhunia A K.Adhesion,invasion,and translocation characteristics of Listeria monocytogenes serotypes in Caco-2cellandmousemodels[J].Applied and Environmental Microbiology,2003,69(6):3640-3645.
[13]Cabanes D,Dehoux P,Dussurget O,et al.Surface proteins and the pathogenic potential of Listeria monocytogenes[J].Trends Microbiol,2002,10:238-245.
[14]Bierne H,Cossart P.Listeria monocytogenes surface proteins:from genome predictions to function[J].Microbiol Mol Biol Rev,2007,71:377-397.
[15]Pizarro Cerdá J,Jonquières R,Gouin E,etal.Distinct protein patterns associated with Listeria monocytogenes InlA-or InlB-phagosomes[J].Cellular Microbiology,2002,4(2):101-115.
[16]Khelef N,Lecuit M,Bierne H,et al.Species specificity of the Listeria monocytogenes InlB protein[J].Cellular Microbiology,2006,8(3):457-470.
