金纳米团簇荧光探针的合成与生物检测应用
2014-11-02谈立伟冯大千刘国良
陈 萌,谈立伟,许 娜,冯大千,刘国良,王 伟
(1.南京工业大学 理学院,江苏南京 211800;2.盐城工学院 化学与生物工程学院,江苏 盐城 224051)
纳米生物技术是整合了纳米技术、生物学、生物化学和医学等的交叉学科,在医药卫生领域有着广泛的应用和明确的产业化前景。在过去的几十年,纳米材料在生命科学领域中有诸多应用,特别是利用荧光纳米材料作为荧光标记物在生物学中的应用发展是一个特别有吸引力的研究领域[1]。目前为止,研究人员已经开发出多种不同类型的荧光纳米材料,包括半导体量子点[2]、染料掺杂纳米粒子[3]、碳纳米点[4]等。然而相比于这些小分子荧光染料,荧光金属纳米团簇,特别是荧光金纳米团簇(gold nanocluster,Au NCs),具有低毒性、表面易于修饰、荧光稳定性强且可调等优点。Au NCs是由几个至几十个金原子组成的具荧光、水溶性的稳定的聚集体,是一种新型的荧光纳米材料[5]。纳米团簇的直径通常小于2 nm,介于单原子和纳米粒子或大体积的金属之间,由于特有的尺寸致其在可见区到近红外区范围内显示出尺寸依赖的荧光性能。Au NCs的特点大大改善了荧光探针的生物检测应用的性能,提升了现有分析方法的特异性和灵敏度。在分析检测、生物探针、细胞标记及荧光成像等领域有着广泛的应用前景[6-8]。
本文概述了金属纳米团簇,主要是具有荧光性质的金纳米团簇的制备方法,并结合目前金纳米团簇应用的最新进展介绍了其在生物传感检测,包括金属离子、阴离子、有机小分子、蛋白质和核酸等各种分析物检测中的应用。同时,简要评述和展望了荧光金纳米团簇研究所面临的挑战及发展方向。
1 荧光金属纳米团簇的制备
金纳米团簇特殊的尺寸和光电性质使得其在生物标记以及药物分析等领域有着良好的应用前景。目前荧光金纳米团簇的合成方法有多种分类[6,9],按照保护基团的不同可分为模板法和单分子层保护法两类。具体的保护剂或模板剂可分为硫醇、树枝状聚合物、蛋白质等[10-12]。选择合适的保护剂和模板对提高金簇的荧光等性能有着关键的作用。因此,我们将基于不同类型的保护剂或模板对荧光金纳米团簇的合成做出介绍。
1.1 硫醇类化合物
硫醇类化合物是最常见的金属纳米团簇合成中的保护剂分子。通过在金簇表面修饰或组装一层分子而形成的具有特定功能的纳米团簇。Brust等[13]首次以氯金酸根离子为前体,利用两相法在十二烷基硫醇(DDT)存在的情况下,合成了1~3 nm的金纳米团簇。之后更多硫醇类化合物用作金纳米团簇的合成被报道,如二氢硫辛酸(DHLA)[14,15]、谷胱甘肽(glutathione,GSH)[16]、半胱氨酸(cysteine)[17]、十二烷基硫醇(dodecanethiol,DDT)[18]、D-3- 巯基缬氨酸(DPA)等(图 1)[19]。Tsukuda研究小组成功制备并分离了谷胱甘肽保护的金簇。该小组进一步的研究发现Au25(SG)18能够防止核心蚀刻,且稳定性最好[20]。随后,该实验组采用Au11(PPh3)8Cl3为前体,利用Hutchison等[21]建立的配体交换反应,GSH为交换配体优先得到Au25(SG)18,其产量提高了100多倍,进而证明了Au25(SG)18的高稳定性。


1.2 树状大分子和聚合物
聚合物及树状大分子由于含有丰富的羧酸基团,并可控制金原子和溶液之间的结合能力,被认为是一种很有前景的合成尺寸较小、荧光度高、水溶性的金纳米团簇模板。聚合物是最早用来合成金属纳米团簇的模板,金属团簇的粒径也能很好地控制,聚合物作为衣壳还能防止外界物质对金纳米团簇荧光的猝灭作用。聚磷酸盐(polyphosphate)首次被报道用作保护基团以防止Ag NCs聚合[22]。此后,聚苯胺(polyaniline,PANI)[23]、聚酰胺氨型树状大分子(poly(amidoamine),PAMAM)[24]、聚乙醇胺(polyethylenimine,PEI)[25]等更多合成金簇的聚合物被陆续报道。然而这些聚合物模板由于存在制备方法复杂、耗时长等缺点,给金属纳米团簇的合成过程加大了难度。
1.3 蛋白质或多肽等生物大分子
近年来研究人员发现生物大分子诸如蛋白质和核酸等也可以作为合成金纳米团簇的模板。蛋白质或多肽作为模板合成的金属团簇具有广阔的应用空间和良好的发展前景,它们在合成和稳定金纳米团簇的过程中起着重要的作用,使得其在后期的生物标记和医学诊断方面有着更为突出的优势。2009年Xie等[12]报道了一种环保无毒的合成金纳米团簇的方法,他们利用牛血清蛋白(BSA)作为模板在37℃下合成了最大发射波长在630 nm处的 BSA-Au NCs,其粒径约为0.8 nm,且具有非常高的稳定性。最近,Wei等[26]采用溶菌酶(lysozyme)作为壳层分子合成了粒径约为1 nm,最大发射波长在657 nm处的金纳米团簇,具有较好的稳定性。Zhou等[27]发现组氨酸、GSH和DNA等生物分子在超声波的辅助下蚀刻金纳米颗粒形成粒径小的金簇,在365 nm的激发波长处其在430~450 nm处出现强荧光。
2 金纳米团簇的荧光分析方法与生物检测应用
荧光金纳米团簇所展现出的尺寸小、水溶性好、低毒性、表面易于修饰、荧光稳定性强等优点,使其为生物分析及医学诊断研究提供了新的标记手段,开辟了新的应用领域。利用金纳米团簇的荧光猝灭原理设计的荧光探针能特异性地检测环境中的化学和生物制剂等。在这一节中我们简单介绍利用荧光探针进行荧光分析检测的方法,并就荧光金纳米团簇作为荧光探针实现对各种重要分析物检测的研究进展作了总结。
2.1 荧光和共振光散射分析方法
金纳米材料的荧光和共振光散射特性得到较多的关注[28]。金纳米团簇常被作为最重要的荧光和共振光散射指示器用于包括免疫分析、DNA测定等一些特殊分析检测。在进行荧光分析时一般采用标准工作曲线法,即取各种已知量的荧光物质,配成一系列的标准溶液,测定出这些标准溶液的荧光强度,然后给出荧光强度对标准溶液浓度的工作曲线。在同样的仪器条件下,测定未知样品的荧光强度,然后从标准工作曲线上查出未知样品的浓度(即含量)。
2.2 荧光金纳米团簇在生物检测中的应用
2.2.1 检测金属离子
Hg2+、Cu2+、Pb2+等是自然界中常见的重金属离子污染物,对人类的健康产生不可逆转的危害。Cu元素缺乏能引发各种疾病,但是高浓度的铜也会对生物体造成危害;微量的Hg2+会对大脑、神经系统和肾脏造成极大地伤害。Huang等[10]发现在 Hg2+的参与下硫醇 -巯十一烷酸(11-MUA)保护的金纳米团簇(11-MUA-Au NCs)的荧光会发生强烈猝灭。由此可对Hg2+实现高灵敏度的检测,最低检测限为5 nM。金纳米团簇上包覆的羧酸根与重金属离子配位形成团聚,导致荧光的猝灭。2009年,Xie等[29]利用牛血清蛋白BSA作为模板合成了具有红色荧光的BSA-Au NCs,发现其可以对Hg2+实现高灵敏度的检测,检测低至 0.5 nM。Chai等[30]通过检测湖水中的Hg2+,提出由于BSA表面上的氨基和羧基与Hg2+结合而导致荧光猝灭的机理。
与此类似的是,Durgadas等[31]发现 Cu2+会与包覆在Au NCs表面的BSA结合使其荧光猝灭。他们利用此原理设计了荧光检测Cu2+浓度的传感器,检测限为50 μM,并且可以通过进一步优化条件使检测更加灵敏。当加入Cu2+的螯合剂甘氨酸后荧光又得以恢复。Chen等[32]利用谷胱甘肽与金纳米团簇表面发生配位合成的GSH-Au NCs检测水中的Cu2+,检测限低至3.6 nM。值得注意的是加入金属离子螯合剂乙二胺四乙酸(EDTA)后,被猝灭的荧光也可得到恢复。随后该小组又报道了一种荧光金纳米团簇探针实现了对 Cu2+的灵敏性检测[33]。He 等[34]运用了微波加热的方法,用7 min合成了高量子产率的GSH-Au NCs。该材料对Cu2+有很好灵敏性检测,检测限低至0.3 nM。其机理是由于GSH-Au NCs表面大量存在的GSH与Cu2+以2∶1的方式配位结合,导致金纳米团簇的聚集,产生明显的荧光猝灭作用。
金纳米团簇不仅可以用来检测Hg2+、Cu2+等重金属离子,还被用来检测其他金属离子,如Ni2+、Pb2+、Fe2+、季铵阳离子等。Kawasaki等[35]首次报道了Pb2+能使金纳米团簇荧光增强,荧光强度会随着Pb2+浓度的增大而增强。当在合成的金纳米团簇(Pep-Au NCs)加入50 μM的Pb2+后,荧光强度增加至原来的8倍。基于配体交换的方法,Yuan等[36]合成Pb2+可以使GSH和11-MUA共同保护的荧光金纳米团簇的荧光发生强烈猝灭,从而可以起到对Pb2+的灵敏性检测,该方法检测限低至5 nM。
2.2.2 检测阴离子
碘元素是人体的微量元素,对人体的生长发育起着很重要的作用。研究表明,碘缺乏可以引起很多疾病,但是,碘浓度高对生物机体组织也具有毒副作用,因此,建立准确灵敏的I-检测方法具有非常重要的意义。Wang等[37]使用GSH为模板合成的金纳米团簇(Au25(SG)18)作为荧光检测I-浓度的传感器,检测限达到400 nM,并且可以通过进一步优化条件使检测更加灵敏。
氰化物是一种广泛存在于自然界,尤其是生物界的剧毒物质,它们可由某些细菌,真菌或藻类制造,存在于相当多的食物与植物中,其毒性跟CN-对重金属离子的超强络合能力有关,因此实现对CN-的灵敏检测刻不容缓。Liu等[38]发现CN-可以使BSA为模板合成的BSA-Au NCs中的Au氧化从而破坏金纳米团簇的机构,其反应机理如反应式(4)所示。该过程会导致荧光猝灭,达到检测CN-浓度的目的。相比其他CN-的光学检测方法,利用金纳米团簇实现对CN-的检测更具有抗干扰性。
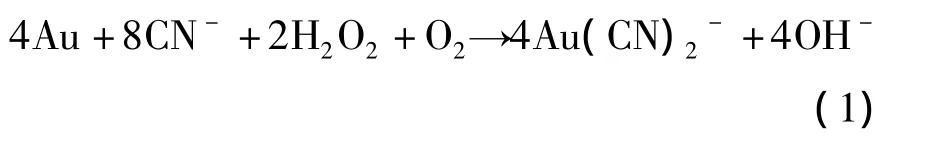
Yan等[39]发现在酸性条件下NO-2可以使人血清蛋白保护的金纳米团簇的荧光发生强烈猝灭,从而起到对NO-2的检测作用。该检测方法在2.0×10-8M 至5.0×10-5M 时成线性良好,最低检测限达到2.2 μM。该小组提出由于酸性环境下NO2-产生了氮氧化合物,这些氮氧化合物才是该金纳米团簇荧光猝灭的物质。
2.2.3 检测双氧水
双氧水(hydrogen peroxide,H2O2)是许多化工、医药和环境变化过程中都涉及到的分析物,几乎是所有氧化酶的反应产物,为人类在许多疾病的早期诊断阶段对体液的分析起着重要的作用。近期,Jin等[40]利用合成的具有红色荧光的BSA-Au NCs,通过实验发现在H2O2的参与下金纳米团簇荧光猝灭明显,检测限为3 μM。他们将荧光猝灭归因于金簇在H2O2的参与下发生如反应式5、式6的变化。

葡萄糖是生物体内新陈代谢不可缺少的营养物质,葡萄糖的定量测定在临床化学、生物化学和食品分析中都占有很重要的地位。此外,血糖水平也是人类健康状况的一个指标,血糖的异样为人类的疾病,如糖尿病或低血糖提供了产生信号。葡萄糖和人体许多疾病相关,如葡萄糖代谢紊乱、胰岛细胞癌等,因此能够快速准确检测人体血糖浓度是诊断这些疾病的一个重要因素。到目前为止,Shiang 等[41]和 Jin 等[40]将葡萄糖氧化酶(GOD)和葡萄糖作用产生过氧化氢,再分别利用过氧化氢使辣根过氧化酶(HRP)和牛血清蛋白保护的金纳米团簇的荧光猝灭(图3)。基于这一现象间接检测葡萄糖,实现对血样中葡萄糖的灵敏检测,检测限(LOD)分别达到了1 μM和5 μM。

图3 HRP-Au NCs的合成和H2O2诱导荧光淬火示意图Fig.3 Schematic representation of the formation of HRP-Au NCs and the H2O2-induced quenching
2.2.4 检测其他有机小分子化合物
维他命B12、盐酸柔红霉素、环丙沙星、槲皮素、多巴胺等有机小分子化合物也可以对金纳米团簇的荧光产生不同程度的响应。这些物质或是存在于人体或是存在于各种药物之中,通过荧光金纳米团簇实现其灵敏检测在医学诊断、生物制药等方面意义重大。Chen等[42]用环丙沙星恢复Au NCs被Cu2+抑制的荧光,实现对环丙沙星的灵敏检测,检测限为0.3 ng/mL。该检测稳定,可重复性高。
Samari等[43]报道了一种金纳米团簇传感器,可以运用于医药制剂中维他命B12的分析。其利用牛血清蛋白为模板合成的Au NCs为能量给体,维他命B12为能量受体,两者发生荧光共振能量转移(FRET),建立了一种灵敏检测维生素B12的方法。
2.2.5 检测氨基酸和蛋白质
氨基酸是构成蛋白质分子的基本单位,它与生物的生命活动有着密切的关系,是生物体内不可或缺的营养成分之一,其中半胱氨酸在机体代谢中扮演着关键的角色,它能与有毒的芳香族化合物缩合成硫醚氨酸而起解毒作用。半胱氨酸的缺乏能引起很多组织、器官的病变,如肝损伤、皮肤疾病以及免疫系统损伤等,因此对于半胱氨酸的灵敏检测显得尤为重要[44]。Cui等[45]发现半胱氨酸可以使BSA-Au NCs的表面缺陷降低从而使其荧光性增强,该小组设计的半胱氨酸的检测方法,最低检测限达到1.2 μM。
选择性受体分子(如抗体和核酸适配体)和金纳米团簇表面的结合已经被应用于金纳米团簇荧光的蛋白质检测。2006年Triulzi等[46]首先报道了将金纳米团簇运用到蛋白质的检测中来。Huang等[47]提出了一种分析和检测蛋白质的方法,他们运用竞争性同源荧光猝灭法,选择一段能和特异蛋白结合的寡核苷酸序列修饰金纳米颗粒,并分别利用PDGF修饰的金纳米团簇和寡核苷酸修饰的金纳米颗粒作为供体和受体,当两者结合后,由于荧光共振能量转移(FRET)使其荧光猝灭。Chen等[48]提出了一个简单的快速利用谷胱甘肽-S-转移酶(GST)标记检测细胞中溶菌产物蛋白质的方法。该方法使用谷胱甘肽为模板合成Au NCs,在紫外灯下通过离心就可以实现对蛋白质的检测,这种用肉眼就可以观察,其方法的检测限达到了0.75 μM,仅比利用荧光光谱仪检测的检测限0.25 μM高出一点。
3 总结和展望
金纳米团簇是一种在荧光传感检测、生物医学等领域具有巨大发展潜力的新型荧光纳米材料,其作为荧光探针所展现出的独特光学特性、较低的毒性和超小的尺寸使其在生物分析检测中有着广泛的应用前景,然而荧光金纳米团簇的合成机理和光学性质研究有待进一步深化。其合成方法多沿用最初设计,新方法的报道还很少见,对于金纳米团簇合成机理的解释更少。由于金纳米团簇合成及其结构的复杂性,其与生物检测物的作用机理也有待进一步探究。
虽然目前对于荧光金纳米团簇的应用和探究尚处于初级阶段,但随着纳米技术的发展和理论研究的逐步成熟,相信会有更多的多功能、高质量的金纳米团簇脱颖而出,并广泛应用于生物分子的快速、灵敏、特异性的检测。
[1]Wang F,Tan W B,Zhang Y,et al.Luminescent nanomaterials for biological labelling[J].Nanotechnology,2006,17:R1.
[2]石建军,王圣,何婷婷,等.超声电化学快速制备近红外CdTe量子点与细胞成像[J].无机化学学报,2013,29(10):2071-2078.
[3]Yan J,Estévez M C,Smith J E,et al.Nanoscale Assays Get High Mileage from Minute Specimens[J].Nano Today ,2007,2:44-50.
[4]Baker S N,Baker G A.Luminescent carbon nanodots:emergent nanolights[J].Angew.Chem.Int.Ed.,2010,49:6726-6744.
[5]Diez I,Ras R H A.Enhanced fluorescence of silver nanoclusters stabilized with branched oligonucleotides[J].Nanoscale,2011,3:1963-1970.
[6]杨群峰,刘建云,陈华萍,等.贵金属纳米团簇的制备及在生物检测中的应用[J].化学进展,2011,23(5):879-891.
[7]任娟,代雯乐,付欣,等.新型蓝色荧光聚合物纳米粒子的合成与表征[J].化学通报,2011,74(8):683-687.
[8]晏菲,刘向洋,赵冬娇,等.荧光金纳米团簇在小分子化合物检测中的应用[J].化学进展,2013,25(5):799-808.
[9]刘钊,金申申,朱满洲.液相合成金纳米团簇[J].化学进展,2011,23(10):2055-2064.
[10]Huang C C,Yang Z,Lee K H,et al.Synthesis of highly fluorescent gold nanoparticles for sensing mercury(II)[J].Angew.Chem.Int.Ed,2007,46:6824-6828.
[11]Zheng J,Petty J T,Dickson R M.High quantum yield blue emission from water-soluble Au8 nanodots[J].Am.Chem.Soc,2003,125:7780-7781.
[12]Xie J,Zheng Y,Ying J Y.Protein-directed synthesis of highly fluorescent gold nanoclusters[J].Am.Chem.Soc,2009,131:888-889.
[13]Brust M,Walker M,Bethell D,et al.Spontaneous ordering of bimodal ensembles of nanoscopic gold clusters[J].Chem.Soc.Chem.Commun,1994:801-802.
[14]Jana N R,Peng X.Controlling size,shape and structural architecture of the nanocrystals requires[J].Am.Chem.Soc,2003,125:14280-14281.
[15]Lin C A,Yang T Y,Lee C H,et al.Synthesis and characterization of colloidal fluorescent silver nanoclusters[J].ACS Nan,2009,3:395-401.
[16]Negishi Y,Nobusada K,Tsukuda T.Synthesis and Characterization of Gold Nanoparticles with Surface Ligands Derived from a Primary Phosphine[J].Am.Chem.Soc,2005,127:5261-5270.
[17]Aryal S,Remant B K C,Dharmaraj N,et al.Spectroscopic identification of SAu interaction in cysteine capped gold nanoparticles[J].Spectrochim.Acta A,2006,63:160-163.
[18]Yang Y,Chen S.Gallium Nitride Nanowire Nanodevices[J].Nano Lett,2003,3:75-79.
[19]Shang L,Dörlich R M,Brandholt S,et al.Effect of Protein Adsorption on the Fluorescence of Ultrasmall Gold Nanoclusters[J].Nanoscale,2011:2009-2014.
[20]Shichibu Y,Negishi Y,Tsunoyama H,et al.Extremely High Stability of Glutathionate‐Protected Au25 Clusters Against Core Etching[J].Tsukuda T.Small,2007,3:835-839.
[21]Woehrle G H,Warner M G,Hutchison J E.Ligand exchange reactions yield subnanometer,thiol-stabilized gold particles with defined optical transitions[J].Phys.Chem.B,2002,106:9979-9981.
[22]Linnert T,Mulvaney P,Henglein A,et al.Controlled Synthesis of Metal NCs:Simple Chemistry Meets Complex Physics[J].Am.Chem.Soc,1990,112:4657-4664.
[23]Hatchett D W,Josowicz M,Janata J,et al.How to affect number,size,and location of metal particles deposited in conducting polymer layers[J].Chem.Mater,1999,11:2989-2994.
[24]Garcia-Martinez J C,Crooks R M.Nanoparticles in dendrimers:From synthesis to application[J].Am.Chem.Soc,2004,126:16170-16178.
[25]Duan H,Nie S.Gold nanodot-based luminescent sensor for the detection of hydrogen peroxide and glucose[J].Am.Chem.Soc,2007,129:2412-2413.
[26]Wei H,Wang Z,Yang L,et al.Lysozyme-stabilized gold fluorescent cluster:synthesis and application as Hg2+sensor[J].Analyst,2010,135:1406-1410.
[27]Zhou R J,Shi M M,Chen X Q,et al.Gold nanoclusters and graphene nanocomposites for drug delivery and imaging of cancer cells[J].Chem.Eur,2009,15:4944-4951.
[28]He Y Q,Liu S P,Liu Z F,et al.A study on the sizes and concentrations of gold nanoparticles by spectra of absorption,resonance Rayleigh scattering and resonance non-linear scattering[J].Acta A,2005,61:2861-2866.
[29]Xie J,Zheng Y,Ying J Y.Highly selective and ultrasensitive detection of Hg2+based on fluorescence quenching of Au nanoclusters by Hg2+-Au+interactions[J].Chem.Commun,2010,46:961-963.
[30]Chai F,Wang T,Li L,et al.Au25(SG)18as a fluorescent iodide sensor[J].Nanoscale Res.Lett,2010,5:1856-1860.
[31]Durgadas C V,Sharma C P,Sreenivasan K.Fluorescent gold clusters as nanosensors for copper ions in live cells[J].Analyst,2011,136:933-940.
[32]Chen W,Tu X,Guo X.Fluorescent gold nanoparticles-based fluorescence sensor for Cu2+ions[J].Chem.Commun,2009:1736-1738.
[33]Tu X,Chen W,Guo X.Facile one-pot synthesis of near-infrared luminescent gold nanoparticles for sensing copper[J].Nanotechnology,2011,22:095701
[34]He D F,Xiang Y,Wang X,et al.Synthesis,Structure,and Characterization of Dinuclear Copper[J].Mater.Res.Bull,2011,46:2418-2421.
[35]Kawasaki H,Yoshimura K,Hamaguchi K,et al.Synthesis of DNA-templated fluorescent gold nanoclusters[J].Anal.Sci,2011,27:591-596.
[36]Yuan Z,Peng M,He Y,et al.Functionalized fluorescent gold nanodots:synthesis and application for Pb2+sensing[J].Chem.Commun,2011,47:11981-11983.
[37]Wang M,Wu Z K,Yang J,et al.Au25(SG)18as a fluorescent iodide sensor[J].Nonoscale,2012,4:4087-4090.
[38]Iu Y,Ai K,Cheng X,et al.Gold-Nanocluster-Based Fluorescent Sensors for Highly Sensitive and Selective Detection of Cyanide in Water[J].Adv.Funct.Mater,2010,20:951-956.
[39]Yan L,Cai Y,Zheng B,et al.Microwave-assisted synthesis of BSA-stabilized and HSA-protected gold nanoclusters with red emission[J].J Mater.Chem,2012,22:1000-1005.
[40]Jin L,Shang L,Cuo S,et al.Biomolecule-stabilized Au nanoclusters as a fluorescence probe for sensitive detection of glucose[J].Biosens.Bioelectron,2011,26:1965-1969.
[41]Shang Y C,Huang C C,Chang H T.Gold nanoclusters as antimicrobial agents for antibiotic detection[J].Chem.Commun,2009:3437-3439.
[42]Chen Z,Qian S,Chen J,et al.Protein-templated gold nanoclusters as fluorescence probes for the detection of methotrexate[J].Talanta,2012,94:240-245.
[43]Samari F,Hemmateenejad B,Rezaei Z,et al.A novel approach for rapid determination of vitamin B12 in pharmaceutical preparations using BSA-modified gold nanoclusters[J].Anal.Methods,2012,4:4155-4160.
[44]Gazit V,Ben A R,Coleman R,et al.Cysteine-induced hypoglycemic brain damage:An alternative mechanism to excitotoxicity[J].Amino Acids,2004,26:163-168.
[45]Cui M L,Liu J M,Wang X X,et al.Selective determination of cysteine using BSA-stabilized gold nanoclusters with red emission.Analyst[J].2012,137:5346-5351.
[46]Triulzi R C,Micic M,Giordani S,et al.Immunoasssay based on the antibody-conjugated PAMAM-dendrimer-gold quantum dot complex[J].Chem.Commun,2006:5068-5070.
[47]Huang C C,Chiang C K,Lin Z H,et al.Synthesis,characterization,and bioconjugation of fluorescent gold nanoclusters toward biological labeling applications[J].Anal.Chem,2008,80:1497-1504.
[48]Chen C T,Chen W J,Liu C Z ,et al.Glutathione-bound gold nanoclusters for selective-binding and detection of glutathione S-transferase-fusion proteins from cell lysates[J].Chem.Commun,2009,3:7515-7517.
