1,4-二甲基-2-(三氟甲基)苯的合成
2014-11-01刘广生付立民
刘广生 付立民
(金凯(辽宁)化工有限公司,辽宁阜新 123129)
0 前言
由于氟原子半径小,又具有较大的电负性,它所形成的C-F键键能要比C-H键键能大得多,所以在医药和农药分子中引入三氟甲基会明显增强药物的稳定性和生理活性。由于含三氟甲基的药物具有较高的脂溶性和疏水性,促进其在生物体内吸收与传递速度,从而提高药效[1];在液晶材料中引入三氟甲基使得液晶的黏度低、电阻率高、响应速度较快、介电常数较高,非常适合薄膜场效应晶体管驱动的液晶显示[2]。
含氟医药、农药和液晶材料都离不开含氟中间体的合成。而在芳香族中间体上引入三氟甲基一般需要首先对甲基进行光氯化,然后再进行氟取代,工艺过程复杂,产生的三废较多,对环境影响较大。如果在芳香族中间体上,在含有甲基同时,引入三氟甲基的工艺就会更加复杂。
有文献报道[3]以对二甲苯为原料,用二(三氟甲基)化碲进行三氟甲基化,得到,4-二甲基-2-(三氟甲基)苯。但二(三氟甲基)化碲不易得到,难以实现工业化。
本文作者经过实验探索,在同一反应器中以对二甲苯为原料,在引入三氯甲基的同时进行氟化反应,得到1,4-二甲基-2-(三氟甲基)苯,同时还得到副产物1,5-二甲基-2-(三氟甲基)苯。整个过程操作简单,收率较高。而且通过该化合物的合成对于构思相关化合物的合成工艺也具有重要的参考意义。
1 实验
1.1 实验仪器与原材料
5 L高压反应釜(设计压力10.0 MPa,磁力搅拌,大连市自控设备厂定制);气相色谱仪:Agilent 7890A型气相色谱仪(美国Agilent Scientific Inc.),Agilent cerity NDS版色谱工作站;IRAffinity-1(日本岛津制作所);Bruker AVIII-400型核磁共振仪(瑞士Bruker)。
对二甲苯[w(PX)=99.5%,工业品,南京金盟化工有限公司];四氯化碳[w(CCl4)=99.9%,工业品,天津盛通泰化工有限公司];氟化氢[w(HF)=99.9%,工业品,内蒙古敖汉银亿矿业有限公司]。
1.2 合成反应
主反应:
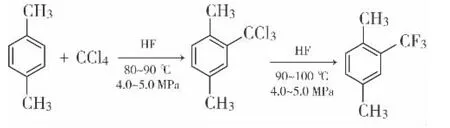
副反应:
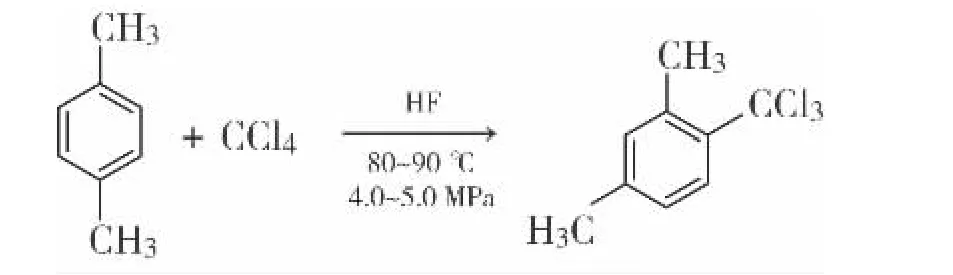
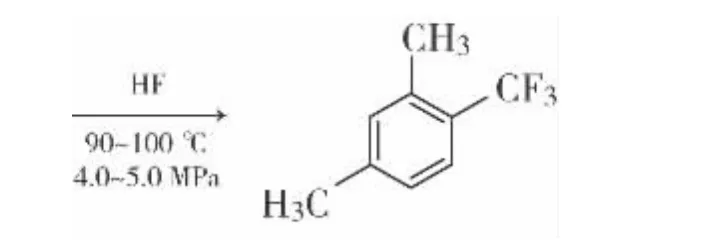
1.3 合成步骤
在5 L高压釜中加入对二甲苯318 g,加入四氯化碳150 g,釜温降至10℃以下,向釜内加入氟化氢1500 g。投料完毕后控制釜温在80~90℃,保温6 h然后升温至90~100℃,保温6 h。高压釜降温至<10℃,用氮气吹扫氟化氢,至无氟化氢被吹出为止。将油层压出,使用20%的碳酸钾溶液进行中和,中和至pH=6~7。将油层分出,投入到水汽蒸馏釜内,控制釜温<120℃,将油层水汽蒸馏。然后将油层进行蒸馏,得到无色油状液体274 g。
2 反应产物的检测
2.1 NMR对于产品结构的证明
2,4-二甲基三氟甲苯各H原子归属如下:
1H NMR(CDCl3,400MHz)σ:7.525,7.545 ppm(d,1H,a);7.134(s,1H,c);7.113,7.093 ppm(d,1H,b)。
2.501 ppm(s,3H,h);2.403(s,3H,i)。
2,5-二甲基三氟甲苯各H原子归属如下:
1H NMR(CDCl3,400 MHz)σ:7.474 ppm(s,1H,a1);7.267,7.250(d,1H,c1);7.190,7.209 ppm(d,1H,b1);2.501 ppm(s,3H,h1);2.403(s,3H,i1)。
2,4-二甲基三氟甲苯各 C原子归属如下:125.667 ~125.831 ppm(q,a);126.134 ppm(s,b)。
132.614 ppm(s,c);129.150,126.308,123.576,120.863 ppm(q,d)。
126.652 ,126.357,126.060,125.722 ppm(q,e)。
136.448 ,136.463 ppm(d,f);135.487 ppm(s,g)。
21.034 ,21.072 ppm(d,h);19.111 ppm(s,i)。
2,5-二甲基三氟甲苯各C原子归属如下:
126.134 ppm(q,a1);131.810 ppm(s,b1)。
132.196 ppm(s,c1);120.699,123.416,126.060,125.667 ppm(q,d1)。
129.150 ,128.856,128.563,128.270 ppm(q,e1)。
136.448 ,136.463 ppm(d,f1);135.487 ppm(s,g1)。
20.707 ,20.744 ppm(d,h1);18.750 ppm(s,i1)。
2.2 红外光谱检测结果
反应产物的红外(IR)谱图见图1。
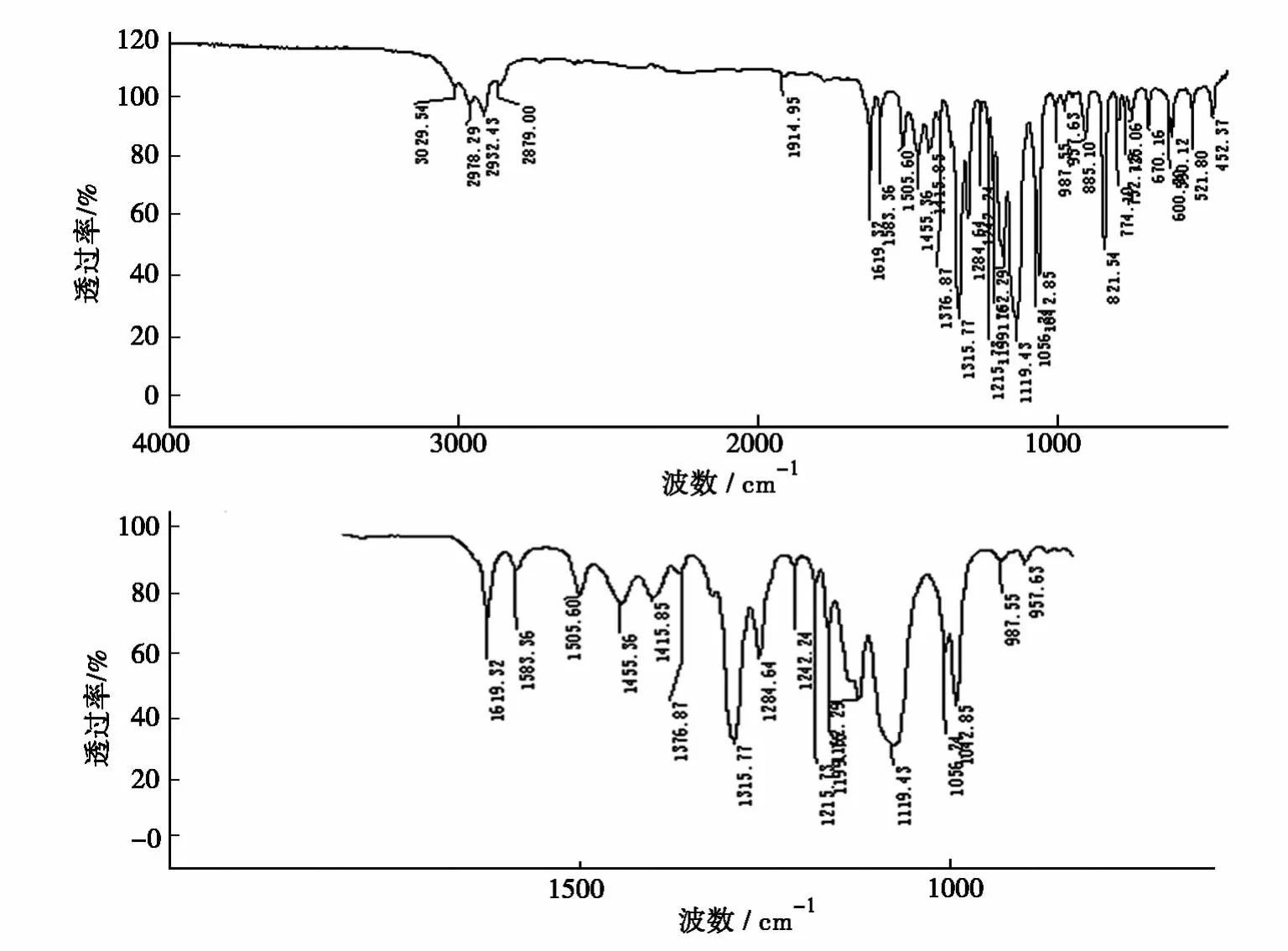
图1 反应产物的IR谱图
从谱图中可明显见到波数为821cm-1的1,2,4-位置的振动,且未见1,2,3-与1,3,5-位置的振动特征。
上述分析结果证明了产物的确切结构。
3 反应机理推测与讨论[4-5]
之所以发生了异构化副反应,可能按如下反应机理进行。
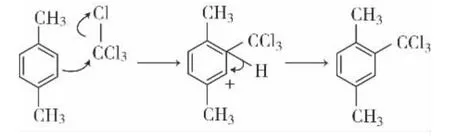
主反应:
副反应:
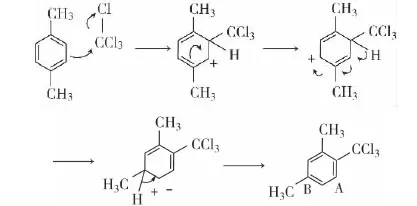
在反应进程中,未能在三氯甲基的邻位(A)发生缺电子重排而只在三氯甲基的对位(B)发生缺电子重排,其可能的原因是空间障碍因素所致。
4 结论
以对二甲苯为原料,以无水HF为溶剂及催化剂,在温度80~100℃和压力4.0~5.0 MPa的下与CCl4进行傅克反应和氟化反应,得到1,4-二甲基-2-(三氟甲基)苯和副产1,5-二甲基-2-(三氟甲基)苯。所得产物分别进行了NMR检测和红外检测,确认了产品结构;此一实例未见国内外文献报道,本文作者从理论上对此现象进行了解析,认定该副产物为缺点子重排反应产物。
[1]梁诚.含氟医药的合成技术与生产现状[J].有机氟工业,2003(1):21-27.
[2]孟凡宝,廉娇,高永梅.含氟液晶研究进展[J].化工进展,2008,20(4):499-506.
[3]Dieter N,Jurge K.Trifluormethylierungsreaktionen Von Te(CF3)2Mit Halogenbenzolen und Methylbenzolem[J].Journal of Fluorine Chemistry,1990,47:283-299.
[4]Marhold A,Klauke E.A New method for the trifluoromethylation of aromatics[J].J.Fluorine Chem.,1981,18:281-291.
[5]陈荣业.分子结构与反应活性[M].北京:化学工业出版社,2008:192-194.
