异戊二烯与低浓度盐酸的加成反应
2014-10-31齐福来
齐福来
(中石化上海工程有限公司,上海 200120)
异戊二烯和氯化氢加成生成氯代异戊烯,再进一步加成生成二氯异戊烷。这两个相继生成的产品是合成维生素A、维生素E、国际型香料,菊酯型农药的基本原料。异戊二烯的来源可以来自异丁烯-甲醛法[1-2],也可由乙炔和丙酮[3]制得,再就是由乙烯生产装置的C5馏分经分离获得,C5馏分法得到的异戊二烯量大且便宜,对前面讲的两个产品的研究和开发将给C5馏分的综合利用和深度加工创造了条件。同时也为精细化工的发展提供了基础原料。
异戊二烯和氯化氢加成的方法大体上分为两种:一种为气相加成法[4-6],一种为液相加成法[7-9]。气相加成法是将气相的氯化氢通入液相的异戊二烯溶液中进行反应。气相加成法需要加入溶剂以保证氯化氢和异戊二烯均溶于它,比如四氯化碳。由于溶剂的加入给产品的分离带来麻烦。而液相法则以不同浓度的液相盐酸与在液相状态的异戊二烯进行反应,该反应就成为两相间的反应。反应后的液相分为两层,油层经分离即可得到产品。但是液相法需要大量的稀盐酸溶液进行对盐酸的增浓和输送,由于跑冒滴漏往往给环境带来污染,因此该方法在工业化时就受到了限制。对于实验室来讲,液相法比较容易进行,尤其是进行基本反应数据的测定极为方便。
以前的气相法文献仅限于研究合成单一产品氯代异戊烯的条件,尽量减少这个反应的第二个烯烃的加成反应产物二氯异戊烷的生成,因此必须选用不同的催化剂、不同的反应温度、适当的溶剂进行反应,这些都对反应后的处理带来麻烦。
本文着重研究不追求单一的氯代异戊烯的产品,允许二氯异戊烷的产生,研究如何根据调节反应的条件来控制两个产品所需的比例。考虑到气相法和液相法的各个优点采用拟液相法,即将氯化氢通入酸油两液相反应液中,保持酸相的盐酸浓度,达到所需的反应程度,避免了各方法的缺点。由于在拟液相法反应中实际上是液相的反应,所以只要研究液相反应的情况就可以了。
1986年齐福来等[10]发表了有关异戊二烯与氯化氢加成的液相法的研究,研究了催化剂、搅拌转速、反应温度、水相和油相比例等条件对反应的影响,并模拟了该反应。在该文献中所报道的数据仅为高浓度的盐酸(37%)与异戊二烯的反应情况。 由于该反应在强盐酸的环境下,第一步的反应在前几分钟就完成了,放热比较集中,热量移不出,反应液要升温,会引起诸多问题,这就给如何实现工业化带来困难。2002年蒋正兴,蔡仁昌等人[11]专门发表文章讨论了反应的放热量的计算问题以及反应器的设计考虑。为此必须降低盐酸的浓度,特别是在异戊二烯浓度高时,降低反应速率,但是随着反应的进行,就必须提高盐酸的浓度,以保持必要的反应速率。这就需要研究不同浓度盐酸与异戊二烯的反应情况。
在拟液相反应系统,气相氯化氢溶解于水比酸油两相之间的质交换速率快得多。液相法便于获得实验数据,在不同的盐酸浓度下测定的反应速率,可以应用于该拟液相法的反应系统。本文主要研究了低浓度盐酸环境下的反应情况。并对工业化的反应器进行了假设和模拟计算。
1 低浓度盐酸与异戊二烯的反应
1.1 氯化氢与异戊二烯的加成反应机理
氯化氢与异戊烯的加成反应在文献[10]中已有介绍,该反应主要有以下三步的主反应:
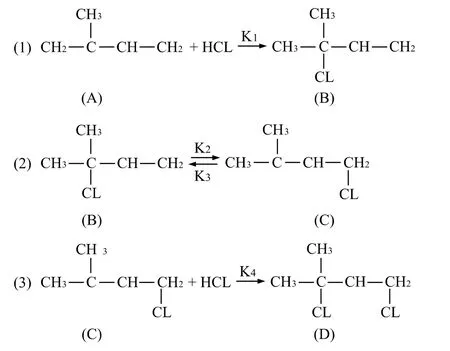
第(1)步反应是异戊二烯(A)和氯化氢叔位碳上的加成,生成了3-位氯代异戊烯(B);第(2)步反应为3-位氯代异戊烯(B)在酸性溶液中很易转化成它的异构体氯代异戊烯(C),这是需要的产品,所以第二步反应也叫异构反应,也是主反应。第(3)步反应是氯代异戊烯再与氯化氢加成生成二氯异戊烷(D),成为需要的第二个产品。该反应的反应历程可写成下面简单的反应模式:
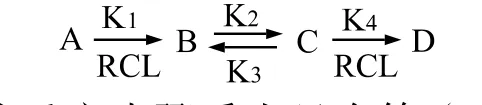
由上面的反应步骤看出只有第(1)步和第(3)步反应为与氯化氢进行加成反应,因此只有这两个反应步骤与氯化氢的浓度有关。第(2)步反应是分子间的异构作用,与氯化氢的浓度无关。也就是说反应方程式所定义的 K1,K4与氯化氢的浓度有关,K2,K3只与温度等条件有关系。
1.2 反应速率模型的建立
按照上面1.1节介绍的反应模式,由于盐酸水相的体积比例比较大,因此该反应系统应该是水相为连续相,而油相为分散相。假定该反应是氯化氢分子穿过两相之间的膜进入异戊二烯的油相再与异戊二烯反应。两相之间的传质按照双膜理论,应考虑氯化氢与异戊二烯的加成反应第(1)步反应应为一级反应,但在文献[10]中已经说明采用异戊二烯浓度的二级反应级数更能模拟反应的实验数据。有人也曾经假定为1.8级的反应模式。因此第(1)步反应的速率方程式根据双膜理论建立如下的反应速率方程式(1):
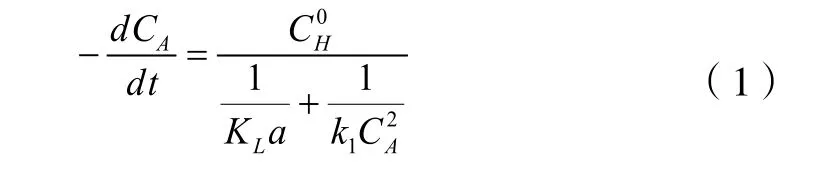
接下来的各反应步骤的反应速率方程描述如下:3-位氯代异戊烯在油相中的组分浓度变化按照反应模式,应与异戊二烯的反应速率,异构化的速率以及氯代异戊烯的浓度有关。其反应速率方程式表示如式(2):
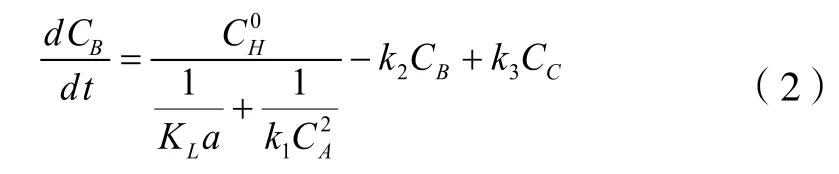
主要产品氯代异戊烯的生成速率,应减去二氯异戊烷的生成速率以及加上3-位氯代异戊烯的异构化速率,因而主要产品的生成速率方程式表述如式(3):

最终产品二氯异戊烷的生成速率方程与盐酸浓度和氯代异戊烯的浓度有关,其二氯异戊烷的生成速率方程式表述如式(4):
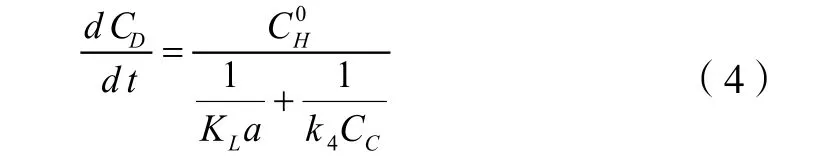
由反应速率方程式(1)~(4)总括了氯化氢与异戊二烯加成反应的全部反应过程。当然在反应过程中也会出现异戊二烯聚合以及其他副产物,因此会出现高沸物,但由于这些高沸物的组成没有进一步的界定,以及它的生成量有限,在计算中暂不予考虑。
1.3 低浓度盐酸与异戊二烯的反应数据
1.3.1 设定反应条件
反应温度控制在20~25 ℃之间;采用文献[10]的设备;在文献[10]中已经对两相接触所需的搅拌转速进行了实验,本次实验均保持搅拌转速为560 r/min,以保证良好的两相之间的传质条件;氯化氢与异戊二烯的分子配比采用(5~7)∶ 1的配比;盐酸浓度太低反应慢,没有实际意义,盐酸浓度太高反应太快,不易测定,得不到准确的数据。因而本次实验采用最低的盐酸浓度为5.9 gmol/L,最高盐酸浓度为10.02 gmol/L;为此配置盐酸浓度(分子浓度)为四个分子浓度:
N=5.9 gmol/L N=7.2 gmol/L
N=8.6 gmol/L N=10.02 gmol/L
盐酸20 ℃时分子浓度与重量浓度及比重的关系如表1。
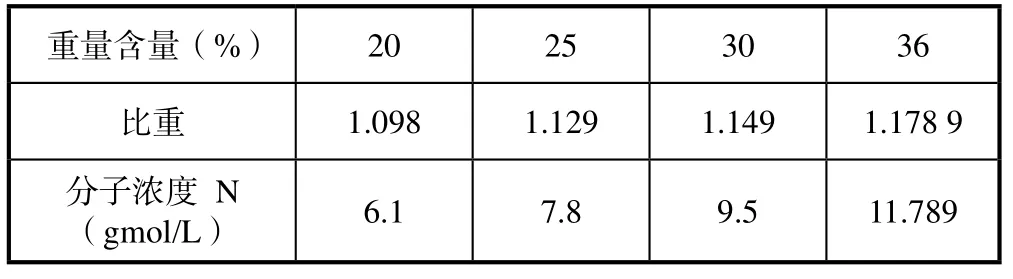
表1 盐酸的分子浓度与重量浓度,比重的关系表
1.3.2 数据的处理
由于只有反应速率方程式(1)关系到异戊二烯的浓度,为了处理方便可以首先研究盐酸浓度不同时异戊二烯的反应速率。这样就可以不考虑其它组分浓度的变化,首先求得不同盐酸浓度时反应速率方程式(1)中的K1值。
油相中异戊二烯的浓度在反应开始时为10 gmol/L。
由图1很明显地看出随着盐酸浓度的降低,异戊二烯的反应速率降低。盐酸浓度在N=8.6 gmol/L和N=10.02 gmol/L时其异戊二烯的反应速率比较接近,而且在前5 min内异戊二烯就反应了近5 gmol/L,将近一半反应程度了。当N=7.2 gmol/L时异戊二烯的反应速率明显降低,异戊二烯反应最慢的是N=5.9 gmol/L的盐酸浓度。
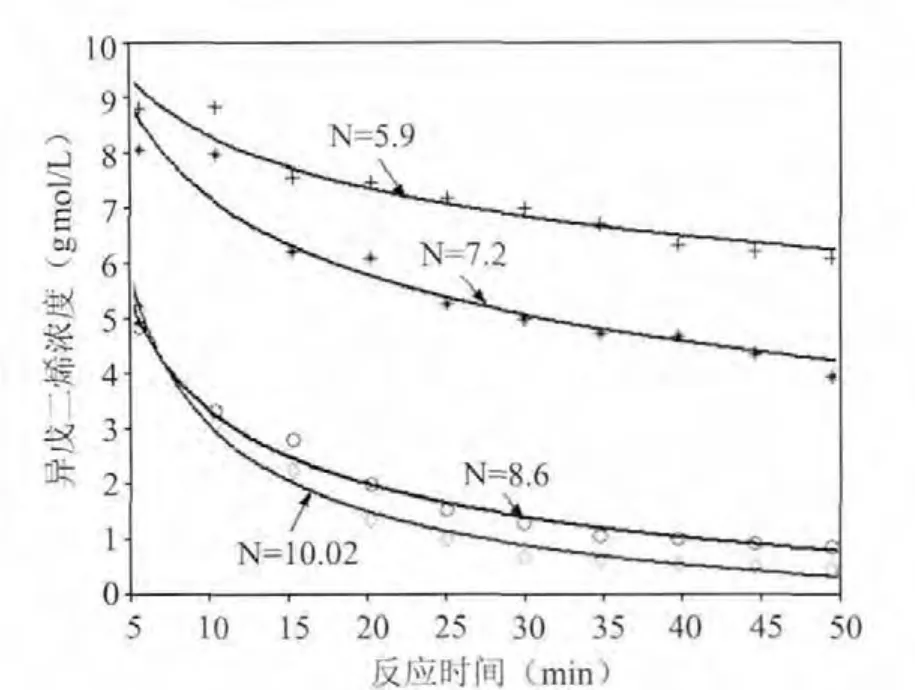
图1 经过数据回归后得到线性的关联图
经数据规整后异戊二烯的浓度变化基本上满足下面式(5)的公式:

不同的盐酸浓度下的系数值列在表2中。
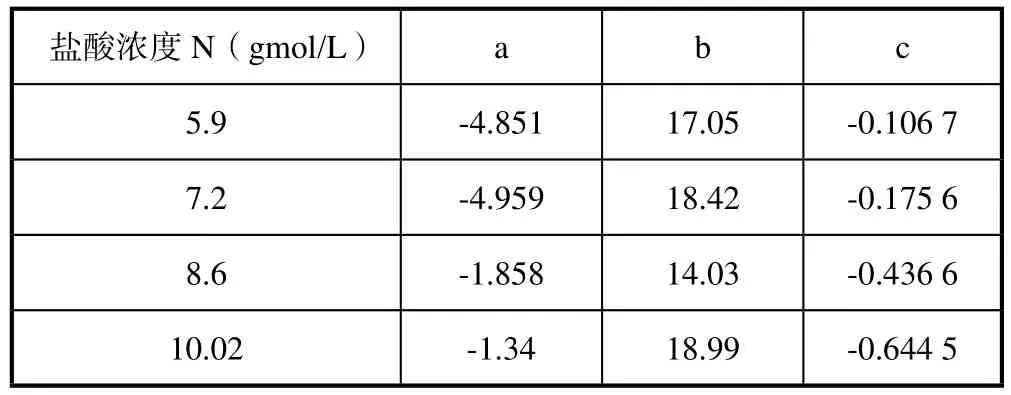
表2 规整方程式(5)的系数表
要求得反应速率方程式(1)中的反应速率常数K1就必须知道两相的传质速率KLa。经过文献[10]的测定在KLa≥10以后基本上属于反应动力学控制,因此在计算中令KLa=10。
在模拟过程中采用下降法[12]和Runge-Kutta[13]四阶解微分方程的方法,求解反应方程式(1)。对不同盐酸浓度得到反应速率方程式(1)的反应速率常数K1,其计算结果按不同的盐酸浓度列在表3中。
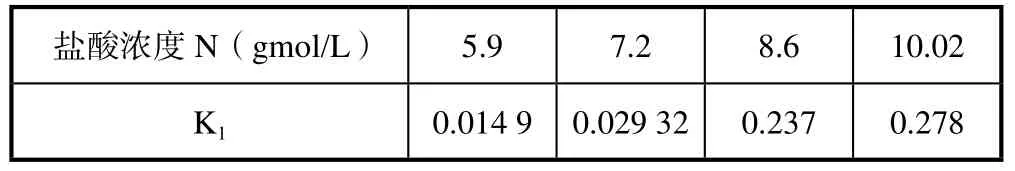
表3 不同盐酸浓度反应速率常数K1的值
求得K1以后,根据不同反应时间的其它各反应物浓度的试验数据,对反应速率方程式组(2)~(4)的联立求解。根据前面介绍的方法得到各反应方程式中的反应速率常数K2~K4。不同盐酸浓度时,K1~K4的反应速率常数列在下表4中。

表4 不同盐酸浓度时各反应速率常数值
为了考核所得到的反应速度常数,按照前面所得到的反应速度常数,对盐酸浓度N=7.2 gmol/L、N=8.6 gmol/L、N=10.2 gmol/L时模拟全部反应历程,反应物浓度随时间变化分别见图3、图4和图5(其中,点——实验值,线——计算值)。
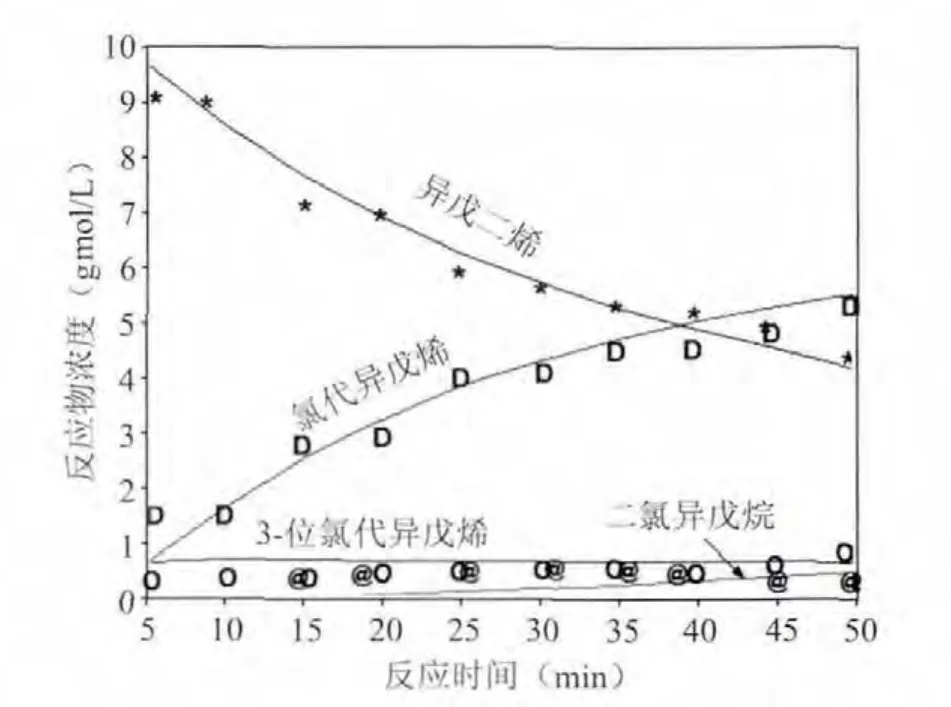
图2 N=7.2 gmol/L时模拟结果和实测数据标绘图
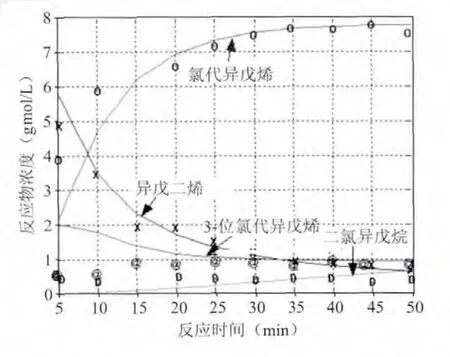
图3 N=8.6 gmol/L时模拟结果和实测数据标绘图
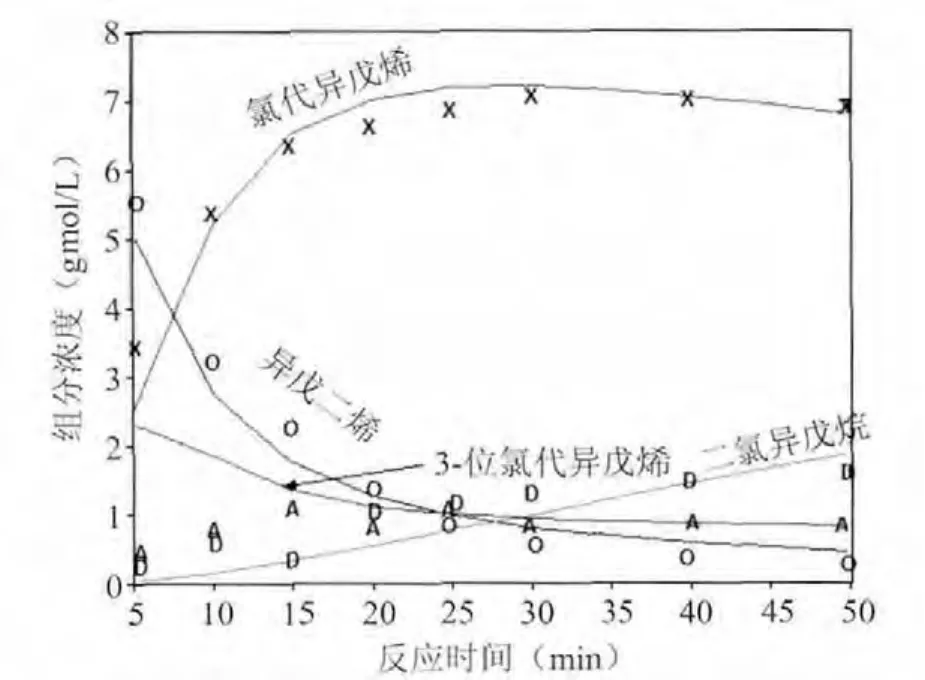
图4 N=10.2 gmol/L时模拟结果和实测数据标绘图
由图3,图4,图5看出:异戊二烯和氯代异戊烯的浓度变化模拟的比较符合,而3-位氯代异戊烯和二氯异戊烷两个反应物的浓度模拟的稍差,这主要是这两个组分在起始阶段相对于其它两个组分的浓度较低的关系,但在反应后期就模拟的较好。
2 四釜串联连续反应器的模拟
前面得到的反应的数据和反应速率常数值均在间歇的小型设备中得到。由于该反应的特殊性:前期反应快,而且放热量大,后期反应慢。这样的反应不易在一个反应器中完成,且不合理。为了实现该反应的条件保持与间歇反应的数据相同,一个是采用活塞流式(Plug Flow)的管道反应器,另一个就是采用全混型多釜串联的反应器(CSTR)。活塞流式管道反应器可以利于传热,对于反应前期较为有利,但对于后期的反应需要大量的反应体积就不合适。全混型多釜串联反应器可以采用不同釜的体积,既可以满足传热的要求,又可以满足停留时间长的要求,比较合理。但在工业上宜采用同体积的反应器,便于生产和安装,但选用多大体积的反应器可以满足传热的要求又可以保障后期反应所需要的停留时间,这就有一个最佳化的问题,本文将不对此问题作更多的探讨。本文采用在不同反应釜放入不同的盐酸浓度,控制其反应速率,以达到既满足传热的要求又可满足后期反应停留时间的要求。下面将以四釜串联连续反应器为例作一模拟计算分析。在四个同体积的反应釜中放入和保持不同的盐酸浓度。反应釜中的盐酸浓度是按量按时向每釜通入氯化氢气体来实现。按此法对于各反应釜不同停留时间,不同盐酸浓度,进行反复计算,以得到我们所需比例的反应产物,按需要应该得到间歇试验所得到的反应产物如表5。
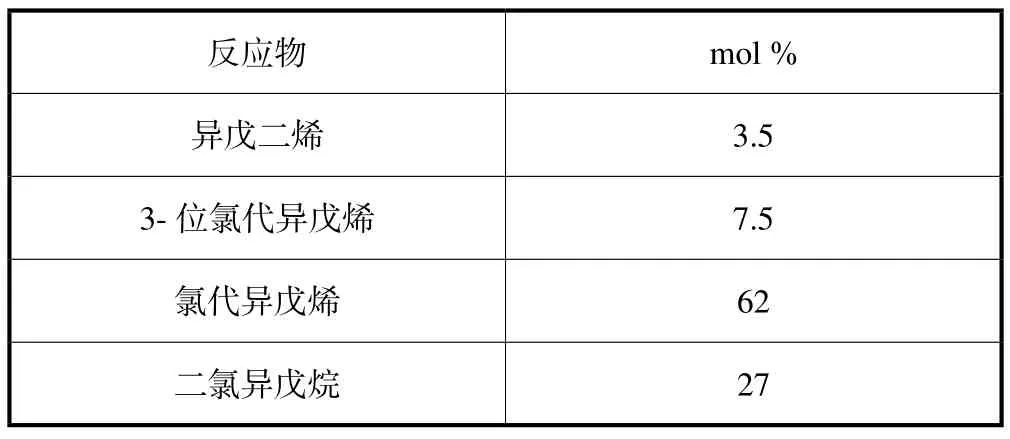
表5 希望的反应产物组成
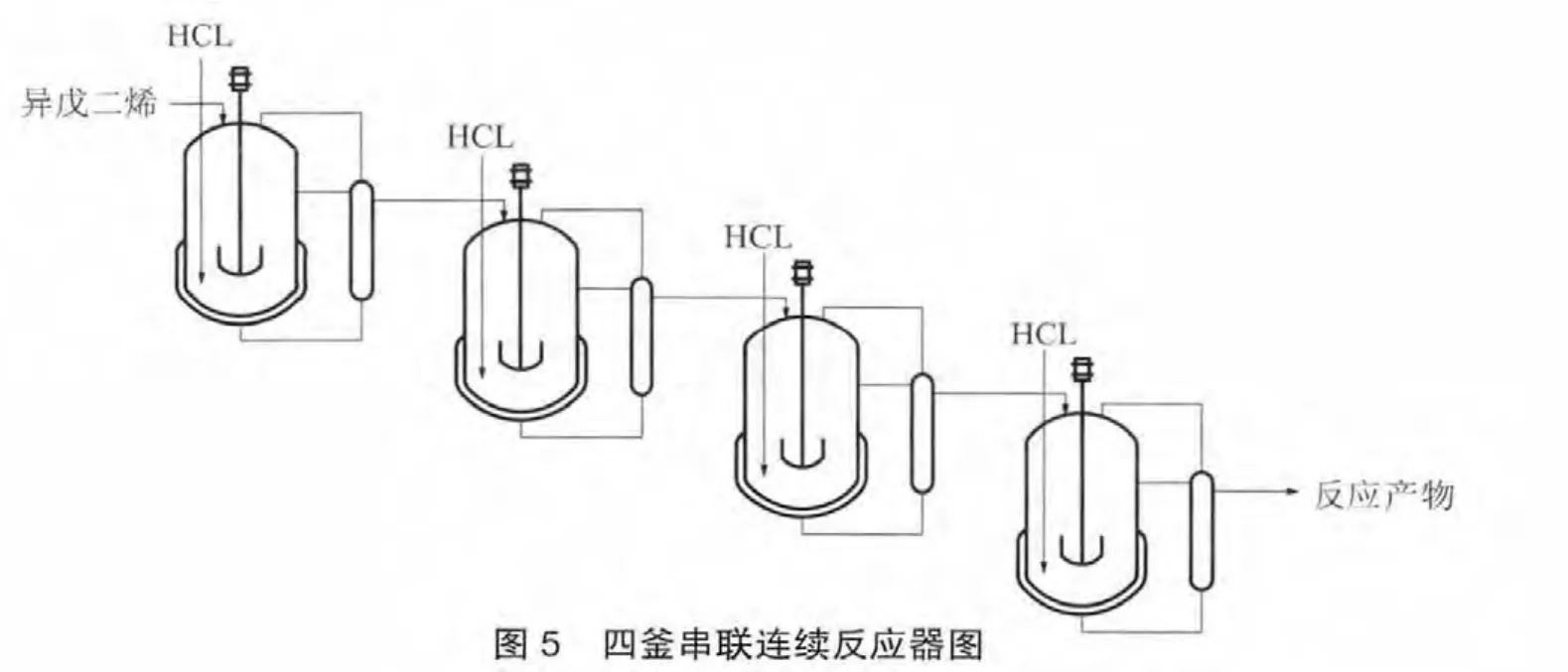
根据这个反应的特点以及工艺的要求,建立一个四釜连续搅拌反应器系统。在每个搅拌反应器中放入适量的异戊二烯以及给定的盐酸浓度的反应液,开动搅拌,保持反应的温度,当盐酸浓度下降时开启氯化氢的阀门注入氯化氢,保持反应液中盐酸的浓度。然后从第一个反应釜中注入定量的异戊二烯,多余的反应液经过沉降分离,油相溢流到下一个搅拌反应釜,第四釜溢流出的油相即为反应的产品。简要示意流程略图如图5。
根据原先计算的反应速率常数,假定反应釜内为全混型,釜内的油相反应物密度变化不大,反应物在釜内的停留时间为θ=V/υ,则对于第i(i=1~4)个反应釜建立目标函数如下:
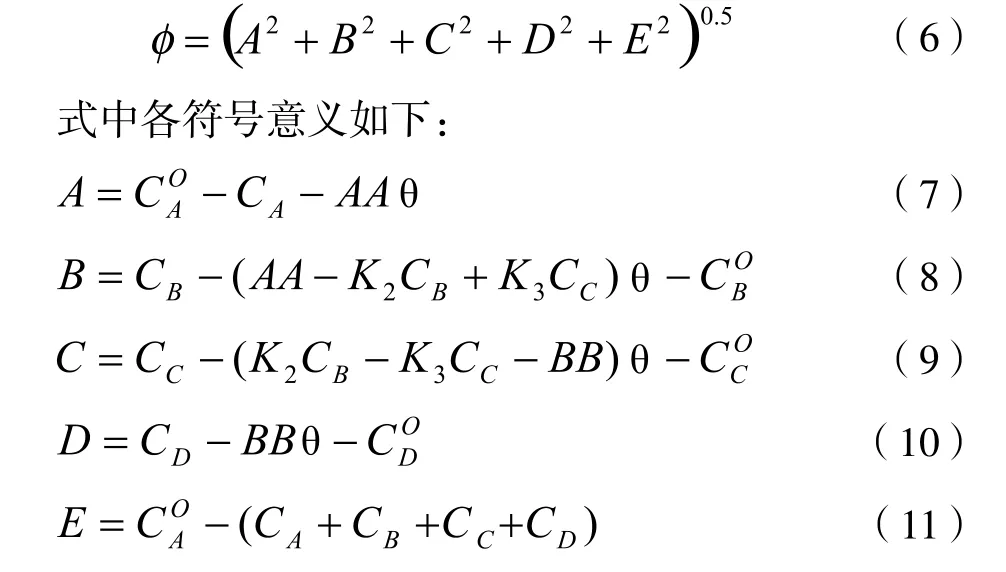
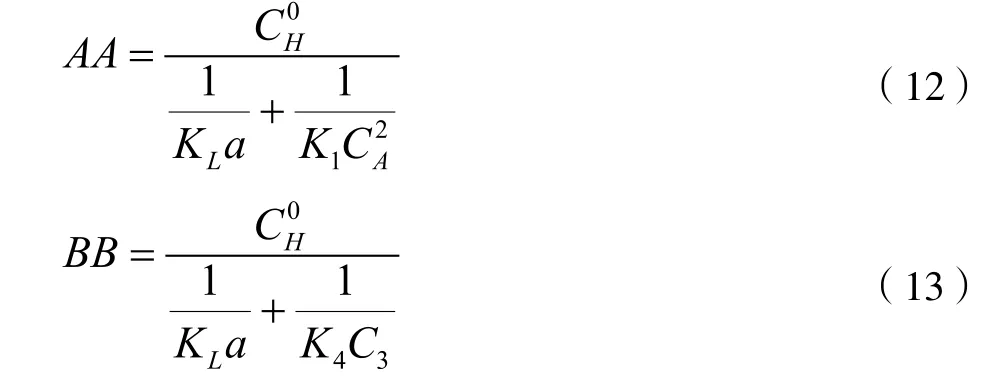

采用最优化方法对方程(6)求解极小值,可以求得反应釜出口物料的组成。第一个反应釜=10.0 gmol/L,其它各组分的起始浓度均为0;其它各釜的起始浓度为上一釜的出口浓度。联立求解平衡方程式(7~10)以及式(12,13),对每一反应釜采用Powell[14-15]方法求解目标函数方程(6)的极小值,求得每釜反应物出口的各组分浓度。经过反复计算和调节各釜的盐酸浓度和停留时间,得到:第一釜N=6.0 gmol/L,第二釜N=8.0 gmol/L,第三釜N=10.0 gmol/L,第四釜N=11.6 gmol/L,每釜的停留时间均为θ=0.5 h。计算结果汇总在下表6,表中的单位是gmol/L。
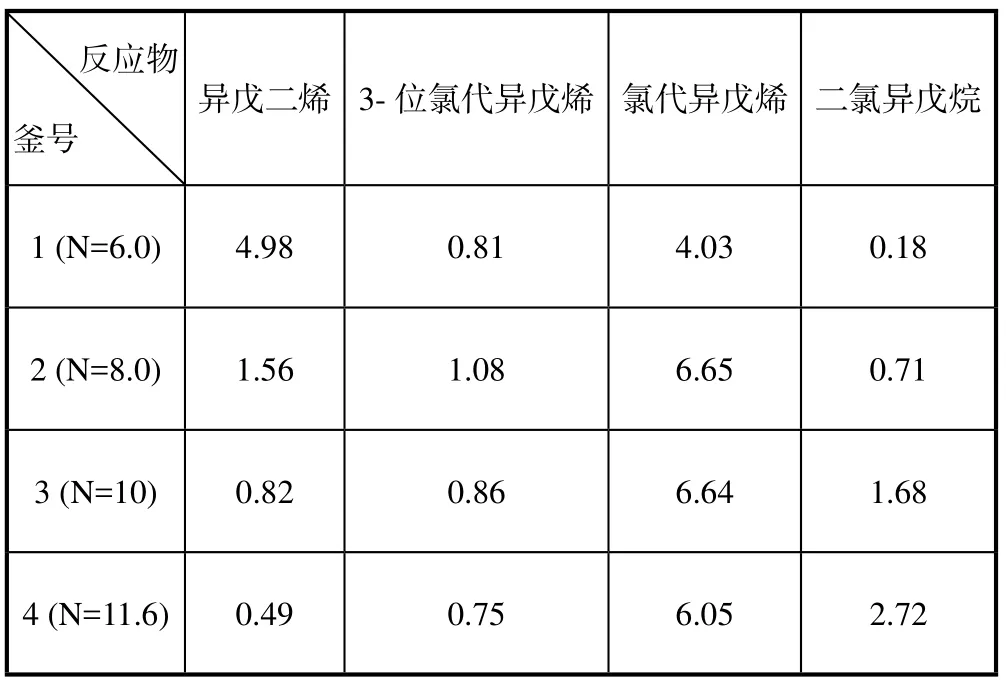
表6 四个反应釜的出口浓度
按表6的数据绘制图6。
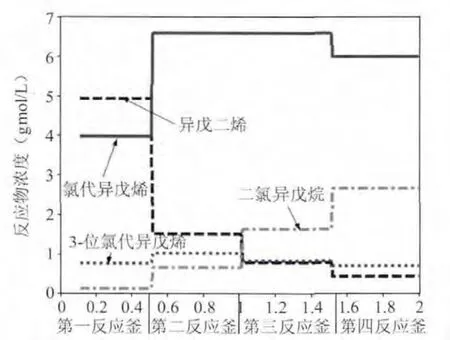
图6 表6中计算结果标绘的图
计算结果和目标值的比较如表7。
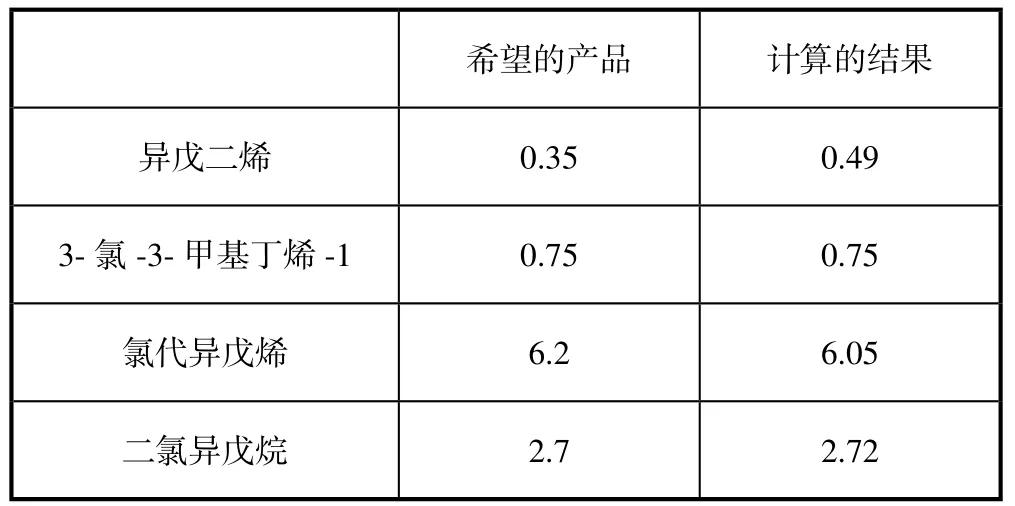
表7 计算结果与设定结果对比
计算的结果和目标的组分浓度基本相同。目前本文只是对于反应系统的一个假想,没有对最好的反应釜的配置个数以及大小(反应停留时间)进一步探讨。另外,在组分的计算中没有考虑反应生成的高沸物,实际生产中大概有5%~8%的高沸物存在。
3 结论
(1) 对盐酸浓度由N=5.9 gmol/L到N=10.2 gmol/L、异戊二烯的浓度为10 gmol/L范围的盐酸与异戊二烯加成反应动力学进行了研究,根据氯化氢与异戊二烯的加成反应,第1步反应为异戊二烯浓度的二级反应级数和两相之间的,传质按照双膜理论建立了过程宏观反应速率方程式,基于实验数据回归得到了不同浓度盐酸的各反应速率常数,可以较好地对盐酸浓度N=7.2 gmol/L、N=8.6 gmol/L、N=10.2 gmol/L时反应物浓度随时间的变化进行模拟,计算值与实验值相符。
(2)以四釜连续串联反应器系统为基础,根据不同反应釜放入不同的盐酸浓度即可以控制其反应速率又可以满足传热的要求及后期反应停留时间较长的要求,对四釜不同浓度盐酸下的反应情况进行了模拟计算,经过调整优化各釜的盐酸浓度和在釜内的停留时间,确定第一釜到第四釜盐酸浓度分别为6.0 gmol/L、8.0 gmol/L、10.0 gmol/L、11.6 gmol/L时,每釜停留时间均为0.5 h可以得到所需要的反应产物分布。
符号说明:
A — 代表异戊二烯,式(6)的代号;
AA — 式(12)的代号;
a — 液相传质界面,m2· m-3;
B — 代表3-位氯代异戊烯,式(6)的代号;
BB — 式(13)的代号;
C — 代表氯代异戊烯或式(6)的代号;
CA,CB,CC,CD— 分别代表异戊二烯,3-位氯代异戊烯,氯代异戊烯,二氯异戊烷在油相中的浓度,gmol/L,或者kgmol/m3;
CH— 代表氯化氢在水相中的浓度,gmol/L,或
kgmol/m3;
CO
A,COH— 分别代表异戊二烯和盐酸的起始浓度,gmol/L,或 kgmol/m3;
D — 代表二氯异戊烷,式(6)的代号;
K1— 第(1)反应式的速率常数,m3/(kgmol · h);
K2~K4— 第(2),(3),(4)反应式的反应速率常数,h-1;
KL— 液相界面传质系数,kgmol/(h · m2);
N — 代表盐酸的分子浓度,gmol/L;
t — 回归方程(5)的时间参数,min;
V — 反应釜内油相的体积,m3;
υ — 反应物油相的流量,m3/h;
θ — 为每釜的停留时间,h;
[1] D. L. Schuttz. Rubber World. 83,(1)87, 1980.
[2] Hydrocarbon Process.50(11),167,1971.
[3] M. Demalde, Chim.e Ind. (Milan),45,665,1963.
[4] A.J. Ultee. J.Chem.Soc. 530,1948
[5] A.J. Ultee. Rec.Tran.Chem. 68, 125-137, 1949.
[6] A.J.J. Meyers. J. Org.Chem. 25,1147, 1960.
[7] S.A. Rhone—Poulenc Ger. 1,117,107, 1961.
[8] Tomkuljak,Dezider, et al. Czech 129,141, 1968.
[9] Levy et al US 4,036,899, 1977.
[10] 王宝钧,齐福来. 异戊二烯与氯化氢加成反应的研究[J].化学反应工程与工艺,1986,2(2):66-68.
[11] 蒋正兴,郭世卓,祁正娟,等.异戊二烯加成反应器的设计[J].化学工程,2002,30(2):36-40.
[12] G.V.Reklaitis,A.Ravindran,K.M.Ragsdell. Enginering Optimization Method and Applications, JOHN WILEY AND SONS, 1983.
[13] Von Dr.-Ing.H. Eckhardt Numerische Verfahren In der Energietechnik, B.G. Teebner Stuttgart, 1978.
[14] M. J. D. Powell. Computer J. 7,155-162, 1964.
[15] M. J. D. Powell. Math. Prog. 4(2),193-201, 1973.
