同一组织来源的肝癌干细胞分化能力异质性的体外研究
2014-10-30刘虹麟许世清彭亮王在房青娄晋宁秦蕾王培刚张文健
刘虹麟,许世清,彭亮,王在,房青,娄晋宁,秦蕾,王培刚,张文健
同一组织来源的肝癌干细胞分化能力异质性的体外研究
刘虹麟,许世清,彭亮,王在,房青,娄晋宁,秦蕾,王培刚,张文健
100029 北京,中日友好医院临床医学研究所(刘虹麟、许世清、彭亮、王在、房青、娄晋宁、张文健),普外科(秦蕾);100101 北京,中国科学院生物物理所蛋白质与多肽重点实验室(王培刚)
通过比较肝癌干细胞的不同单细胞克隆的体外分化能力,分析同一组织来源的肿瘤干细胞分化能力是否具有异质性,以进一步明确肿瘤干细胞的分化特性,为靶向肿瘤干细胞的治疗提供实验依据。
通过有限稀释法对肝癌干细胞进行单细胞克隆培养,获得的单细胞克隆通过 MTT 测定比较其增殖能力。然后分别挑选增殖速度较快和较慢的 3 个克隆,采用 RT-PCR 方法比较其干细胞标志物表达水平。对干细胞标志表达水平高的 3 个克隆(A2、A3 和 B2)进行向成骨、软骨和脂肪方向的诱导分化。采用实时荧光定量 PCR 方法检测诱导前后成骨、软骨和脂肪标志分子的表达。
获得的 20 个单细胞克隆增殖能力不同,并且增殖能力快的克隆表达干细胞标志物 CD133、Oct4、c-kit、SCF、nestin 比增殖能力慢的克隆强。向成骨方向诱导后,A2、A3 和 B2 克隆I型胶原 mRNA 表达水平分别升高了(4.71 ± 0.11)、(2.13 ± 0.15)和(3.82 ± 0.3)倍;骨钙素 mRNA 的表达水平分别升高(8.55 ± 0.18)、(7.02 ± 0.03)和(7.91 ± 0.09)倍,说明 A2 克隆向成骨细胞分化能力最强。向软骨方向诱导后,B2 分化能力最强,软骨标志分子蛋白聚糖和II型胶原的表达分别上调(25.01 ± 0.19)倍和(17.49 ± 0.19)倍,而在 A2 未发生明显变化,A3 只轻微上调。向脂肪方向诱导后,A2、A3 和 B2 克隆脂联素 mRNA 表达水平分别升高了(6.12 ± 0.15)、(11.45 ± 0.36)和(12.41 ± 1.03)倍,过氧化物酶体增殖物激活受体 γ mRNA 的表达水平分别升高(4.92 ± 0.02)、(9.54 ± 0.18)和(8.96 ± 0.11)倍。
来源于同一组织的肝癌干细胞在分化能力上具有异质性,这可能是导致肿瘤组织异质性的原因之一,也提示靶向肿瘤干细胞的治疗需要联合用药。
肿瘤干细胞; 单细胞克隆; 细胞分化; 异质性; 间质细胞
对放化疗不敏感是恶性肿瘤临床治疗的重要难题,而肿瘤的异质性是导致疗效差的重要原因之一。近年来的研究认为肿瘤干细胞(cancer stem cells,CSCs)不仅是导致肿瘤异质性的根源,而且其本身对化疗极为不敏感,是肿瘤复发、转移和耐药的关键因素。如何杀灭或减少 CSCs 已成为肿瘤治疗中不可忽视的重要问题。近年来,利用 CSCs 具有分化能力的特点,通过诱导 CSCs 分化可以促进其对化疗药物的敏感性[1],并减少 CSCs 的数量以改善疗效[2]。
对 CSCs 的分化特性进行深入研究是建立以 CSCs 分化为目标的治疗手段所必需的。目前对各种组织来源 CSCs 的表型和自我更新及起始肿瘤能力的研究较多,但对 CSCs 分化能力的研究相对薄弱。CSCs 具有非常复杂的生物学特性,甚至来源于同一组织的肿瘤干细胞群也存在表型差异[3]。但对同一肿瘤组织中的 CSCs 在分化能力上是否具有异质性还不清楚。向间充质分化是 CSCs 分化能力的重要体现,本研究对同一组织来源 CSCs 的单细胞克隆进行间充质分化能力的比较,分析 CSCs 是否具有分化异质性。为阐明 CSCs 的分化特性和建立促进 CSCs 分化的治疗措施提供实验依据。
1 材料与方法
1.1 主要试剂和仪器
DMEM/F12 培养基和胎牛血清(fetal bovine serum,FBS)购自美国 Gibco 公司;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor, EGF)、白血病抑制因子(leukimia inhibitor factor,LIF)和 B27 购自美国 Invitrogen 公司;地塞米松、β-甘油磷酸钠、维生素 C、3-异丁基-1-甲基黄嘌呤、吲哚美辛购自美国 Sigma公司;RNA 提取试剂盒购自德国 Qiagen 公司;逆转录试剂盒购自美国 Promega 公司;实时荧光定量 PCR 试剂盒和 SYBR Premix EX Taq 购自日本 Takara 公司;TSE100 型倒置相差显微镜购自日本 Nikon 公司;Multiskan MK3 型酶标仪购自美国 Thermo 公司;ChemiDocTMXRS+ 型凝胶成像系统购自美国 Bio-Rad 公司。
1.2 方法
1.2.1 肝癌干细胞的来源和单细胞克隆培养 我们前期工作中从人原发性肝癌组织获得 CSCs,该细胞表达多种干细胞的标志性分子,并且具有很强的自我更新能力和成瘤能力[4]。
为更好地研究该 CSCs 的生物学特性,我们通过有限稀释法将其进行单克隆培养。细胞按照0.5 个/孔的浓度,200 μl/孔的终体积接种到 96 孔板,共接种 5 块。使用干细胞培养基进行培养,其配方为 DMEM/F12 1:1 培养基添加1% 胎牛血清、B27(1:50)、EGF(20 μg/L)、bFGF(10 μg/L)、LIF(10 μg/L)、2 mmol/L 谷氨酰胺、5 mg/L 胰岛素和 0.5 mg/L 氢化可的松。待细胞贴壁后挑选只有一个细胞的孔,作好标记。每 3 天换一次液,待细胞长至 90% 汇合时,将其一对一传至 24 孔板扩大培养。
1.2.2 MTT 法比较各克隆的增殖能力 将最终获得的单细胞克隆按照 500 个/孔的密度分别接种于 96 孔细胞培养板中,培养过夜后记为 0 d。用 MTT 法分别测定 0、1、3、5、7 d 的细胞增殖情况,每个时间点设置 3 个平行孔。测定时每孔加入 0.5 g/L MTT 50 μl,继续培养 4 h,然后完全吸弃培养基,每孔加入二甲基亚砜 150 μl,轻轻振荡使细胞内的结晶紫完全溶解,在酶标仪波长 492 nm 处测光密度值(值)。
1.2.3 RT-PCR 检测 CSCs 克隆的干细胞标志物 经 MTT 测定挑选增殖能力最快的 3 个克隆和最慢的 3 个克隆,比较其干细胞标志物的表达。实验按照以下方法重复一次。收集每个克隆细胞约 1 × 106个,使用总 RNA 提取试剂盒提取细胞总 RNA,取 1 μg 总 RNA 进行逆转录。然后采用 PCR 的方法分别扩增 CD133、Oct4、干细胞因子(stem cell factor,SCF)、c-kit 和 nestin。扩增产物经 2% 琼脂糖凝胶电泳后在凝胶成像系统上进行结果分析。
1.2.4 CSCs 克隆的间充质分化 挑选增殖快、干细胞标志表达水平高的 3 个克隆进行分化特性的比较,每种分化方向重复 3次,具体方法如下:
1.2.4.1 向成骨细胞的诱导分化 将各克隆的细胞培养在成骨分化诱导培养基中,其成分为 DMEM培养基添加10% FBS,以及终浓度为 0.1 μmol/L 的地塞米松、50 μmol/L 抗坏血酸和 10 mmol/L β-甘油磷酸钠,每 3 天更换一次培养基。诱导分化 21 d 后应用 qPCR 方法检测成骨细胞标志物I型胶原(collagen type I)和骨钙素的表达。以干细胞培养基培养相同时间的细胞作为对照。
1.2.4.2 向软骨细胞的诱导分化 将各克隆的细胞培养在软骨分化诱导培养基中,其成分为 DMEM培养基添加 10% FBS,以及终浓度为 10 μg/L 的转化生长因子 β1,1 μg/L 的 bFGF 和 6.25 mg/L 的胰岛素,每 3 天更换一次培养基。在诱导分化 21 d 后应用 qPCR 方法检测软骨细胞标志物蛋白聚糖和II型胶原的表达。以干细胞培养基培养相同时间的细胞作为对照。
1.2.4.3 向脂肪细胞的诱导分化 将各克隆的细胞培养至 90% 汇合,换成脂肪分化诱导培养基:DMEM 添加 1 μmol/L的地塞米松、0.5 mmol/L 的 3-异丁基-1-甲基黄嘌呤、2 μmol/L 的胰岛素、200 mmol/L 的吲哚美辛诱导培养 3 d,再用含2 μmol/L 的胰岛素、10% FBS 的 DMEM 培养1 d,循环 3 次后,用含 2 μmol/L 的胰岛素、10% FBS 的 DMEM 继续培养 8 d,每 3 天换液 1 次。诱导分化结束后应用 qPCR 方法检测脂肪细胞标志物脂联素和过氧化物酶体增殖物激活受体 γ(peroxisome proliferator-activated receptor,PPARγ)的表达。
1.2.5 实时荧光定量 PCR 细胞总 RNA 的提取和逆转录同 RT-PCR,使用 SYBR Green PCR 试剂盒,两步法进行 PCR 扩增。引物序列见表 1。反应结束后进行融解曲线分析,用计算 2-ΔΔCt的方法进行半定量分析,通过比较各分化方向上分化标志物的表达水平评价各克隆的分化能力。
1.3 统计学分析

表 1 人间充质分化相关基因的引物序列
2 结果
2.1 CSCs 的单细胞克隆培养
利用有限稀释法在 96 孔板上挑选出只有 1 个细胞的克隆,有些克隆在培养过程中增殖缓慢甚至停止,因此无法扩增培养。其他增殖较好的单细胞克隆最后扩增至 T25 细胞培养瓶并冻存,共获得 20 个克隆。
2.2 单细胞克隆增殖能力的比较
通过 MTT 测定法对 20 个克隆增殖能力进行了比较,结果如图 1 所示,各克隆增殖能力不同,随培养时间的延长差别更明显,最快的和最慢的克隆在第 7 天值相差超过 1 倍。

OD4922.5 2.0 1.5 1.0 0.5 0A1A2A3B1B2C1C2C3D1D2E1E2F1F2G1G2H1H2I1I2 1 3 5 7 时间(d)Time (d)
Figure 1 Evaluation of proliferation of CSCs clones by MTT assay
2.3 单细胞克隆的表型分析
为判断得到的 20 个克隆是否均为 CSCs,我们挑选了 3 个增殖快的和 3 个增殖慢的克隆进行干细胞标志物表达水平的比较。结果如图 2 所示:CD133、Oct4、c-kit、SCF 和 nestin 的表达水平在 3 个增殖快的克隆上均明显高于 3 个慢克隆。尤其以 CD133 和Oct4 最为明显。说明增殖能力强的克隆保持干性好,而增殖能力弱的克隆可能发生了向祖细胞的分化。因此后续分化实验选择增殖快的克隆进行。
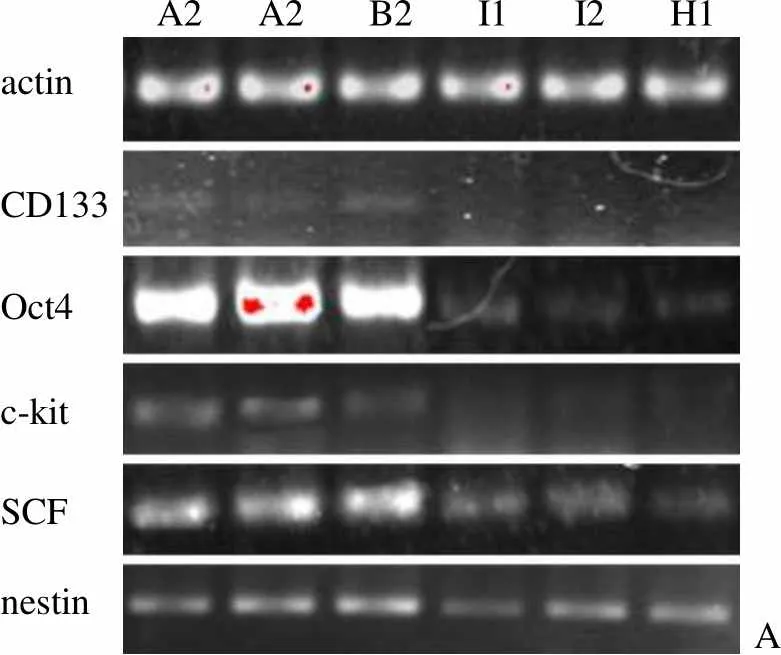
A2 A2 B2 I1 I2 H1 actin CD133 Oct4 c-kit SCF nestinA
Figure 2 Comparison of stem cell markers expression in CSCs clones by RT-PCR (A: Electrophoresis photo; B: Semi-quantity of line density)
2.4 单细胞克隆向成骨细胞分化能力的比较
将增殖快的 3 个克隆诱导 3 周后,A2、A3 和 B2 克隆I型胶原 mRNA 表达水平分别升高了(4.71 ± 0.11)、(2.13 ± 0.15)、(3.82 ± 0.3)倍,骨钙素 mRNA 的表达水平分别升高(8.55 ± 0.18)、(7.02 ± 0.03)、(7.91 ± 0.09)倍(图 3)。由此可见,A2 克隆向成骨细胞的分化更强,而 A3 克隆向成骨细胞分化的能力略弱于其他 2 个克隆。
2.5 单细胞克隆向软骨细胞分化能力的比较
诱导 3 周后,A2、A3 和 B2 克隆软骨蛋白聚糖 mRNA 表达水平分别升高了(1.4 ± 0.06)、(2.05 ± 0.08)、(25.01 ± 0.19)倍,II型胶原 mRNA 的表达水平分别升高(1.36 ± 0.02)、(2.02 ± 0.05)、(17.49 ± 0.19)倍(图 4)。A2 克隆的软骨标志分子表达水平与对照无差别,A3 克隆的轻微上调,只有 B2 克隆诱导后两种标志蛋白表达水平升高均非常显著(< 0.001)。由此可见,B2 克隆向软骨细胞的分化能力明显强于 A2 和 A3 克隆。

相对 mRNA 水平Relative mRNA level10 8 6 4 2 0 A2A2 诱导后A2-inducedA3A3 诱导后A3-inducedB2B2 诱导后B2-induced I 型胶原 骨钙素 Collagen I Osteocalcin
Figure 3 Comparison of osteogenic differentiation potential of CSCs single cell clones
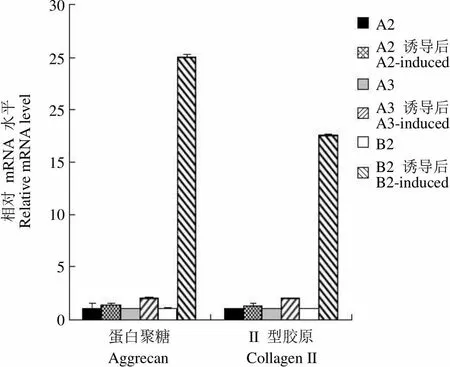
相对 mRNA 水平Relative mRNA level30 25 25 15 10 5 0A2A2 诱导后A2-inducedA3A3 诱导后A3-inducedB2B2 诱导后B2-induced 蛋白聚糖 II 型胶原 Aggrecan Collagen II
Figure 4 Comparison of chondrogenic differentiation potential of CSCs single cell clones
2.6 单细胞克隆向脂肪细胞分化能力的比较
诱导 3 周后,A2、A3 和 B2 克隆脂联素mRNA 表达水平分别升高了(6.12 ± 0.15)、(11.45 ± 0.36)、(12.41 ± 1.03)倍,PPARγ mRNA 的表达水平分别升高了(4.92 ± 0.02)、(9.54 ± 0.18)、(8.96 ± 0.11)倍。3 个克隆诱导后脂联素和 PPARγ 的表达均显著升高(均< 0.01)(图 5)。但从表达水平升高程度上,A3 和 B2 克隆明显强于 A2 克隆。

相对 mRNA 水平Relative mRNA level16 14 12 10 8 6 4 2 0A2A2 诱导后A2-inducedA3A3 诱导后A3-inducedB2B2 诱导后B2-induced 脂联素 PPAPγ Adiponectin
Figure 5 Comparison of adipogenic differentiation potential of CSCs single cell clones
3 讨论
目前的抗癌治疗主要靶向已分化的增殖力强的肿瘤细胞,这对未分化的尤其是处于静息期的CSCs 疗效甚微。多种证据表明 CSCs 对化疗、放疗和免疫治疗均很耐受[5-7],甚至有时治疗后反而导致 CSCs 的富集[8]。对 CSCs 分化特性进行深入研究以诱导 CSCs 分化可能是解决其对治疗不敏感的有效手段。
在肝癌 CSCs 的研究中,常使用表面标志物 CD133[9]和 CD90[10]进行 CSCs 的分选。但以一种或两种表面标志物所分选获得的细胞在其他表型和功能上并不一定完全一致。为避免细胞异质性带来的实验误差,本研究对CSCs 分化能力进行分析之前,将获得的肝癌干细胞进行了单细胞克隆培养,这些来源于单细胞的 CSCs 亚群保证了细胞的均质性,在进行 CSCs 分化能力的研究中排除了细胞异质性导致不同分化结果的可能。
我们对获得的单细胞克隆首先进行了增殖能力的比较,发现其增殖速度存在明显差异。由于 CSCs 休眠时表现缓慢增殖特点,但激活后表现高增殖速度,因此我们分别挑选 3 个增殖最快的和 3 个增殖最慢的克隆进行干性标志分子的检测。结果显示增殖快的克隆表达干性标志更强,这可能由于体外培养时添加的大量促增殖的生长因子导致 CSCs 激活进入快速增殖周期。
向间充质分化的能力用于鉴定多种组织来源 CSCs 的多向分化潜能,可代表 CSCs 的分化能力。本研究中 3 个快增殖克隆的间充质分化能力存在明显差异,在向成骨、软骨和脂肪方向分化各有优势方向,说明同一肝癌组织来源的 CSCs 存在明显的分化能力异质性。此前,Abelson 等[11]对卵巢透明细胞癌的多个单细胞克隆进行研究发现同一组织来源的 CSCs 在不同微环境中分化能力不同,说明同一癌组织中处于不同干细胞龛的 CSCs 表现不同的分化潜能。该研究说明外因导致同一组织中 CSCs 分化能力不同,而本研究证实存在某些内因导致 CSCs 分化能力差异。
综上所述,本研究结果表明:同一肝癌组织来源的肿瘤干细胞在分化能力上具有异质性。由此推测,这种分化能力的异质性可能是导致肿瘤细胞异质性的原因之一,也提示在靶向CSCs 分化治疗时需要采用联合治疗手段才能达到良好效果。
[1] Azzi S, Bruno S, Giron-Michel J, et al. Differentiation therapy: targeting human renal cancer stem cells with interleukin 15. J Natl Cancer Inst, 2011, 103(24):1884-1898.
[2] Gupta PB, Onder TT, Jiang G, et al. Identification of selective inhibitors of cancer stem cells by high-throughput screening. Cell, 2009, 138(4):645-659.
[3] Mukhopadhyay P, Farrell T, Sharma G, et al. Heterogeneity of functional properties of clone 66 murine breast cancer cells expressing various stem cell phenotypes. PLoS One, 2013, 8(11):e78725.
[4] Liu H, Zhang W, Jia Y, et al. Single-cell clones of liver cancer stem cells have the potential of differentiating into different types of tumor cells. Cell Death Dis, 2013, 4:e857.
[5] Yan H, Chen X, Zhang Q, et al. Drug-tolerant cancer cells show reduced tumor-initiating capacity: depletion of CD44 cells and evidence for epigenetic mechanisms. PLoS One, 2011, 6(9)e24397.
[6] Li X, Lewis MT, Huang J, et al. Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy. J Natl Cancer Inst, 2008, 100(9): 672-679.
[7] Reim F, Dombrowski Y, Ritter C, et al. Immunoselection of breast and ovarian cancer cells with trastuzumab and natural killer cells: selective escape of CD44high/CD24low/HER2low breast cancer stem cells. Cancer Res, 2009, 69(20):8058-8066.
[8] Liu H, Patel MR, Prescher JA, et al. Cancer stem cells from human breast tumors are involved in spontaneous metastases in orthotopic mouse models. Proc Natl Acad Sci U S A, 2010, 107(42):18115- 18120.
[9] Ma S, Lee TK, Zheng BJ, et al. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway. Oncogene, 2008, 27(12):1749-1758.
[10] Yang ZF, Ho DW, Ng MN, et al. Significance of CD90+ cancer stem cells in human liver cancer. Cancer Cell, 2008, 13(2):153-166.
[11] Abelson S, Shamai Y, Berger L, et al. Niche-dependent gene expression profile of intratumoral heterogeneous ovarian cancer stem cell populations. PLoS One, 2013, 8(12):e83651.
Differentiation heterogeneity of liver cancer stem cells derived from the same cancer tissue
LIU Hong-lin, XU Shi-qing, PENG Liang, WANG Zai, FANG Qing, LOU Jin-ning, QIN Lei, WANG Pei-gang, ZHANG Wen-jian
To investigate the differentiation heterogeneity of cancer stem cells (CSCs) by comparing differentiation potential of clonally expanded subpopulations derived from the same cancer tissue.
Single cell clones ofCSCs were obtained by limited dilution method. The proliferation of these clones was evaluated by MTT assay. The expression of stem cell markers was detected by RT-PCR. Three clones (A2, A3 and B2) were induced to differentiate toward mesenchymal-like cell for 3 weeks. Real-time PCR was used to detect the mRNA levels of mesenchymal-specific markers.
The proliferation of the obtained 20 clones was differed between each other, and the expression of stem cell markers CD133, Oct4, c-kit, stem cell factor and nestin was higher in highly proliferation of clones than in the low proliferation of ones. Upon induction toward osteoblast, the mRNA level of collagen type I in clone A2, A3 and B2 was up-regulated to (4.71 ± 0.11),(2.13 ± 0.15) and (3.82 ± 0.3) times respectively; and the mRNA level of osteocalcin was up-regulated to (8.55 ± 0.18), (7.02 ± 0.03) and (7.91 ± 0.09) times respectively, which showed that A2 has stronger potential toward osteoblast. Upon induction toward chondrocyte, clone B2 exhibited very strong differentiation potential as shown the mRNA level of aggrecan and collagen type II was up-regulated to (25.01 ± 0.19) and (17.49 ± 0.19) times. However, the expression of aggrecan and collagen type II was not increased in clone A2 and increased slightly in clone A3. Upon induction toward adipocyte, the mRNA level of adiponectin in clone A2, A3 and B2 was up-regulated to (6.12 ± 0.15), (11.45 ± 0.36) and (12.41 ± 1.03) times respectively; and the mRNA level of peroxisome proliferator-activated receptor (PPARγ) was up-regulated to (4.92 ± 0.02), (9.54 ± 0.18) and (8.96 ± 0.11) times respectively, which suggested that A3 and B2 had stronger differentiation potential toward adipocyte.
The CSCs derived from the same cancer tissue has heterogeneity in differentiation potential, which may be one reason of tumor heterogeneity. These results indicate that combination of drugs might be needed in targeting CSCs treatment in the future.
Tumor stem cells; Single cell clone; Cell differentiation; Heterogeneity; Mesenchymal stem cells
WANG Pei-gang, Email: peigangwang@gmail.com; ZHANG Wen-jian, Email: zwj-72@163.com
10.3969/cmba.j.issn.1673-713X.2014.03.001
国家重点基础研究发展计划(973 计划)(2009CB521804);国家自然科学基金(81370873、81302334)
王培刚,Email:peigangwang@gmail.com;张文健,Email:zwj-72@163.com
2014-02-19
Author Affiliations:Institute of Clinical Medical Sciences (LIU Hong-lin, XU Shi-qing, PENG Liang, WANG Zai, FANG Qing, LOU Jin-ning, ZHANG Wen-jian), Department of Surgery (QIN Lei), China-Japan Friendship Hospital, Beijing 100029, China; Key Laboratory of Proteins and Peptide Pharmaceuticals, Institute of Biophysics, Chinese Academy of Science, Beijing 100101, China (WANG Pei-gang)
