硫化氢应力腐蚀开裂原因的试验
2014-10-25王全庭
王全庭
(鹤壁中德石化装备有限公司,河南 鹤壁 458030)
多年来硫化氢应力腐蚀开裂(简称SSCC)的问题困扰着石化装备行业,由此造成的损失也很多,到底产生SSCC的原因是什么?经查,国内外都沿用了:硫化氢电离,腐蚀铁,生成硫化亚铁,硫化亚铁电位较正,疏松多孔,加快腐蚀,在渗氢、拉应力的共同作用下,产生裂纹和断裂。这一理论使SSCC有些问题得不到圆满的解释,因此进行了研究和验证,根据多年经验,从下述三个方面(实际是多个方面)进行了实验:(1)双极性电化学腐蚀;(2)脆性开裂是从阴极区渗氢所致;(3)氢原子在钢中可在某些地方汇集。
1 双极性电化学腐蚀试验
双极性电化学腐蚀是一对正负电位相差比较大的电极,金属导电体在它两电极之间又形成一对新的正负极,电化学反应都是在后形成的电极上进行的。
实验方法:取一根长100 mm,粗4 mm的铁丝,一端(约30 mm)镀0.2 mm的锌,一端(约30 mm)镀0.1 mm的银,中间用寛5 mm的塑料薄膜扎住,提起来,置于杯中,杯中食盐的质量浓度为10%的溶液,1.0N的盐酸(见图1)。可观察到双极性电化学腐蚀的过程,即氢气不但在锌镀层上冒出,而且转到旁边的铁基体上和银镀层上,银镀层旁边的铁基体铁被腐蚀,锌镀层旁边的铁基体上氢离子被还原。

图1 双极性电化学腐蚀试验Fig.1 Bipolar electrochemical corrosion test
另一个试验是硫化亚铁和氧化铁对铁基体所形成的双极性腐蚀,取两只大口的塑料瓶,一个瓶装活化了的硫化亚铁(用滤纸裹好)和含稀硫酸亚铁的水溶液,一个装活化了的氧化铁(用滤纸裹好)和含稀硫酸高铁的水溶液,两瓶用φ4 mm的铁丝穿起来(见图2)。同时分别在两瓶内放入同样的铁丝,以便和穿入的铁丝比较。两天后观察,穿入在两瓶的铁丝,在氧化铁瓶中的部分有腐蚀;在还原瓶的部分没腐蚀,仔细观看,还镀上了微量的铁。分别于两瓶的铁丝都没变化。上述试验证明了硫化亚铁和氧化铁分别同时存在时,会使铁基体发生双极性腐蚀和还原,而且腐蚀和还原速度很快。
2 氢脆性试验
取15根100 mm长,直径φ3 mm的弹簧钢丝,经淬火调质处理,分成三组,每组5根,其中一组不镀,一组全镀锌,另一组只留中间10 mm不镀,其余全镀锌,锌层厚度为0.2 mm,然后三组一齐置于食盐质量浓度为10%的溶液,100 mL/L的盐酸中(见图3)。

图2 三氧化二铁—硫化亚铁原电池Fig.2 Ferric oxide ―― Its primary battery
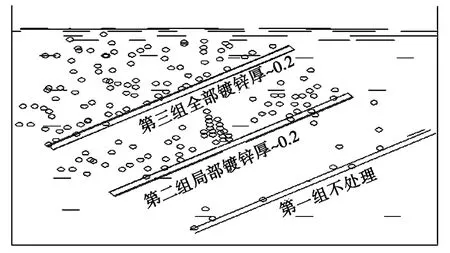
图3 渗氢氢脆性试验Fig.3 Hydrogen permeation and embrittlement test
此时可观察到第二组中间不镀的地方也在冒氢气,待试件上的锌刚退完,或者还没有彻底退完时,就取出试件,马上进行弯曲试验,见表1。

表1 试验结果Table1 Test result
上述试验结果第一组不镀的基本不显脆性,为最好;第二组中间不镀的最差(不镀处是阴极渗氢最多);第三组次之。在SSCC中硫化亚铁电位为负值,且较大,能使铁基体形成阴极,使其还原析氢和渗氢,因此会使罐基体发生氢脆性。
3 氢在铁基体的状态
盛装氢的压力容器,即便压力很大,常温下,向钢中渗氢也是极少的,不足以引起严重后果,说明氢是以原子状态进入钢中的,而不是氢分子。在钢中含氢量最多的是铁镀层,是过保和状态。因此选了φ50 mm的圆钢,镀上0.2~0.5 mm的铁,所用的工艺为低温氯化亚铁镀铁工艺,镀好后迅速置于锭子油的烧杯中见图4,锭子油温度为30~50℃。

图4 氢状态试验Fig.4 Hydrogen test
再放置一对正负极板,电压约40~60 V,阴极板每隔10 s瞬间触一下被镀即可。观察发现靠近阴极的一侧冒得气泡多,靠近阳极的一侧少,还可听到铁镀层的爆裂声,把被镀件转180°,还是靠近阴极的一侧多。试验说明:被镀件中的氢有些是带电荷的(质子),会被阴极上的电子所吸引,所以冒得就多一些。氢引起基体脆性开裂应该和此种现象有关:电子会在有“缺陷”地方汇集,氢(质子)有穿越性被吸引,所以就在“缺陷”点形成氢压,加拉应力造成了开裂。
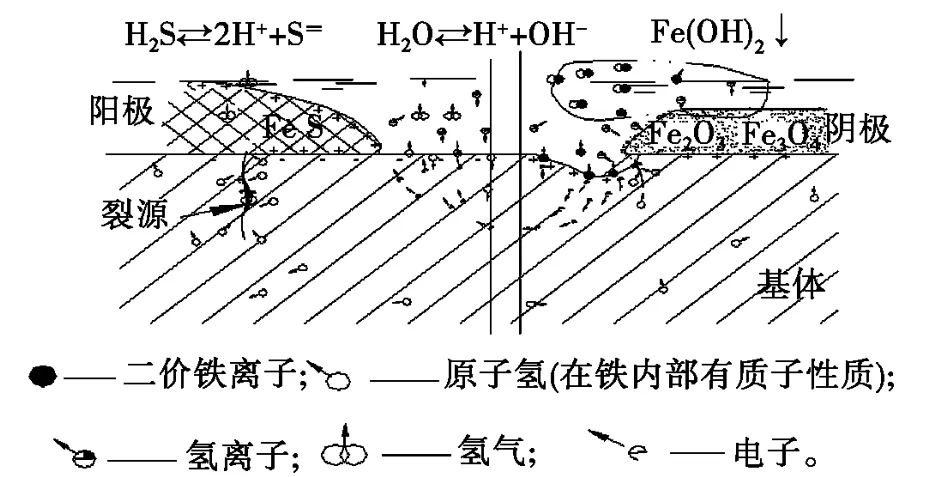
图5 SSCC基本原理图Fig.5 Principle of SSCC
4 结论
根据上述试验验证的结果可得到如下结论:硫化氢应力腐蚀开裂原因是硫化氢电离,硫离子和铁生成硫化亚铁,硫化亚铁电位为负值,且较大,能和电位较正的氧化铁形成微电池的两极,在电解质不连续、两电极电动势的作用下,可使基体微小部分形成双极性微电池,阳极区腐蚀,阴极区析氢,部分氢以原子态渗入基体,和拉应力叠加,造成开裂。
