利用GS技术选育耐高温高糖葡萄糖酸盐生产菌
2014-10-24沈玉平张祖姣
沈玉平 张祖姣
(湖南科技学院 生命科学与化学工程系,湖南 永州 425199)
葡萄糖酸盐主要用于人体微量元素补充[1]和建筑添加剂,在食品、建筑行业有着广泛的应用。
葡萄糖酸盐主要通过微生物发酵法生产。我国大部分地区夏季温度高、时间跨度长。因此,夏季生产必然导致能却能耗的增加。此外,在葡萄糖酸发酵过程中,采用高浓度葡萄糖发酵,葡萄糖的分解产生高浓度的葡萄糖分解代谢物如葡萄糖酸、丙酮酸等阻遏物,阻遏葡萄糖氧化酶的合成[2],延长发酵时间。因此,选育具有耐高温、高糖性状的葡糖糖酸盐生产菌株具有重要的意义。
基因组改组(GS, Genome Shuffling)技术是分子定向进化在全基因组水平上的延伸,它以整个基因组为操作对象,模拟生物进化过程,将具有不同正突变的多个全基因组进行随机重组,从而快速选育出高产优质菌株或目的性状得到较大改进的菌株。Zhang Ying-Xing[3]等通过基因组改组快速提高了弗氏链霉菌生产泰乐星的能力。Ranjan Patnaik[4]等通过基因组改组提高了乳酸菌的耐酸能力,大大提高了乳酸的合成能力。Genome Shuffling技术最大的优点就是可以在基因型和表型的相关机制不是很清楚的情况下可以迅速将决定某一理想表型的多个甚至十几个突变基因组合在一起从而达到改进的目的。因此,对于提高微生物的环境耐受性等基因编码机制尚不清楚的性状,Genome Shuffling技术有着独特的优势。本文在理化诱变的基础上,利用Genome Shuffling技术选育耐高温和高初始葡萄糖糖性能优良的改组菌株,并通过摇瓶实验5 L发酵罐实验验证其耐受高温和初始葡萄糖糖性能。
1 材料与方法
1.1 材料
1.1.1 菌株
黑曲霉ZBY-7(Aspergillus.niger ZBY-7)[5],本实验室保存。菌种保藏于4 ℃的斜面培养基中,每两个月转种一次。
1.1.2 试剂
蜗牛酶、 纤维素酶、溶菌酶购于上海励瑞生物科技有限公司;亚硝基胍(NTG)为FLUKA公司产品,其他化学试剂均为国产分析纯试剂。
1.1.3 培养基
斜面培养基:葡萄糖 300 g、KH2PO40.15 g、KCl 0.2 g、MgSO4.7H2O 0.12 g 、(NH4)2HPO40.6 g、琼脂 20 g,蒸馏水1000mL,自然pH。
初筛培养基:参阅文献[6]。
发酵培养基:葡萄糖 300 g、MgSO4.7H2O 0.15 g 、KH2PO40.35 g、CaCO335 g、尿素 0.55 g,蒸馏水1000 mL,自然pH。
原生质体再生培养基[6,7]:初筛培养基中加入 0.6M 的MgSO4渗透压稳定剂即可。
1.2 方法
1.2.1 亚硝基胍-紫外诱变
挑取新鲜斜面上孢子将浓度调整到 1×106个/ml,制成孢子悬液。准确称取5mg 亚硝基胍加入到6 cm无菌培养皿中,用1滴丙酮助溶,加入5 ml孢子悬液,在功率为15 W,距离为30 cm的紫外灯下分别照射0.5、1、1.5、2、2.5、3、3.5、4 min,在红光下取处理后的孢子悬液0.1ml涂布于平板上,培养后菌落计数,绘制致死曲线。
1.2.2 正突变基因库的获得
出发菌株经亚硝基胍-紫外诱变,37 ℃、30 % 初始葡萄糖浓度条件下耗糖速率大于出发菌株30 ℃、10 % 初始糖浓度条件下耗糖速率的突变株为正突变株。
1.2.3 基因组改组
1.2.3.1 原生质体的制备 参阅文献[7]。
1.2.3.2 原生质体的灭活 将原生质体于 50 ℃水浴处理1、2、3、4、5 min,计算原生质体的致死率。
1.2.2.3 基因组改组 将各正突变株原生质体按1:1比例混合,在25 %聚乙二醇(PEG)6000、0.01 mol/L CaCl2溶液促融下对个正突变株的整个基因组进行随机重组,并通过定向筛选技术筛选出耐受高温、高初始葡萄糖性状得到提高的改组菌株。
1.2.4 筛选方法
1.2.4.1 初筛 根据初筛平板上透明圈的大小进行初筛。
1.2.4.2 复筛 黑曲霉发酵生产的葡萄糖酸导致发酵液pH,从而抑制菌株继续产酸,因此摇瓶发酵时采用 CaCO3中和产生的葡萄糖酸,以达到调节pH的目的。葡萄糖酸钙的溶解度很低(40 g.L-1),未溶解的葡萄糖酸钙以晶体的形式吸附在菌体上。因此,检测发酵液中的葡萄糖酸钙的含量不能真实的反应发酵所产生的葡萄糖酸。刘建忠[8]经多年研究发现,黑曲霉 ZBY-7发酵消耗的葡萄糖几乎完全被用来产酸,葡萄糖的消耗量能够真实的反应菌株在发酵过程中葡萄糖酸的产生量。因此,本文通过检测发酵液中残糖含量,以葡萄糖的消耗速率(mg.h-1.mL-1)表征菌株的产酸能力。
1.2.5 葡萄糖的测定
葡萄糖的测定采用氧化还原滴定法[8]。
1.2.6 5 L发酵罐水平实验
在摇瓶实验的基础上,在5 L发酵罐水平上考察高浓度初始糖、高温条件下改组菌株发酵状况。发酵条件为pH 6.0,温度37℃,初始葡萄糖浓度为30%,转速 950 rpm 通气量前2 h 为2 vvm,以后均为8 vvm,采用40% NaOH作为 pH调节剂,依据流加NaOH的体积计算发酵过程中产生的酸。
2 结果与分析
2.1 亚硝基胍-紫外线诱变
通过紫外线、亚硝基胍处理,其处理时间和致死率关系如图1。
研究表明,致死率85%左右比较容易获得正突变株,因此我们选择3.0 min的处理时间。
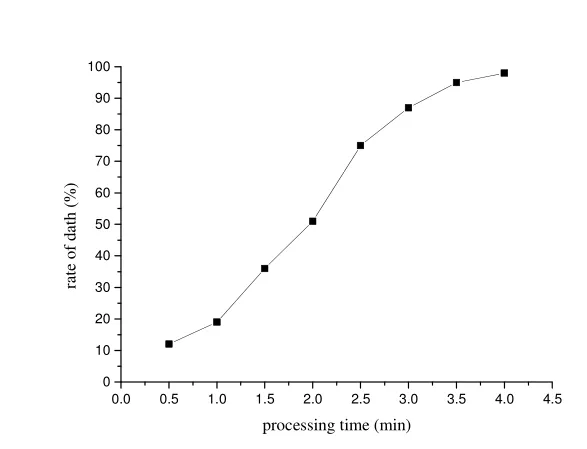
图1.亚硝基胍-紫外线诱变会致死曲线
2.2 正突变基因库的获得
本文通过经典的亚硝基胍-紫外线诱变获取基因组改组所需的正突变基因组库。以黑曲霉 ZBY-7为出发菌株度,亚硝基胍、紫外线处理3 min,获得正突变株9株,其耗糖速率如表1。
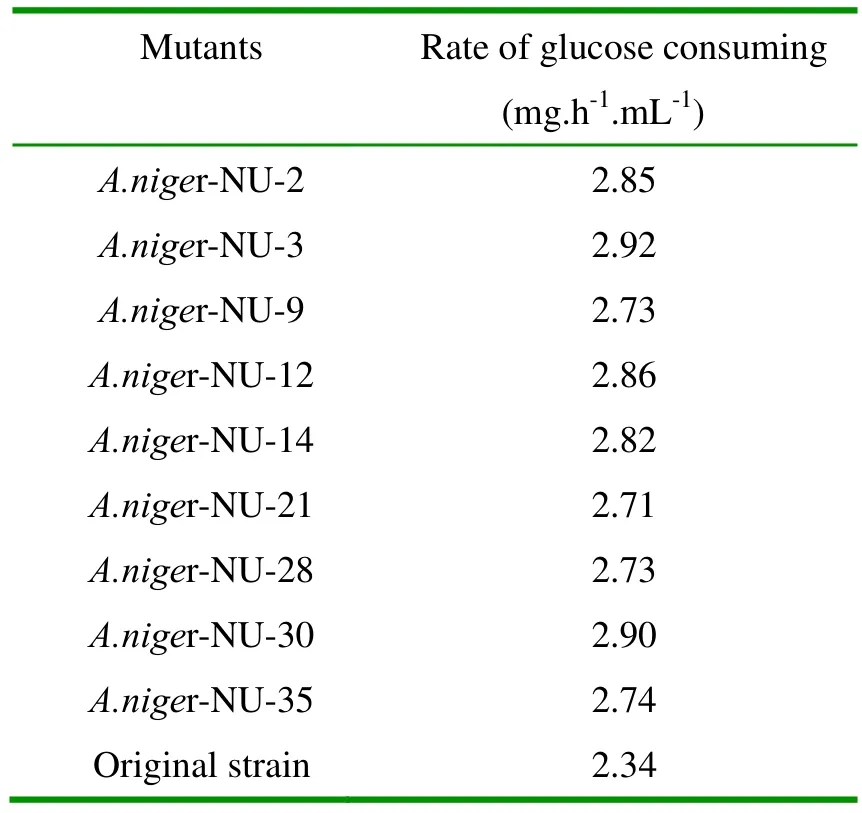
表1 突变株耗糖速率
从表1我们可以看出,在初始葡萄糖浓度提高到30 %,发酵温度提高到37 ℃情况下,突变耗糖速率较出发菌株有较大幅度的提高,其中最高的一株 A.niger-NU-3 较出发菌株提高12.48 %。这证明,通过诱变,各正突变株初步具有了耐高温高糖的性能。
2.3 原生质体灭活
原生质体分别处理 1、2、3、4、5min,其致死情况见图2。
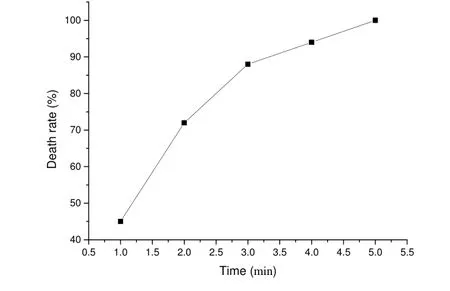
图2.黑曲霉原生质体灭活致死曲线
从图2我们可以看出,热灭活能够完全灭活黑曲霉原生质体。因此,为排除基因组改组过程中亲本的干扰,我们采用的50 ℃,水浴5 min的灭活方式进行亲本灭活。
2.4 基因组改组
以亚硝基胍-紫外线诱变所获得的 9株正突变株为出发菌株进行基因组改组,获得8株正融合株,结果如表2所示。其中耗糖速率最高的一株为 3.00mg.h-1.mL-1,命名为A.niger-GS-30,其耗糖速率较出发菌株提高28.21%。
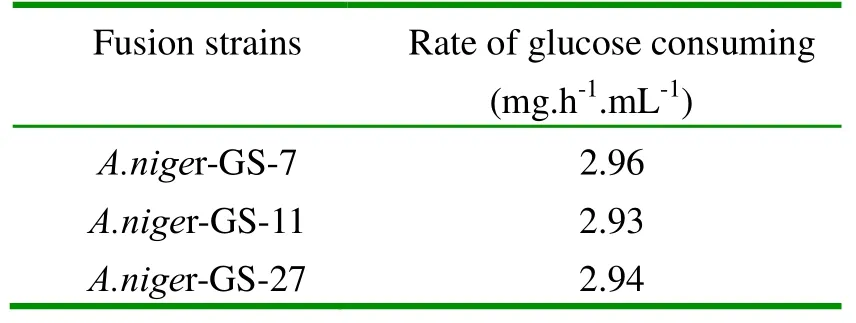
表2融合子的耗糖速率

A.niger-GS-30 3.00 A.niger-GS-34 2.98 A.niger-GS-42 2.93 A.niger-GS-58 2.94 A.niger-GS-62 2.96
在此次基因组改组中,菌株的耗糖速率未得大幅度提高,这可能是菌株的耗糖能力已接近极限,很难再提高;也有可能是由于遗传背景差异较小造成的,在今后的改组中,可以采用不同的诱变剂诱变获得遗传背景差异较大的菌株,可能会取得更好的效果。
2.5 5 L发酵罐水平发酵实验
为验证耐高糖高温菌株A.niger-GS-30在发酵罐水平上是否具有可信性和可重复性,本实验进行了5L发酵罐的葡萄糖酸钠的发酵实验。发酵过程中,对残糖(RG)和葡萄糖酸钠的产量(以葡萄糖酸钠的浓度表示,g.L-1)作了检测,并将与出发菌株作了比较,结果如图3。
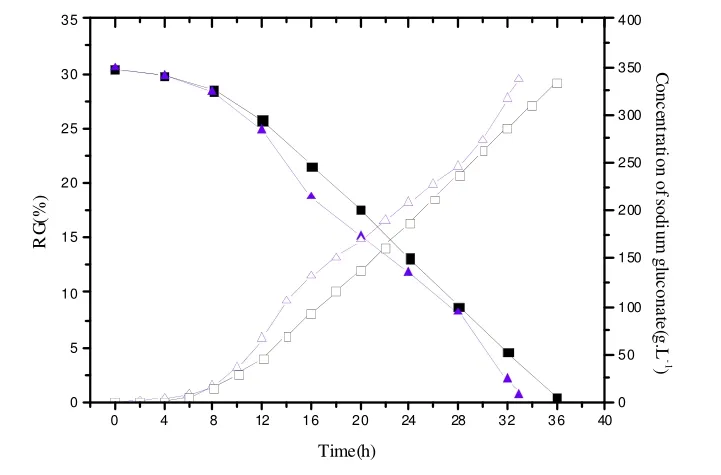
图3.A.niger-GS-30在 5 L发酵罐水平上残糖浓度变化-葡萄糖酸钠产量关系图
图中“◆”为出发菌株残糖A.niger-ZBY-7含量,“◇”为出发菌株 A.niger-ZBY-7葡萄糖酸钠含量;“▼”为改组菌株 A.niger-GS-30残糖含量,“◇”为改组菌株A.niger-GS-30葡萄糖酸钠含量。
从图3中我们可以看出,在高初始糖浓度高温条件下,随着葡萄糖浓度的下降,葡萄糖酸钠浓度持续升高。A.niger-GS-30发酵2小时时已经流加开始NaOH,说明菌体已经开始产酸,而出发菌株直到发酵 4小时后才开始流加NaOH。比起出发菌株,A.niger-GS-30的适应期缩短2h。发酵时间上,在同为30%的初始糖浓度下,出发菌株的发酵时间为36h,而A.niger-GS-30的发酵时间为33h,发酵时间缩短3h。
从发酵的效果看,A.niger-GS-30产率为40.82 g.h-1,比出发菌株37.12 g.h-1的产率提高9.97 %;A.niger-GS-30的转化率与出发菌株相当,分别为113.03%和111.96%。无论是发酵的产率还是转化率,A.niger-GS-30都比出发菌株有一定的提高。
3 结论
3.1 通过亚硝基胍-紫外线复合诱变,初步获得具有耐受高温高糖性能的突变株,作为正突变株基因库。
3.2 热灭活5 min 可完全灭活黑曲霉原生质体,可有效的排除基因组改组后改组菌株筛选的干扰。
3.3 通过基因组改组,获得一株能耐受37 ℃高温,30 %初始葡萄糖的改组菌株,其耗糖速率较出发菌株提高28.2 %,发酵温度提高7 ℃,初始葡萄糖耐受浓度由10 %提高到30 %。
4 讨论
本文通过基因组改组成功获得一株耐高温高糖的葡萄糖酸盐生产菌,无论耗糖速率还是发酵温度及初始糖耐受浓度均得到较大提高。这说明,在现今环境耐受性能的机制及基因编码控制尚未完全弄清楚的情况下,使用 Genome shuffling技术提高菌株的环境耐受性仍不失为一种快速便捷的方法。但是,如果不采用多元化来源的正突变基因库,其性能提高幅度将大大降低。在本文中,基因组改组的出发菌株均为亚硝基胍-紫外线复合诱变后的正突变株,其遗传背景差异较小,因此,本次改组虽然耐高温高糖的性能得到较大提高,但葡萄糖的耗糖速率却提高有限。此外,如果不采用合理的方法定向筛选改组菌株,也将大大增加筛选的工作量。在本文中,采用热灭活的方法排除亲本的干扰,并通过透明圈的方法进行初筛,这样就大大减少了定向筛选的工作量。
[1]Drummond M F.A reappraisal of economic evaluation of pharmaceuticals-science or marketing[J].Pharmacoeconomics, 1998,14(1):1-9.
[2]王普,李友荣.葡萄糖氧化酶产生菌发酵条件研究[J].工业微生物, 1990,20(1):20-24.
[3]Zhang Y X, Perry K, Vinci V A, et al.Genome shuffling leads to rapid phenotypic improvement in bacteria[J].Nature,2002, 415:644-646.
[4]Patnaik R , Louie S, Gavrilovic V, et al.Genome shuffling of Lactobacillus for improved acid tolerance[J].Nature Biotechnology, 2002, 20:707-712.
[5]计亮年,刘建忠,杨惠英,等.黑曲霉发酵葡萄糖生产葡萄糖酸镁(锰)[P].中国发明专利, CN1188152, 1997-12-17.
[6]Markwell J, Frakes L G, Brott E C, et al.Aspergillus niger mutants with increased glucose oxidase production[J].Applied Microbiology and Biotechnology.1989, 30: 166-169.
[7]姚婷婷,王正祥.黑曲霉原生质体的制备、再生及转化条件[J].食品与生物技术学报, 2006,25(4):116-119.
[8]刘建忠.金属离子地黑曲霉生物合成酶的影响及其作用[D].广州:中山大学, 2001.
