NOTCH1靶基因的筛选
2014-10-23刘文斌丁洪波
刘文斌,李 睿,曾 驰,丁洪波
(1.武汉轻工大学医学技术与护理学院,湖北武汉 430023;2.武汉轻工大学生物与制药工程学院,湖北武汉 430023)
NOTCH1信号通路是少数几个高度保守的发育相关的信号通路之一,它使得细胞间实现短程通讯。NOTCH1信号可以促进或抑制细胞增殖、细胞凋亡、特定细胞归宿或者细胞分化的激活。这个信号通路中成员的不正常表达或功能异常会导致一系列发育紊乱甚至癌症,例如Alagille综合症。某些重要的胚胎或干细胞实验操作也离不开使用NOTCH1信号通路的拮抗剂[1]。NOTCH1信号通路的激活需要配体的结合及蛋白酶(如ADAM和γ-secretase)的切割,并离不开靶基因的功能发挥。NOTCH1主要的配体有 JAG1,JAG2,DLL1,DLL3 和 DLL4。NOTCH1的入核部分 ICN1与 CSL(CBF1,Su(H),Lag-1)和MAML1(Mastermind-like 1)结合后才能启动靶基因的转录。NOTCH1靶基因的激活转录根据CSL的有无,可分为CSL依赖性的和非CSL依赖性的。CSL通过几个转录共抑制因子,如 SMRT、NcoR、CIR、SHARP、KyoT2 和 Skip[2-6],来招募组蛋白去乙酰化酶及其它染色质修饰酶,抑制NOTCH1靶基因的表达。当激活的ICN1进入细胞核后,它取代了这些抑制因子及其它染色质修饰蛋白,而与CSL形成转录激活复合物,从而招募其它蛋白进一步形成稳定的转录复合物,如MAML1,这样NOTCH1靶基因才得以表达。
目前已知的NOCTH1靶基因有HES1,HERP1,Cyclin D1,NF-κB 等,但是找到更多的 NOTCH1靶基因,对于深刻、全面理解NOTCH1的功能是非常重要和有意义的。
笔者通过分析CSL所结合的NOTCH1靶基因启动子的特点,找到一些预选基因,通过RT-PCR及蛋白表达分析,发现SEPT4是NOTCH1的靶基因。
1 材料和方法
1.1 细胞培养,抗体及其它试剂
DMEM液体培养基购自Cellgro公司。胎牛血清、青霉素和链霉素购自HyClone公司。Trizol购自Invitrogen公司。
抗NOTCH1抗体和抗SEPT4抗体购自Santa Cruz Biotechnology公司。抗肌动蛋白(β-actin)抗体购自Sigma公司。总RNA纯化系统和PCR扩增试剂盒购自Promega公司。逆转录试剂盒购自Applied Biosystems。
1.2 ICN1,CSL,MAML1 共转染细胞系 U2OS 的构建
U2OS细胞系是一种人类骨肉瘤细胞系,它不表达可以检测到的内源性NOTCH1蛋白,因此,我们使用pFLAG-CMV-2、pcDNA3和逆转录病毒载体pMSCV-GFP将 MAML1、CSL、ICN1和 GFP导入U2OS细胞系,从而建立一株 CSL-MAML1-GFPU2OS细胞系 (命名为 GFP)和一株 CSL-MAML1-ICN1-GFP-U2OS细胞系(命名为ICN1)。
1.3 半定量和定量PCR
使用Trizol法从CSL-MAML1-GFP-U2OS细胞系和CSL-MAML1-ICN1-GFP-U2OS细胞系抽提总RNA,并用SV Total RNA Isolation System进行纯化,然后进行使用GeneAmp RNA PCR Kit进行逆转录反应。半定量PCR:根据cDNA的质量及靶基因的丰度将cDNA进行稀释。PCR循环步骤如下:96℃2 min,94 ℃1 min,56 ℃45 s,72 ℃30 s,重复 24 个循环。55 ℃2 min,94 ℃1 min,56 ℃45 s,72 ℃30 s,重复4个循环。55℃2 min,94℃1 min,56℃45 s,72℃30 s,重复4个循环。55℃2 min,94℃1 min,56℃45 s,72℃30 s,重复4个循环。72℃5 min。以GAPDH作为内参。定量PCR:将cDNA进行稀释,然后使用Applied Biosystems公司的7500 Fast Machine进行定量PCR反应。PCR循环如下:95℃,10 min,94 ℃,45 s,56 ℃,45 s,72 ℃,45 s,重复40个循环。PCR引物序列见表1。

表1 NOTCH1潜在靶基因PCR引物DNA序列

续表
1.4 蛋白质印迹法(Western blot)
将U2OS细胞在含有10%胎牛血清的DMEM培养基中培养,到达一定丰度后收集细胞,并用裂解缓冲液(20 mM Tris-Cl,150 mM NaCl,10% 甘油,1%NP-40,0.4% 氟化钠,100 mM 钒酸钠,10 μg/mL pepstatin,10 μg/mL leupeptin,10 μg/mL aprotinin,pH 7.4)来裂解细胞,在冰上放置 30 min,10 000转/min离心10 min,去沉淀,上清即总蛋白,测定蛋白浓度。将50 μg总蛋白进行SDS-PAGE电泳,并转移至PVDF(polyvinylidene difluoride)膜上,使用5%的脱脂牛奶4℃封闭过夜,或室温2 h,然后使用加Tween-20的缓冲液TBST冲洗5遍。在膜上加针对SEPT4的一抗,4℃反应过夜,或室温2 h,再使用TBST冲洗5遍后加入酶标记的二抗,室温1 h,使用TBST冲洗,然后使用Pierce ECL底物进行反应,显色发光,冲洗X光片。
2 结果与分析
2.1 NOTCH1靶基因的生物信息学分析
当NOTCH1激活它的靶基因时,位于细胞膜上的两个酶Disintegrin and metalloproteinase domaincontaining protein 10和 γ-secretase切割 NOTCH1,使其产生一个入核片段ICN1。ICN1进入细胞核之后与共激活因子CSL和MAML1结合形成复合物,该复合物结合在靶基因的启动子区,并且CSL结合在DNA的核心区,TGGGAA,从而激活基因的转录。我们把已知的NOTCH1靶基因的CSL结合区序列作为一个“位置权重模块(position weight matrix,PWM)”,再使用该模块在全基因组范围内搜寻潜在的结合区,全基因组涵盖了非冗余的人类、小鼠和大鼠的启动子序列。我们通过比较由Eukaryotic Promoter Database[7]提供的这三个物种的启动子同源区来评估该潜在结合区的保守区。通过PromoSer 3.0软件,我们鉴定了21个以前从未研究过的NOTCH1可能的靶基因。
2.2 SEPT4和 FRMD4A在转染 ICN1的 U2OS细胞中基因转录增加
半定量PCR的结果显示,在21个NOTCH1潜在靶基因中,有15个基因的基因转录在U2OS细胞中被NOTCH1(ICN1是其活化的入核片段)上调(图1),其中,SEPT4,CDC25A,FRMD4A 和 NUDCD1 基因转录上调较为明显。6个基因的转录被下调(图2),其中,FUT9基因转录下调明显。实时定量PCR的结果显示,在15个上调基因中,SEPT4基因转录上调最为明显,转录量是对照细胞SEPT4的10.48倍(图3),而FRMD4A和CD44基因的转录量约为对照细胞的1.5倍以上(图4)。在6个下调基因中,GRHL1基因转录下调较为明显,转录量只有对照细胞的0.7倍左右(图5)。

图1 受NOTCH1影响表达上调基因的半定量PCR产物凝胶电泳分析

图2 受NOTCH1影响表达下调基因的半定量PCR产物凝胶电泳分析
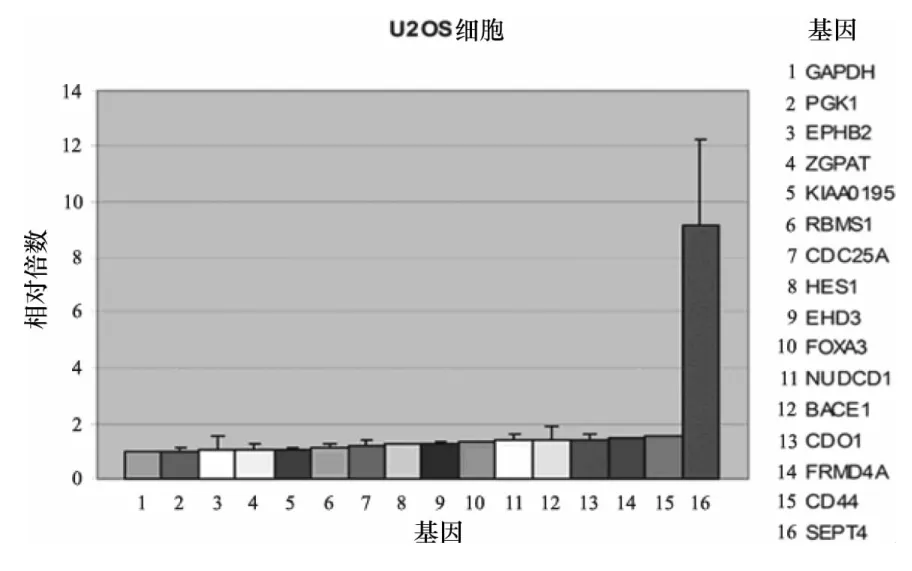
图3 受NOTCH1影响,SEPT4基因表达明显上调
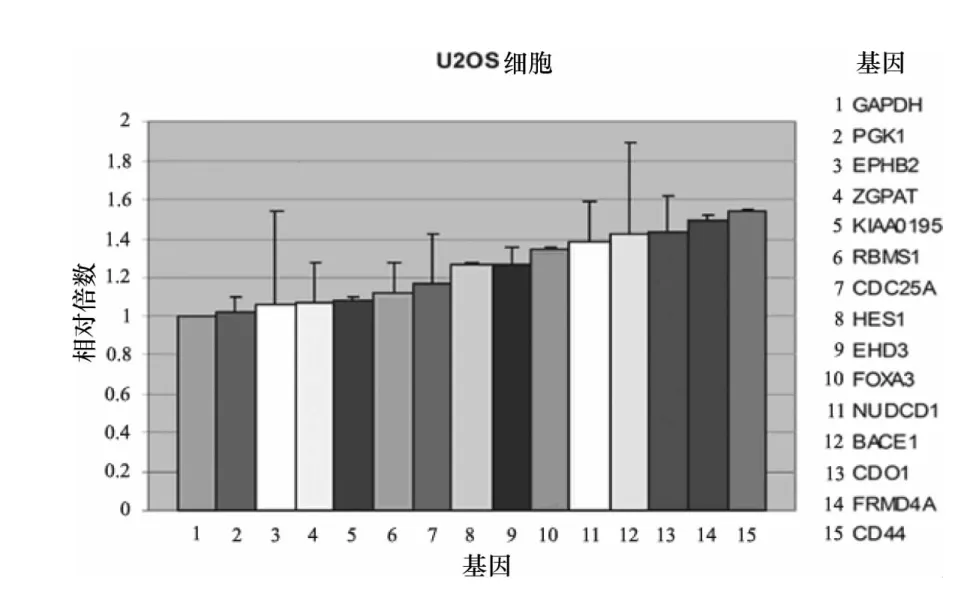
图4 受NOTCH1影响表达上调靶基因的定量PCR结果
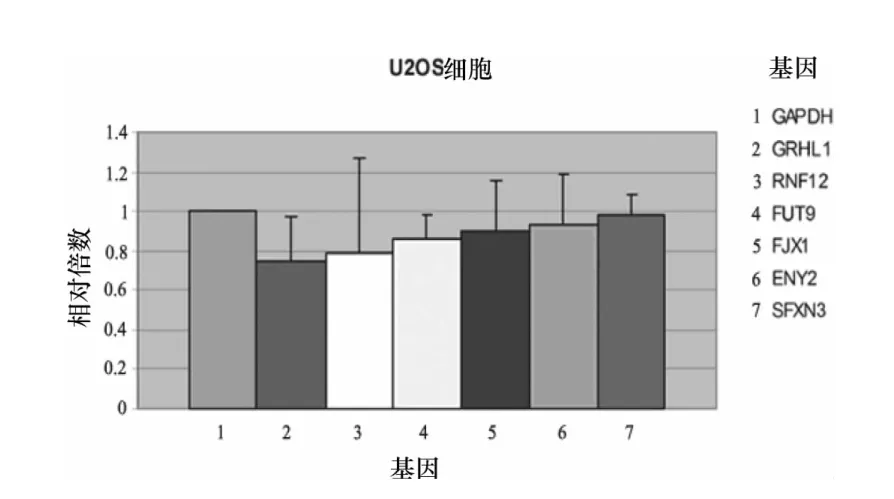
图5 受NOTCH1影响表达下调靶基因的定量PCR结果
2.3 SEPT4蛋白在转染ICN1的U2OS细胞中表达增加
在半定量PCR和实时定量PCR中,结果非常一致的有表达上调的SEPT4和FRMD4A基因。由于FRMD4A研究较少,没有合适的商业化抗体,笔者挑选SEPT4基因作为进一步蛋白表达的鉴定对象。笔者使用pFLAG-CMV-2、pcDNA3和逆转录病毒载体 pMSCV-GFP将 GFP、ICN1、CSL和 MAML1基因转入U2OS细胞中,进行蛋白的过表达。如图6所示,与对照细胞(GFP)相比,在表达ICN1的细胞中,SEPT4的蛋白表达被明显上调了。因此,SEPT4是NOTCH1的一个靶基因。

图6 NOTCH1靶基因SEPT4蛋白表达的Western blot分析
3 结论
笔者的生物信息学分析、半定量PCR分析和定量PCR分析均表明在转染了ICN1、CSL和MAML1基因的细胞中,SEPT4和FRMD4A基因的转录被ICN1明显上调了,而ICN1是NOTCH1被激活的入核片段。蛋白表达分析还表明SEPT4的表达被ICN1上调了,因此,SEPT4是NOTCH1的靶基因。
[1]Kopan R,Ilagan M X G.The canonical Notch signaling pathway: unfolding the activation mechanism [J].Cell,2009,137(2):216-233.
[2]Kao H Y,Ordentlich P,Koyano-Nakagawa N,et al.A histone deacetylase corepressor complex regulates the Notch signal transduction pathway[J].Genes Dev,1998,12:2269-2277.
[3]Hsieh J J,Zhou S,Chen L,et al.CIR,a corepressor linking the DNA binding factor CBF1 to the histone deacetylase complex[J].Proc Natl Acad Sci USA,1999,96:23-28.
[4]Oswald F,Kostezka U,Astrahantseff K,et al.SHARP is a novel component of the Notch/RBP-Jκ signaling pathway[J].EMBO J,2002,21:5417-5426.
[5]Taniguchi Y,Furukawa T,Tun T,et al.LIM protein KyoT2 negatively regulates transcription by association with the RBP-J DNA binding protein [J].Mol Cell Biol,1998,18:644-654.
[6]Zhou S,Fujimuro M,Hsieh J J,et al.Skip,a CBF1-associated protein,interacts with the ankyrin repeat domain of NotchIC to facilitate NotchIC function [J].Mol Cell Biol,2000,20:2400-2410.
[7]Eukaryotic Promoter Database[DB].http//www.epd.isb - sib.ch/.
