Mn0.8Cu0.2Fe2O4/埃洛石纳米管的制备及其对次甲基蓝的吸附研究
2014-10-17吕春芳孙洋洋杨茜怡
吕春芳,王 婕,孙洋洋,杨茜怡
(1.长安大学环境科学与工程学院,陕西西安 710054;2.西安工程大学环境与化学工程学院,陕西西安 710048)
近年来,随着工业的快速发展,染料废水造成的环境问题也日益突出,排入水体中的染料不仅给生物的生长带来很大的影响,破坏水体生态系统的平衡[1-2],还严重危害着人体的健康。目前,处理染料废水的方法主要有混凝、离子交换、氧化还原、膜分离法、吸附法等[3-6]。其中吸附法因成本低、效率高、简单易操作,对有毒物质不敏感等特点而受到广泛重视[7-9]。
埃洛石纳米管(HNTs)作为纳米尺寸的天然管状粘土矿物,具有与碳纳米管相似的中空孔道,与碳纳米管、二氧化硅和二氧化钛相比,HNTs价格低廉,容易获得,形貌特殊,生物相容性好[10],在水处理中展现出良好的应用前景[11-12]。因此,HNTs和磁性纳米粒子藕合得到的磁性复合材料将是一种新型理想的吸附材料。
磁性分离技术始于20世纪70年代后期,目前已经在分子医学、水处理以及光催化领域取得一些令人瞩目的研究成果,在人们所熟知的大量磁性材料中,可选作磁性微粒的仅有几种:主要为金属氧化物 Fe2O3、MFe2O4(M=Co,Mn,Ni)以及 Fe3O4等,本文用溶胶凝胶法将一种新型磁性材料 Mn0.8Cu0.2Fe2O4负载到HNTs的表面,并对其吸附行为进行研究。
1 实验部分
1.1 材料与仪器
硝酸铁(Fe(NO3)3·9H2O)、硝酸锰(50%溶液)、氯化铜(CuCl2·2H2O)、柠檬酸、次甲基蓝(100 mg/L)、浓硫酸(98%)、浓硝酸(70%)均为分析纯;埃洛石纳米管(HNTs),郑州金阳光陶瓷有限公司(河南)。
SK-2.5-BASP陶瓷管管式电阻炉;HJ-6A多头磁力加热搅拌器;DZF-6050真空干燥箱;101-OAB鼓风干燥箱;Phs-3C数字酸度计;FA2104电子分析天平;S-4800冷场发射扫描电镜;ADVANCE型X射线衍射;UV-3200PCS型紫外可见分光光度计。
1.2 埃落石纳米管的纯化
由于天然埃落石长期处于室外环境,必然导致其表面及内部含有一定的杂质及水分,影响其各方面的性能。因此,使用前必须预处理。其步骤主要有:干燥处理、高温酸化处理、超声处理。
准确称取10 g烘干的HNTs放置在250 mL的烧杯内,并且依次量取90 mL浓硝酸和30 mL浓硫酸加入在上述的烧杯中,利用磁力加热搅拌器连续密封搅拌6 h。接着在温度为40℃以及频率为100 Hz条件下连续超声处理3 h。随后利用蒸馏水采用离心洗涤的方法洗涤8~10次直至为中性,洗涤好的HNTs利用真空干燥箱在一定温度下将其烘干,密封保存。
1.3 磁性埃洛石纳米管的制备
准确称取4.04 g的硝酸铁,0.96 mL的硝酸锰及一定量的氯化铜置于250 mL的烧杯中,加入6 g的柠檬酸,30 mL的蒸馏水,将一定量的埃洛石加入混合溶液中,剧烈搅拌2 h,25℃下真空干燥直至形成凝胶,随后在100℃下干燥成碎玻璃状,然后利用管式炉在氮气保护下600℃煅烧2 h,最后,取出样品研磨,在外部磁场作用下先用去离子水洗涤,再用无水乙醇洗涤,以去除磁性不好的样品。洗涤后的样品在70℃下真空干燥后放入样品袋,即得到磁性埃洛石纳米管。
1.4 磁性埃洛石纳米管(MHNTs)对次甲基蓝的吸附行为测试
称取0.100 g MHNTs于具塞锥形瓶中,加入25 mL 50 mg/L次甲基蓝溶液,恒温振荡一定的时间,离心分离,测定上层清液的吸光度,结合下式计算其吸附量。

式中 Qe——吸附量,mg/g;
V——次甲基蓝溶液的体积,L;
C0——吸附前次甲基蓝溶液浓度,mg/L;
Ct——吸附时间为t时次甲基蓝溶液浓度,mg/L;
m——MHNTs的质量,g。
2 结果与讨论
2.1 纯化的HNTs扫描电镜图分析
为了更清楚的看到埃洛石纳米管的结构,对纯化后的埃洛石纳米管进行扫描电镜(SEM)观察,见图1。

图1 埃洛石纳米管HNTs纯化后的扫描电镜图(SEM)Fig.1 Scanning electron microscopy of HNTs
由图1可知,埃洛石纳米管有较大的长径比,且表面光洁,直径为20~40 nm。其直径范围在70~120 nm,内径及管壁厚均为30 nm左右,且每一根纳米管的两端都有不规则的口,进一步说明了HNTs是属于管状结构。与纯化前相比,纯化后的埃洛石纳米管不仅表面的活性增强,引入大量羟基以及羧基,其次可以去除原埃洛石含有的杂质,对后续负载磁离子有很大的作用。
2.2 HNTs/Mn0.8 Cu0.2 Fe2O4 磁性复合材料的 SEM图分析
磁性复合材料的SEM见图2。

图 2 HNTs/Mn0.8 Cu0.2 Fe2 O4 磁性复合材料的 SEM 图Fig.2 Scanning electron microscopy of HNTs/Mn0.8 Cu0.2 Fe2 O4 magnetic composite materials
由图 2 可以清楚地看到 Mn0.8Cu0.2Fe2O4磁粒子被成功的负载到埃洛石纳米管的表面,且负载较均匀。
2.3 MHNTs磁性复合材料吸附次甲基蓝的试验研究
2.3.1 溶液pH对吸附性能的影响 pH值是影响吸附效果的重要因素,因此实验首先对溶液pH值进行研究。用0.1 mol/L的HCl和NaOH将溶液的pH 调节到 2,3,5,7,9,11,测得其平衡吸附量见图3。

图3 pH对吸附量的影响Fig.3 Effects of pH value on adsorption capacity of methylene blue
由图3可知,溶液的初始pH会对磁性埃洛石纳米管的吸附性能产生微小影响。随着pH的增大,其吸附量也呈增大趋势。分析原因,pH值影响磁性材料表面负电荷的分布,pH越大,磁性材料表面负电荷越多,而次甲基蓝属于阳离子染料,可在水溶液中电接触大量阳离子,这样就增加了彼此之间的静电引力,从而提高了MHNTs的吸附性能。但考虑到其影响较小,且未经调节的溶液pH在7左右,所以以后实验中不需要再调节溶液pH。
2.3.2 吸附剂投加量的影响 称取不同质量的MHNTs加入25 mL 50 mg/L的溶液中,振荡一定时间至吸附平衡,结果见图4。
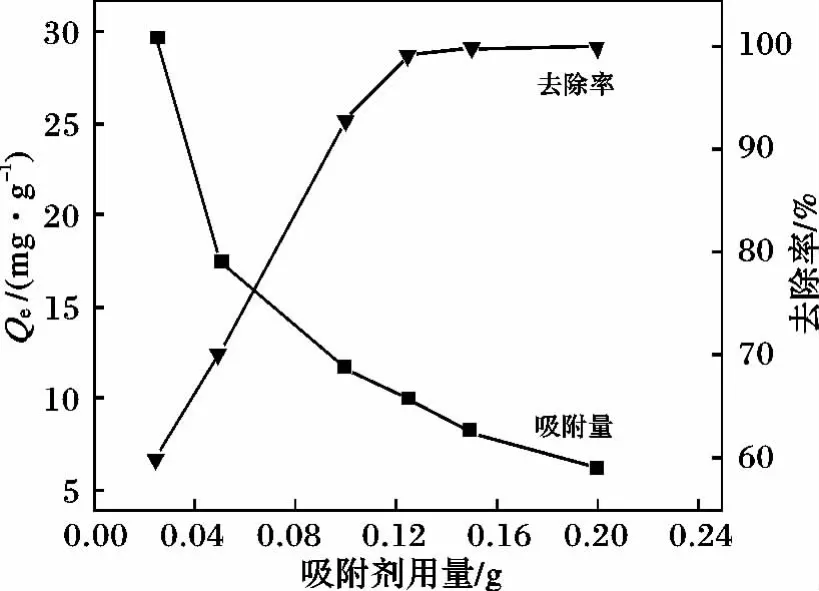
图4 吸附剂投加量对吸附量和去除率的影响Fig.4 Effects of dosing quantity on adsorption capacity of methylene blue
由图4可知,当投加量从0.025 g提高到0.15 g时,MHNTs对次甲基蓝的去除率从59.82%增加到100%,但吸附量却明显降低。分析原因,随着吸附剂投加量的增大,给吸附质提供更多的活性位点,从而提高吸附效率,但单位吸附剂的吸附量也会减少。从图中可以看出,当吸附剂的质量>0.1 g时,吸附效率变化不大,单位吸附量也不是很小,因此在以后的实验中,考虑到节约成本,将投加量定为0.1 g。
2.3.3 时间的影响 图5为吸附时间对吸附量的影响。

图5 时间对吸附量的影响Fig.5 Effects of time on adsorption capacity of methylene blue
由图5可知,前30 min进行了大部分的吸附行为,1 h左右不同初始浓度的溶液均已接近吸附平衡。这是因为开始一段时间,吸附剂能提供较多的吸附位点,随着吸附时间的加长,吸附位点越来越少,吸附效率也就越来越低,慢慢接近平衡。同时,可以看出不同初始浓度吸附量有很大区别,究其原因,初始浓度越大,所产生的浓度梯度和吸附动力也就越大,这就是图中所示的前30 min 100 mg/L的溶液吸附量远远大于其他浓度的原因。
2.3.4 初始浓度和温度的影响 实验考察了不同初始浓度的溶液在不同温度的吸附量,结果见图6。
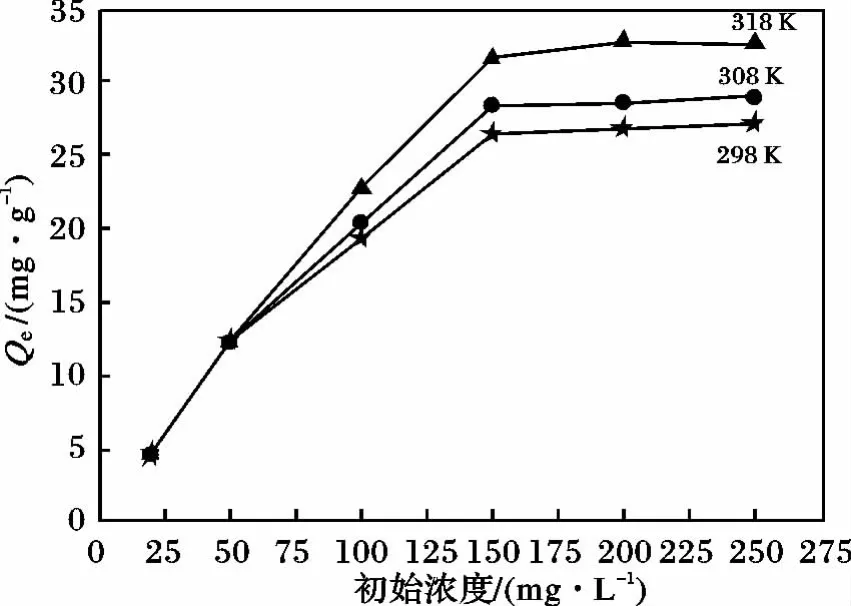
图6 初始浓度和温度对吸附量的影响Fig.6 Effects of initial concentration and temperature on adsorption capacity of methylene blue
由图6可知,吸附量随着浓度及温度的增加都在提高。这是因为浓度越大,由浓度梯度所产生的吸附动力也随之增大,这就会使更多的次甲基蓝被MHNTs所吸附,而温度的提高使得原本溶解的吸附质从溶液中扩散到吸附剂的表面,这样,就使吸附量随着温度的提高也越来越大。另外,也表明MHNTs对次甲基蓝的吸附过程是一个吸热的过程。
3 结论
(1)Mn0.8Cu0.2Fe2O4作为一种新型的磁性材料,可以被成功的负载到埃洛石纳米管的表面,合成一种新型磁性吸附材料,有一定的使用价值。
(2)研究了不同因素对磁性复合材料吸附次甲基蓝的影响,结果表明 Mn0.8Cu0.2Fe2O4/HNTs 复合材料对次甲基蓝有较好的吸附性能,对于不同初始浓度的溶液,选择合适的投加量,去除率均可达到100%。
(3)复合材料的吸附过程均在1 h左右可达到吸附平衡,且吸附容量随污染物初始浓度的增大而增加,随温度升高而升高,吸附过程为吸热反应,pH对吸附量影响较小,实验选用溶液的初始pH。
[1] Gupta V K,Suhas.Application of low-cost adsorbents for dye removal:A review[J].J Environ Manage,2009,90:2313-2342.
[2] Rai H S,Bhattacharyya M S,Singh J,et al.Removal of dyes from the effluent of textile and dyestuff manufacturing in dustry:A review of emerging techniques with reference to biological treatment[J].Crit Rev Environ Sei Technol,2005,35:219-238.
[3] Husain Q.Potential applications of the oxidoreductive enzymes in the decolorization and detoxification of textile and other synthetic dyes from polluted water:A review[J].Crit Rev Biotechnol,2006,26:201-221.
[4] Gupta V K,Jain R,Varshney S.Electrochemical removal of the hazardous dye react fix Red3 BFN from industrial effluents[J].JColloid Interf Sci,2007,312:292-296.
[5] Alnuaimi M M,Rauf M A,Ashraf S S.A comparative study of neutral red decoloration by Photo-Fenton and photocatalytic proeesses[J].Dyes and Pigments,2008,76:332-337.
[6] Zhang J,Shi Q Q,Zhang C L,et al.Adsorption of neutral red onto Mn-impregnated activated carbons prepared from typha orientalis[J].Bioresource Technol,2008,99:8974-8980.
[7] Qadaee I,Allen SJ,Walker G.Adsorption of basic dyes from aqueous solution onto activated carbons[J].Chemical Engineering Journal,2008,135:174-184.
[8] Wang L,Zhang J,Wang A.Removal of methylene blue from aqueous solution using chitosan-g-poly(acrylic acid)/montmorillonite superadsorbent nanocomposite[J].Colloids and Surfaces A:Physicochem Eng Aspects,2008,322:47-53.
[9] Zhao M,Tang Z,Liu P.Removal of methylene blue from aqueous solution with silica nanosheets derived from vermiculite[J].Journal of Hazardous Materials,2008,158:43-51.
[10] Vergaro V,Abdullayev E,Lvov Y M,et al.Cytocompatibility and uptake of Halloysite clay nanotubes[J].Biomacromolecules,2010,11:820-826.
[11] Luo P,Zhao Y F,Zhang B,et al.Study on the adsorption of neutral red from aqueous solution onto Halloysite nanotubes[J].Water Res,2010,44(5):1489-1497.
[12] Zhao Y F,Zhang B,Zhang X,et al.Removal of ammonium from wastewater by pure form low-silicazeolite Y synthesized from Halloysite mineral[J].Sep Sci Technol,2010,45(8):1066-1075.
