双氧水对亚硫酸铵的氧化特性
2014-10-13王梦秋龚惠娟樊杨梅余珉陈泽智刘静潘敏
王梦秋,龚惠娟,樊杨梅,余珉,陈泽智,刘静,潘敏
(1南京大学环境学院污染控制与资源化研究国家重点实验室,江苏 南京 210023;2南京大学现代分析中心,江苏 南京 210093;3上海克硫环保科技股份有限公司,上海 201203)
氨法脱硫由于具有脱硫效率高、运行费用低、比较适合我国目前经济技术条件[1]等优势,近年来逐渐得到人们的关注。在氨法烟气脱硫技术中,将亚硫酸铵氧化成硫酸铵的氧化工艺是该技术的重要环节,也成为该领域研究的一个热点问题。
对于氨法脱硫中的亚硫酸铵氧化或强化氧化的研究,以往的研究工作多集中在在氧化动力学、催化氧化等方面,例如国外从 20世纪中期开始,Gürkan等[2-4]就开展了亚硫酸铵氧化动力学的研究。近些年来,康宏伟[5]、周志明[6]等通过空气鼓泡氧化实验研究,认为较高浓度亚硫酸铵不能被迅速氧化为硫酸铵。为了促进对亚硫酸铵的氧化,研究人员尝试了多种方法,例如胡小吐等[7]采用流光放电法氧化亚硫酸盐,Long等[8]使用[Co(NH3)6]2+/I−作催化剂,李伟等[9]使用铜、轶、钴、锌、锰的硫酸盐作催化剂来提高氧化速率,危海涛[10]和Li[11]等研究了臭氧对亚硫酸铵的氧化效果。陈枝[12]开展了利用双氧水和二氧化锰来提高对亚硫酸铵的氧化效率,并提出了在二氧化锰存在条件下双氧水氧化是催化氧化过程的观点。
双氧水作为一种清洁的化工产品,有较强的氧化性能[13],在促进亚硫酸铵氧化过程方面具有潜在的应用可能性。为此,本文作者分别在空气氧化和臭氧氧化条件下,对投加双氧水的亚硫酸铵氧化过程及其特点进行了实验研究。
1 实验部分
1.1 实验装置及流程
实验装置如图1所示,由配气部分和鼓泡反应器组成。在配气部分中,根据氧化用气体(空气氧化/臭氧氧化)的选取,选择不同的实验组件,其中臭氧由臭氧发生器制得,氮气用于吹扫鼓泡反应器内空气。配气经水饱和器进入鼓泡反应器内的微孔曝气头,对配制的亚硫酸铵溶液进行氧化。鼓泡反应器采用水浴控温,并设置搅拌器和pH计,鼓泡反应器内亚硫酸铵溶液量为2 L。进行实验前,先通入氮气吹扫以排除空气干扰。在曝气氧化过程中,为了减小吸收液中水分散失带来的影响,根据不同曝气流量和温度下的水蒸气损失速率,定期补加蒸馏水。在实验中,取一定量的30%浓度双氧水投加到鼓泡反应器中,然后定时取样测量溶液中的亚硫酸根浓度。
1.2 亚硫酸根的测量方法
选择碘量法[14]标定反应前后亚硫酸根的浓度。用标准硫代硫酸钠溶液标定和亚硫酸根反应后剩余的碘液。以碘酸钾标准溶液为基准物,采用间接法标定硫代硫酸钠。实验中需要的盐酸、淀粉溶液等根据实验条件现制现用。
1.3 亚硫酸铵氧化率计算方法
亚硫酸铵氧化率的计算方法如式(1)所示。
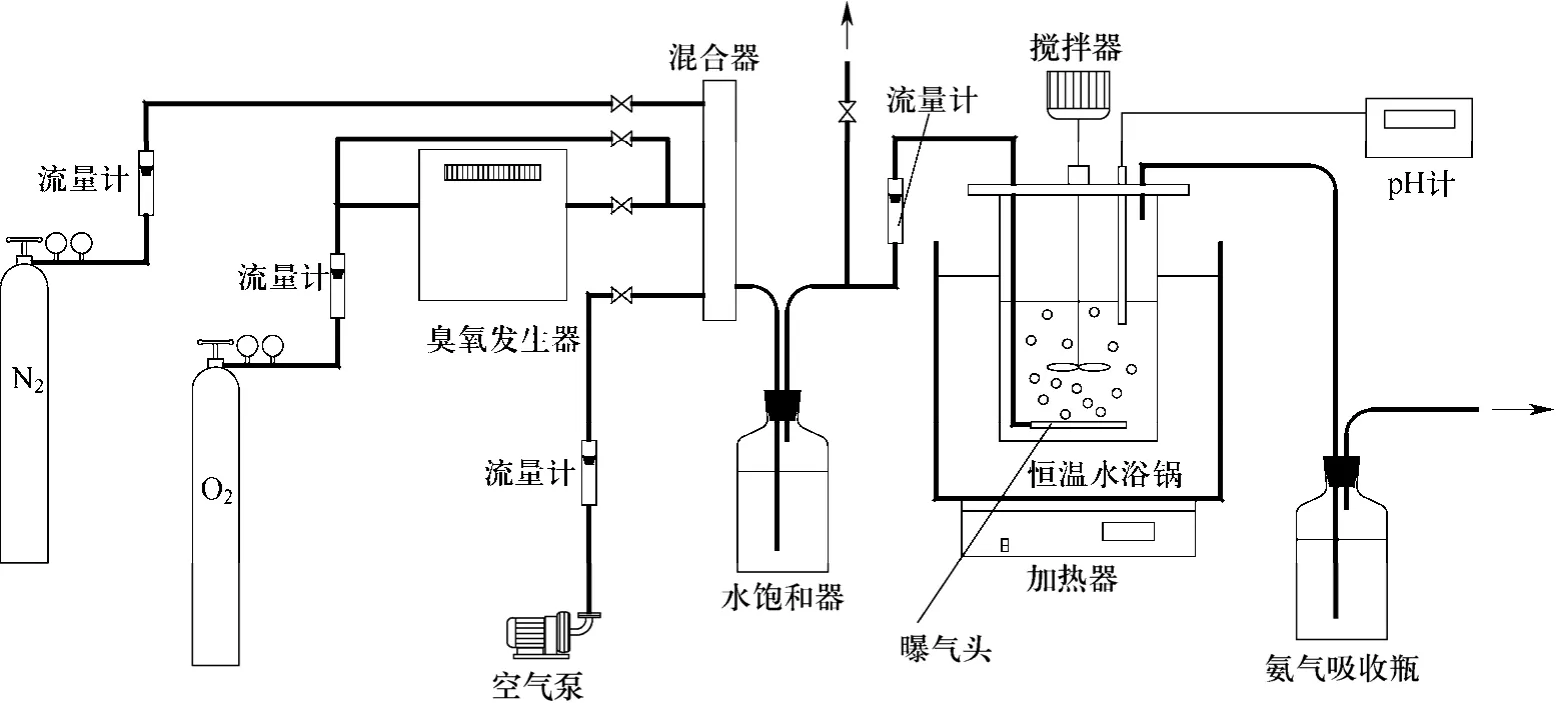
图1 实验装置流程图

式中,X为不同时间下的亚硫酸铵氧化率,%;C0为初始亚硫酸根浓度,mol/L;Ct为反应后即 t时刻亚硫酸根浓度,mol/L;t为氧化反应时间,min。
2 实验结果与讨论
首先在空气氧化条件下,开展了双氧水对中低浓度亚硫酸铵的氧化实验,在此基础上开展了在臭氧氧化条件下双氧水对亚硫酸铵的氧化实验,实验结果与分析如下。
2.1 在空气氧化条件下,双氧水对亚硫酸铵的氧化实验
实验中,控制反应温度为 50 ℃,空气曝气流量为150 L/h,亚硫酸铵初始浓度分别为0.1 mol/L和0.5 mol/L。对于0.1 mol/L亚硫酸铵溶液的氧化实验,分别开展了加入总量为10 mL和20 mL 30%的双氧水(分析纯)的实验,其中总加入量为10 mL的双氧水为反应开始时一次性加入,而总加入量为20 mL双氧水则是在反应开始和第10 min时分两次加入(每次10 mL);对于0.5 mol/L亚硫酸铵溶液的氧化实验,只是在反应开始时加入10 mL双氧水。对两个不同初始浓度亚硫酸铵的氧化率测量结果见图2。
从图 2可见,对于低浓度亚硫酸铵溶液(0.1 mol/L),与单纯的空气氧化相比,投加10 mL双氧水后,亚硫酸铵的氧化率在反应开始20 min内快速增加至 60%,之后氧化率增幅明显变缓,在反应20~40 min的时间段内,氧化率仅提高10%左右。这说明氧化率快速增加的前期主要是受双氧水作用,而在氧化率增幅变缓的后期双氧水已经被利用完;对于分两次共加入20 mL双氧水的实验,由于投加的双氧水过量,使得亚硫酸铵在20 min内快速地全部被氧化完。对于中浓度亚硫酸铵溶液(0.5 mol/L),与单纯的空气氧化相比,投加10 mL双氧水后,亚硫酸铵的氧化率在反应开始 20 min内由10%增长至20%,存在一个快速增加的抬升阶段,在该阶段中主要受双氧水的氧化作用。
通过上述实验现象可知,双氧水对亚硫酸铵具有极强的氧化能力,使得亚硫酸铵氧化率快速增加,但其自身在短时间内被消耗殆尽,之后亚硫酸铵则依靠空气曝气氧化。
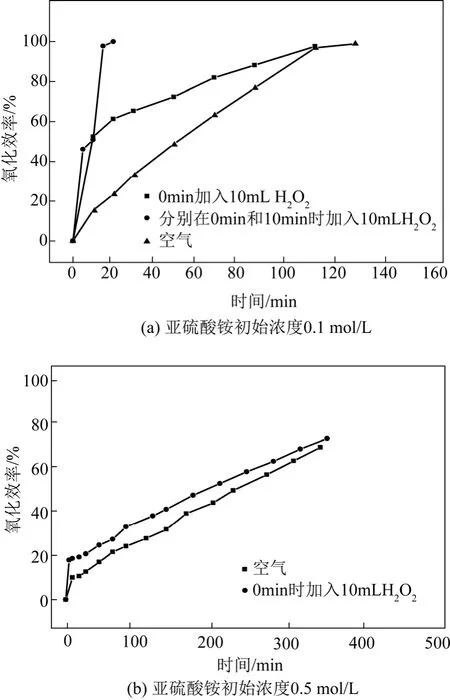
图2 双氧水对亚硫酸铵氧化效率的影响
此外,计算表明,对于0.1 mol/L和0.5 mol/L的亚硫酸铵溶液,所投加的双氧水仅有约30%(质量分数)部分真正参与了对亚硫酸铵的氧化作用,其余部分并未有效地参与反应。究其原因,可能是在碱性环境中双氧水自身分解的速度较快所致。例如刘中兴等[15]研究认为,溶液酸碱度对双氧水分解率影响较大:1 h内、60 ℃条件下,30%的双氧水在pH值为7和8时分别约有60%和80%的双氧水分解。在本文实验中,亚硫酸铵溶液初期的pH值在7.8左右,加之温度也较高,加速了双氧水自身的分解。尽管有研究表明,双氧水分解同时会产生氧气并在弱碱性条件下促进过氧氢根(HO2−)产生[16],但是本实验中鼓泡反应装置一直处于曝气运行,亚硫酸铵溶液中的溶解氧在实验条件下已经饱和,因此由双氧水分解释放的氧气进一步发挥氧化作用的效果并不明显,这也影响了双氧水的有效利用。
2.2 在臭氧氧化条件下,双氧水对亚硫酸铵的氧化实验
臭氧是一种高效的氧化剂,其本身就可提高亚硫酸铵的氧化效果,在臭氧氧化条件下投加双氧水,以期达到更好的氧化效果。
实验中,保持温度为 50 ℃,曝气流量为 150 L/h,亚硫酸铵初始浓度分别为0.5 mol/L、1.0 mol/L和1.5 mol/L。通过改变通入臭氧发生器的氧气量来调节臭氧产生量,进而调节曝气中的臭氧浓度,实验中设置臭氧浓度为0.0133 g/L。
针对上述3种不同浓度的亚硫酸铵溶液,分别开展了空气氧化、臭氧氧化、臭氧氧化+双氧水氧化(实验开始时一次性投加20 mL 30%的双氧水)条件下的亚硫酸铵氧化实验。实验结果如图3所示。
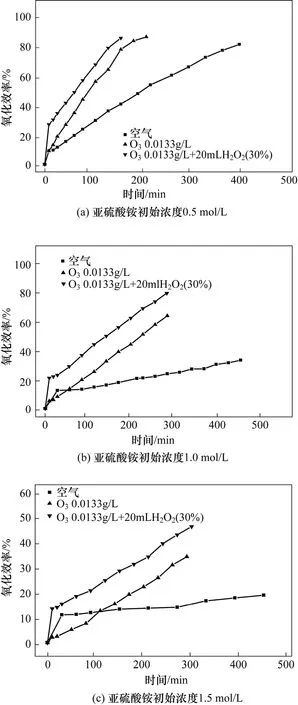
图3 臭氧氧化条件下双氧水对亚硫酸铵氧化效率的影响
由图3可知,在臭氧氧化条件下,亚硫酸铵初始浓度分别为0.5 mol/L、1.0 mol/L、1.5 mol/L时投加双氧水,与不投加双氧水时相比,亚硫酸铵的氧化率在反应开始20 min内分别快速地由14%、6%、2%增加至30%、20%、11%。之后的20~90 min时间段内,氧化率增幅减缓,在上述的亚硫酸铵初始浓度梯度下,投加双氧水与不投加双氧水相比,氧化率增长幅度分别为30%、15%、6.7%和33%、14%、6.8%。由此可见,加入双氧水后的氧化率增加速度与与未加入双氧水的曲线基本保持一致。
总结以上图 2、图 3中的实验结果,并与 2.1节中内容进行对比分析,可以得出如下结论。
首先,无论是在臭氧氧化条件还是空气氧化条件下,投加双氧水的氧化过程均呈现相同的规律,即在双氧水加入后很短时间内使亚硫酸铵氧化率快速增加,例如在臭氧氧化条件下,对于初始浓度为0.5 mol/L的亚硫酸铵溶液,使氧化率达到60%时的反应时间缩短30 min,而在空气氧化条件下,对于初始浓度为0.1 mol/L的亚硫酸铵溶液,使氧化率达到60%时的反应时间缩短50 min,与此同时双氧水自身也被快速消耗掉,之后亚硫酸铵的氧化速率则由空气氧化或臭氧氧化来决定。
其次,与在空气氧化条件下投加双氧水的氧化过程相似,在臭氧氧化条件下投加的双氧水也只有部分参与了亚硫酸铵氧化过程。经计算分析,当亚硫酸铵初始浓度分别为0.5 mol/L、1.0 mol/L和1.5 mol/L时,加入的双氧水中分别约有 45%、60%和70%参与了氧化亚硫酸铵,双氧水利用率的提高是由于亚硫酸铵浓度增大而导致的。
此外,相对于空气氧化气氛,在臭氧氧化气氛下投加双氧水的利用率要明显增大。例如本文中对于0.5 mol/L亚硫酸铵溶液,在臭氧氧化气氛下参与氧化亚硫酸铵的双氧水中约占45%,而在空气氧化气氛下则仅有30%参与氧化过程。这说明,臭氧与双氧水联用促进了双氧水的氧化能力,两者之间具有一定的协同作用。与之相近的协同作用已有相关研究报道,例如江举辉等[17]认为双氧水会提高臭氧分解并形成·OH的能力,而针对氧化亚硫酸铵的场合,其机理还没有专门的分析讨论,有待进一步研究予以明确。
3 结 论
本文分别在空气氧化和臭氧氧化条件下,对投加双氧水氧化亚硫酸铵的工作特性进行了实验研究,得到如下结论。
(1)无论是在空气曝气还是臭氧曝气条件下,双氧水的加入能明显加快亚硫酸铵的氧化速率,但双氧水自身也在短时间内被消耗殆尽,双氧水的氧化作用持续时间不长。
(2)投加的双氧水只有部分参与对亚硫酸铵的氧化过程,其利用率在空气氧化条件下较低,在臭氧氧化条件下得到明显提高,臭氧与双氧水联用具有一定的协同作用。
[1]刘晓飞,肖文德. 高浓度硫酸铵溶液中亚硫酸铵的氧化[J]. 广东化工,2008,35(4):16-18,52.
[2]Neelakantan K,Gehlawat J K. Kinetics of absorption of oxygen in aqueous solutions of ammonium sulfite[J]. Industrial & Engineering Chemistry Fundamentals,1980,19(1):36-39.
[3]Gürkan T,Nufal A,Eroğu I. Kinetics of the heterogeneous oxidation of ammonium sulfite[J]. Chemical Engineering Science,1992,47(13):3801-3808.
[4]Bengtsson S,Bjerle J. The absorption of oxygen into sodium sulfite solutions in a packed column[J]. Chem. Eng. Sci.,1975,30:1429-1435.
[5]康宏伟,周永兵,李俊平. 亚硫酸铵氧化的研究[J]. 广州化工,2009,37(4):132-133,138.
[6]周志明,陈枝. 亚硫酸铵的氧化反应动力学研究[J]. 广东化工,2007,34(11):5-8.
[7]胡小吐,姜学东. 流光放电等离子体氨法烟气脱硫工艺[J]. 化工学报,2007,58(4):158.
[8]Long X L,Li W,Xiao W D,et al. Novel homogeneous catalyst system for theoxidation of concentrated ammonium sulfite[J].Journal of Hazardous Materials,2005,129(1-3):260-265.
[9]李伟,周静红,肖文德. 高浓度亚硫酸铵氧化反应过程研究[J]. 华东理工大学学报,2001,27(3): 226-229.
[10]危海涛,吴春笃. 臭氧对亚硫酸铵的氧化效果研究[J]. 安徽农业科学,2011,39(25):15588-15589,15611.
[11]Li Yue,Shang Kefeng,Lu Na,et al. Oxidation of ammonium sulfite in aqueous solutions using ozone technology[C]//7th International Conference on Applied Electrostatics (ICAES),2012.
[12]陈枝. 烟气脱硫产物亚硫酸铵氧化动力学研究[D]. 重庆:重庆大学,2007.
[13]陈建波,曹杨. 双氧水市场分析及预测[J]. 川化,2007(2):25-33.
[14]国家环境保护总局科技标准司. HJ/T 56—2000固定污染源排气中二氧化硫的测定—碘量法[S]. 北京:中国环境科学出版社,2001-03-01.
[15]刘中兴,谢传欣,石宁,等. 过氧化氢溶液分解特性研究[J]. 齐鲁石油化工,2009,37(2):99-102.
[16]莫淑欢. 过氧化氢分解动力学研究[D]. 南宁:广西大学,2008.
[17]江举辉,虞继舜,李武,等. 臭氧协同产生·OH的高级氧化过程研究进展及影响因素的探讨[J]. 工业安全与环保,2001,27(12):16-20.
