芹菜黄酮合成酶Ⅰ基因的克隆与序列分析
2014-10-11陈逸云徐志胜谭国飞李梦瑶熊爱生
陈逸云, 王 枫, 徐志胜, 谭国飞, 李梦瑶, 熊爱生
(南京农业大学作物遗传与种质创新国家重点实验室,农业部华东地区园艺作物生物学与种质创制重点实验室,园艺学院,江苏南京210095)
芹菜(Apium graveolens)为伞形科(Umbelliferae)芹属中一、二年生草本植物,原产于地中海沿岸的沼泽地带,世界各国已普遍栽培。芹菜富含蛋白质、碳水化合物、胡萝卜素、B族维生素等,具有食用、药用价值,是中国重要的蔬菜之一。
黄酮类化合物是一种小分子酚类物质,广泛存在于植物界,具有多种生物功能,是一类生物活性很强的化合物,在植物抗病虫中起重要的作用[1-4]。黄酮类化合物还是一种天然的抗氧化剂,在抗癌、防癌等方面也有显著效果[5]。植物中主要存在2种黄酮合成酶,即黄酮合成酶I(FSⅠ)和黄酮合成酶Ⅱ(FSⅡ)。FSⅠ是可溶性的,它是2-氧代戊二酸依赖的酶[6];FSⅡ属于细胞色素P450单氧化酶,催化反应依赖于 NADPH[7-8]。目前为 止,已 在 茶 树[9]、大 豆[10]、马 铃 薯[11]、苜蓿[12]、高粱[13]、水稻[14]等植物中分离出多种黄酮类化合物合成酶的相关基因。
本试验分别从3个芹菜材料六合黄心芹、津南实芹和美国西芹中克隆芹菜黄酮合成酶 I基因Ag-FS I,对其序列进行分析,为深入研究芹菜黄酮合成酶的功能提供依据。
1 材料与方法
1.1 试验材料、菌株、质粒
本试验选用的芹菜材料六合黄心芹、津南实芹和美国西芹均保存在本实验室,种植于南京农业大学江浦基地和南京农业大学作物遗传与种质创新国家重点实验室人工气候室。取用部位为芹菜的嫩叶部。
大肠杆菌菌株DH5α由本实验室保存;质粒载体 pMD18-T vector、分子量 Marker、Ex-Taq聚合酶和各类限制性内切酶均为大连TaKaRa公司产品。
1.2 试验方法
1.2.1 芹菜DNA的提取 芹菜DNA的提取采用CTAB 法[15]。
1.2.2 芹菜AgFS I基因的克隆 根据GenBank中旱芹的FS I基因(登录号:AY817676)设计1对引物(NXR45:5'-ATGGCTCCATCAACTATAACTG-3';NXR46:3'-TCATATCTTCATCTTGGCCTTCTC-5')。分别以六合黄心芹、津南实芹和美国西芹的DNA为模板进行PCR扩增,反应条件为:94℃ 5 min;94℃30 s,54 ℃ 30 s,72 ℃ 60 s,共30个循环;72 ℃ 10 min。PCR产物用1.2%的琼脂糖进行凝胶电泳,用AxyPrep DNA凝胶回收试剂盒回收。PCR扩增产物连接到pMD18-T载体上,转化大肠杆菌菌株DH5α
提取质粒,经PCR鉴定后委托南京金斯瑞生物科技有限公司进行测序。
1.2.3 芹菜AgFS I基因序列分析 芹菜AgFS I基因序列全长拼接及氨基酸翻译采用bioXM 2.6软件[16];氨基酸比对及多重比较、氨基酸疏水/亲水性鉴定等采用DNAMAN软件。用NJ法构建分子系统进化树,用MEGA 5生成报告图形[17]。利用NCBI网站BLAST程序进行同源性计算,用网站(http://www.expasy.org)相关软件进行氨基酸成分、蛋白质分子量、等电点等分析[18]。蛋白质空间结构模型通过Swiss-Model(http://swiss-model.expasy.org)建立[19]。
2 结果与分析
2.1 芹菜AgFS I基因的克隆
分别以六合黄心芹、津南实芹和美国西芹的DNA为模板进行PCR扩增,得到1 600 bp左右的片段(图1)。序列测定与分析结果表明,3个芹菜来源的AgFS I基因全长为1 616 bp,其中365~723位置和1 152~1 341位置是内含子区域。AgFS I含有1 068 bp的开放阅读框(Open reading frame,ORF),编码355个氨基酸(图2)。三者核苷酸水平上有5个碱基的差异,分别为28位(T/C/T,六合黄心芹/津南实芹/美国西芹,下同)、285 位(T/T/C)、431 位(A/A/G)、511位(A/A/G)、631 位(A/T/T)和1 001位(T/T/C)(图3);编码的氨基酸有5个位点的差异,分别为10位(S/P/S)、144位(Y/Y/C)、171位(K/K/E)、211位(M/L/L)和位(V/V/A)(图4)。

图1 芹菜AgFS I基因DNA片段电泳检测Fig.1 Agarose gel electrophoresis of DNA fragment of AgFS I gene from A.graveolens

图2 六合黄心芹AgFS I基因序列及其推导的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of AgFS I gene from celery Liuhehuangxinqin
2.2 芹菜AgFS I氨基酸多重序列比对与分析
对芹菜AgFS I基因推导的氨基酸序列进行BLASTp同源性检索,结果显示:芹菜AgFS I具有20G-FeII_Oxy保守结构域,属于20G-FeII_Oxy超级家族(图5)。芹菜 AgFS I与胡萝卜(Daucus carotaAAX21536.1)、孜 然 芹 (CuminumcyminumABG78790.1)、苹果(Malus domesticaAAX89398.1)、沙梨(Pyrus pyrifoliaADP09378.1)、桃(Prunus persicaAEJ88219.1)、茶(Camellia sinensisAAT68774.1)、金花茶(Camellia nitidissimaADZ28514.1)、牡丹(Paeonia suffruticosaAEN71544.1)、芍药(Paeonia lactifloraAFI71897.1)物种中的FS I具有较高的相似性,相似度达84.45%(图6)。
2.3 芹菜AgFS I蛋白质氨基酸组成成分、理化性质分析及亲水、疏水性质比较

图3 3种芹菜AgFS I基因序列比对Fig.3 Alignment of gene sequences of AgFS I gene from three cultivars of A.graveolens
选取上述植物,同时增加拟南芥(Arabidopsis thalianaBAD89980.1)、油 菜 (BrassicanapusABF60660.1)、大豆(Glycine sojaACA81445.1)、苜蓿(Medicago truncatulaXP_003629323.1),共16种不同来源植物,对其FS I蛋白质进行氨基酸组成成分及理化性质分析(表1)。这些植物中的FS I蛋白质残基数均在355至368之间,分子量在4.0×104左右,理论等电点在5至6之间,碱性氨基酸与酸性氨基酸的数量基本持平。脂肪族氨基酸比例较高,芳香族只占7%~8%,蛋白质可溶性预测中不溶蛋白质的比例较高,在49%至65%之间。
另外,对芹菜AgFS I氨基酸序列进行亲水性和疏水性分析,结果表明,该合成酶的亲水性在氨基酸第23位最强,第42位碱基疏水性最强。整体而言,AgFS I属于疏水性蛋白(图7)。
2.4 芹菜AgFS I氨基酸序列的进化树分析
根据检索结果,选取上述植物进行同源性进化比对,构建同源进化树(图8)。结果表明,六合黄心芹、津南实芹、美国西芹与同属于伞形科的胡萝卜、孜然芹进化关系最近。蔷薇科的苹果、沙梨、桃和山茶科的茶、金茶花在进化关系上也较近,接着是芍药科的牡丹、芍药,较远的是十字花科的拟南芥、油菜和及豆科的大豆、苜蓿。进化关系分析结果显示,伞形科与蔷薇科和山茶科的FSI进化较近。

图4 3种芹菜AgFS I氨基酸比对Fig.4 Alignment of amino acid sequences of AgFS I from three cultivars of Apium graveolens

图5 六合黄心芹AgFS I保守域预测Fig.5 Prediction of the conserved domain of AgFS I from celery Liuhehuangxinqin

图6 芹菜AgFS I氨基酸序列的多重比对Fig.6 Alignment of amino acid sequences of AgFS I from celery and other different plants
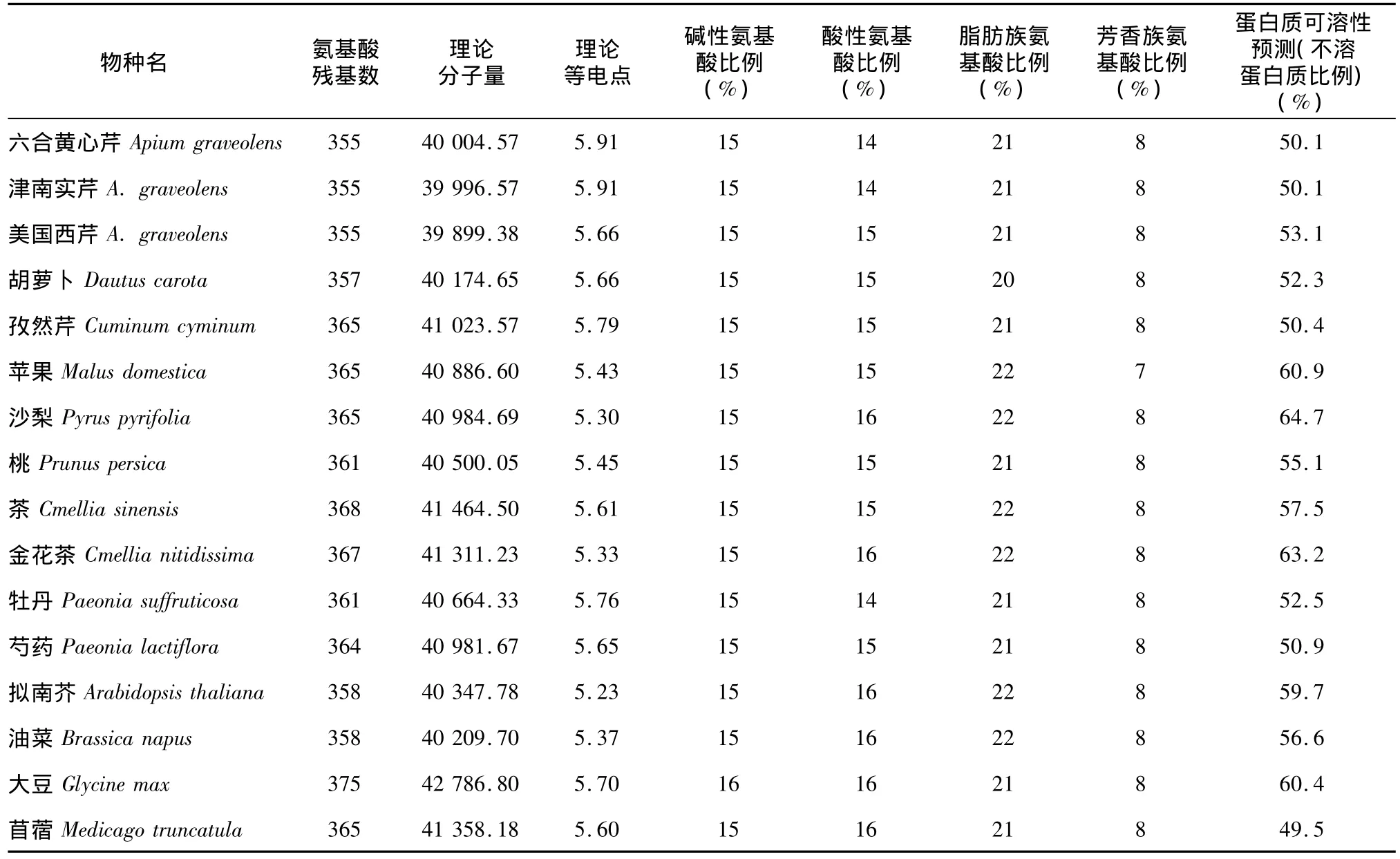
表1 不同植物来源的FS I氨基酸组成成分及理化性质分析Table 1 Com position and physico-chemical characterization of amino acid sequences of FS I derived from various
2.5 芹菜AgFS I三级结构预测与分析
六合黄心芹、津南实芹和美国西芹中的AgFS I与拟南芥花色素合成酶的氨基酸一致性大于60%。以拟南芥花色素合成酶空间结构(PDB ID:1gp5)为模型,通过Swiss-Model对六合黄心芹、津南实芹和美国西芹AgFS I三维结构建立模型(图9)。结果显示:六合黄心芹、津南实芹和美国西芹与拟南芥花色素合成酶PDB ID:1gp5的氨基酸同源性分别为33.3%、31.4%和33.3%,三维结构相似,主要有3个氨基酸位点不同,分别是第144位(Y/Y/C,六合黄心芹/津南实芹/美国西芹,下同)、第171位(K/K/E)、第211位(M/L/L),上述氨基酸位点的差异没有导致芹菜AgFS I空间结构的明显变化。
3 讨论
芹菜是是伞形科重要的蔬菜作物之一,富含蛋白质、碳水化合物、胡萝卜素、B族维生素、钙、磷、铁等,老少兼宜。本试验选用的3个芹菜品种中,六合黄心芹[20]和津南实芹[21]是中国地方品种,美国西芹[22]来源于美国,三者具有较大地域差别和一定的形态差异。六合黄心芹是南京市六合区的地方优良品种,株型半直立,株高较矮,叶大、绿色、有光泽,心叶黄绿色,纤维少、清香味浓,品质佳;津南实芹是天津市津南区选育的优良地方品种,一般植株高大,紧凑直立,基本无分枝,叶片肥大,组织充实,风味适口,纤维少,商品性好;美国西芹是从美国引进经多代提纯选育而成,植株较为高大,株型紧凑,叶片宽厚脆绿、有光泽,组织充实,质地脆嫩、纤维少,品质佳。

图7 芹菜AgFS I氨基酸序列亲水、疏水性质预测Fig.7 Predicted hydrophilic and hydrophobic properties of AgFS I from Apium graveolens
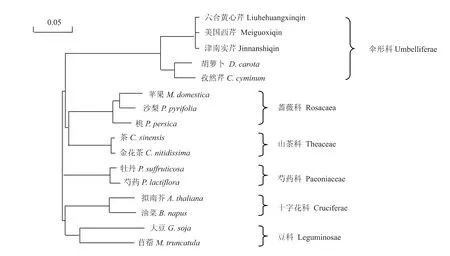
图8 不同物种的FS I氨基酸序列的系统进化树Fig.8 Phylogenetic tree of amino acid sequences of FS I from several plant species

图9 芹菜AgFS I的三维结构建模Fig.9 The structural model of the AgFS I from A.graveolens
本试验从上述3种芹菜中克隆出的黄酮合成酶I,是植物中合成黄酮类物质的关键酶之一[23]。黄酮类物质在植物中广泛存在,从苔藓植物到被子植物都含有这类物质,是一类低分子量的多酚类次生代谢产物[24-25]。植物中,黄酮类物质与许多功能有关,是果实和种子颜色的主要显色物质,能够保护植物抵御紫外线和防止病源微生物侵袭,调节植物生长素的运输,是植物和细菌相互作用中的信号分子,能促进花粉萌发并且和花粉的育性直接相关[26]。黄酮类化合物是一类生物活性很强的化合物,是一种天然的抗氧化剂[5]。但前人的研究大多集中在黄酮合成酶II上,黄酮合成酶I研究相对较少。序列分析比对结果表明,3种芹菜中AgFS I基因之间核苷酸水平上有5个碱基的差异,编码的氨基酸有5个位点的差异,这些不同地域来源和类型的芹菜中位点差异可能与芹菜某些特定的生理功能和不同地域进化有关。与其他来源植物FSI氨基酸序列的相似性高,表明FS I具有高度保守性。同源进化树分析结果显示,AgFS I与同属于伞形科的胡萝卜、孜然芹在进化关系上属于同一大的分枝,与蔷薇科、山茶科FS I的进化关系也较近,而与十字花科、豆科FS I在进化上比较远,但从进化树上的长度来看,各科之间的进化是相对保守的。三级结构预测与分析发现,不同芹菜AgFS I虽然部分氨基酸位点不同,但是其空间结构具有一定的相似性,这种空间结构的相似性可能对于其功能非常重要。
[1] TREUTTER D.Significance of flavonoids in plant resistance and enhancement of their biosynthesis[J].Plant Biology,2005,7(6):581-591.
[2] LATTANZIO V,ARPAIA S,CARDINALIA,et al.Role of endogenous flavonoids in resistance mechanism of Vigna to aphids[J].Journal of Agriculture and Food Chemistry,2000,48(11):5316-5320.
[3] 何 斌.异株荨麻黄酮类化合物提取工艺优化[J].江苏农业科学,2012,40(8):267-269.
[4] 陆 敏,冯俊霞,于宏伟.紫菀黄酮类化合物的超声波辅助提取与高效液相色谱法含量测定[J].江苏农业科学,2012,40(7):224-225.
[5] ATCHLEYW R,WOLLENBERG K R,FITCHW M,et al.Correlations among amino acid sites in bHLH protein domains:an information theoretic analysis[J].Molecular Biology and Evolution,2000,17(1):164-178.
[6] LEONARD E,CHEMLER J,LIM KH,et al.Expression of a soluble flavone synthase allows the biosynthesis of phytoestrogen derivatives inEscherichia coli[J].Applied Microbiology and Biotechnology,2006,70(1):85-91.
[7] KOCHSG,GRISEBACH H.Induction and characterization of a NADPH-dependent flavone synthase from cell cultures of soybean[J].Zeitschriftfür Naturforschung,1987,42(c):343-348.
[8] STICH K,EBERMANN R,FORKMANN G.Einfluβ cytochrom P-450-spesifischer inhibitor auf die aktivitat von flavonoid 3’hydroxylase und flavone synthase II bei verschiedenen Pflanzen[J].Phyton(Austria),1988,28:237-247.
[9] 乔小燕.茶树黄酮合成酶II基因全长cDNA序列的克隆和实时荧光定量 PCR检测[J].茶叶科学,2009,29(5):347-354.
[10] FLIEGMANN J,FURTWÄNGLERA K,MALTERER G,et al.Flavone synthase II(CYP93B16)from soybean(GlycinemaxL.)[J].Phytochemistry,2010,71(5-6):508-514.
[11] 范 敏.干旱胁迫对马铃薯类黄酮和类胡萝卜素合成关键酶基因表达的影响[J].园艺学报,2008,35(4):535-542.
[12] MARTENSS,FORKMANNG.Genetic control of flavone synthase IIactivity in flowers of Gerbera Hybrids[J].Phytochemistry,1998,49(7):1953-1958.
[13] DU Y G,CHU H,WANG M F,et al.Identification of flavone phytoalexins and a pathogen-inducible flavone synthase II gene(SbFNSII)in sorghum[J].Journal of Experimental Botany,2010,61(4):983-994.
[14] LEE Y J,KIM JH,KIM B G,et al.Characterization of flavone synthase I from rice[J].BMB Reports,2008,41(1):68-71.
[15] STEWART N C,LAURA E.A rapid CTAB DNA isolation technique useful for RAPD fingerprinting and other PCR applications[J].Bio Techniques,1993,14(5):748-749.
[16] 黄 骥,张红生.基于Windows的核酸序列分析软件的开发[J].生物信息学,2004(1):13-17.
[17] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28:2731-2739.
[18] WILKINSM R,GASTEIGER E,BAIROCH A,et al.Protein identification and analysis tools in the ExPASy server[J].Methods in Molecular Biology,1999,112:531-552.
[19] SCHWEDE T,KOPP J,GUEX N,et al.Swiss-model:an automated protein homology-modeling server[J].Nucleic Acids Research,2003,31:3381-3385.
[20] 周晓燕,王铁芳,朱训永,等.黄心芹秋冬保护地栽培技术[J].中国园艺文摘,2010(26):4.
[21] 李海燕.芹菜品种—津南实芹[J].天津农林科技,2004(4):21.
[22] 李海燕.芹菜品种—美国西芹[J].天津农林科技,2004(4):29.
[23] LEONARD E,YAN Y,LIM K H,et al.Investigation of two distinct flavone synthases for plant-specific flavone biosynthesis inSaccharomyces cerevisiae[J].Applied Environmental Microbiology,2005,71(12):8241-8248.
[24] HARBORNE J B,BAXTER H.The handbook of natural flavonoids[J].CAB Direct,1999,16:879.
[25] WILLIAMS C A,GRAYER R J.Anthocyanins and other flavonoids[J].Natural Products Reports,2004,21:539-573.
[26] MARTENS S,MITHÖFER A.Flavones and fiavone synthases[J].Phytochemistry,2005,66(20):2399-2407.
