葡萄抗病相关基因VvIPK2的克隆、序列分析及表达
2014-10-11王西成吴伟民赵密珍钱亚明王壮伟
王西成, 吴伟民, 赵密珍, 钱亚明, 王壮伟
(江苏省农业科学院园艺研究所,江苏 南京 210014)
葡萄作为世界第二大水果被广泛种植和加工利用,为人类社会的发展创造了重要的经济、生态和社会效益[1-5],特别是美国科学杂志报道并证明葡萄果实及其加工产品中特异功能成分白藜芦醇(Res)含量居各类水果之首[6-7],进一步加速了世界葡萄产业的发展。葡萄霜霉病(Grapevine downy mildew)是由葡萄霜霉病菌[Plasmopara viticola(Berk.Et Curtis)Ber.et de Toni]引起的真菌性病害,易于多雨季节发生[8],严重影响葡萄植株的生长及果实产量和品质的提高,给葡萄产业造成较大经济损失[9]。到目前为止,葡萄霜霉病的防治仍以传统的化学药剂防治为主[10-11],这不仅给食品安全带来隐患,还大幅提高了生产成本,破坏了环境。随着病原菌对杀菌剂抗性的产生,致使杀菌剂的效能大幅下降[12],这使人们不得不将目标集中于更为安全的生物防治技术上来[13]。因此,深入研究葡萄抗霜霉病的作用机制具有重要的理论和现实意义。
近年来,有关葡萄霜霉病抗性方面的研究已取得了一定的进展。在生理生化方面研究发现,葡萄对于霜霉病菌抗性的强弱与其自身的组织结构和生理生化特性有着紧密的联系,如:Allègre等[14]研究结果表明,葡萄植株对于霜霉病菌抗性的强弱与其自身叶片气孔的数量、气孔孔径、叶片下表皮绒毛及蜡质层之间均存在密切联系;当接种葡萄霜霉病菌后葡萄叶片中过氧化物酶、多酚氧化酶、超氧化物歧化酶、过氧化氢酶和苯丙氨酸解氨酶的活性均明显高于接种前[15-16]。此外,接种霜霉病菌后同样能够诱导葡萄叶片几丁质酶和β-1,3-葡聚糖酶活性的提高,且这两种酶活性的提高水平在不同的品种间存在一定的差异[15,17]。在分子方面研究发现,葡萄抗霜霉病性状遗传是主效基因控制的数量性状遗传,抗病主效基因主要存在于我国的野葡萄资源,而抗病微效基因则存在于欧洲葡萄,两者可通过协同作用增强植株的抗病性[18-19]。
Ca2+是植物体内一种重要的信号转导物质,植物可通过调节其浓度变化,积极参与植物体内的各种生理生化反应过程[20]。如:Ca2+作为应答病原菌侵染的重要信号转导物质,可通过一系列信号转导过程诱导防御相关基因的表达,进而提高植株自身的抗病性[21]。而由多磷酸肌醇激酶基因/三磷酸肌醇3激酶基因(IPK2/IP3K)所编码的多磷酸肌醇激酶(IP3-kinase)可通过调节三磷酸肌醇(IP3)的水平促使液泡释放Ca2+,引起胞质内Ca2+浓度的瞬间升高,进而起到信息传递的作用,参与植株体内多种生理生化过程的调控[22]。据此分析,IPK2/IP3K基因在提高植株抗病性过程中发挥着积极作用。目前,已从拟南芥[23]、盐芥[24]等多种植物中克隆了多磷酸肌醇激酶基因,并且证明了该基因与植物应答非生物胁迫过程密切相关。在葡萄上,尽管已有关于VvIPK2基因部分序列信息的报道[25],但其并未获得该基因的全长cDNA序列,同时未对该基因的序列特征进行分析。有鉴于此,本研究以对霜霉病抗性较强的鲜食葡萄品种金星无核为试验材料,首次获得了VvIPK2基因全长cDNA序列,并对其结构特征及其在应答霜霉病菌胁迫过程中的表达模式进行了系统分析,以期为进一步开展葡萄VvIPK2基因功能研究,探讨葡萄抗病的分子机制提供理论依据和基础,同时也为今后利用基因工程技术培育抗病葡萄新品种提供可操作的基因资源。
1 材料与方法
1.1 试验材料
试验于2012年9月在江苏省农业科学院溧水植物科学基地内进行,供试葡萄品种为6年生金星无核。葡萄霜霉病病原菌(Plasmopara viticola)于江苏省农业科学院院内葡萄资源圃病叶上分离获得。
pMD19-T克隆载体、M-MLV逆转录酶、DNaseⅠ酶、Ex-Taq酶、dNTP、荧光染料 SYBR GreenⅠ均购自TaKaRa公司;T4 DNA连接酶购自Promega公司;DNA回收试剂盒、DL 2000 DNA Marker购自上海生物工程技术服务有限公司;DH5α感受态大肠杆菌(Escherichia coli)菌株由作者所在实验室保存;各种引物均由上海英潍捷基贸易有限公司(http://www.invitrogen.com)合成,其编号及序列见表1。
1.2 病原菌制备及接种
从田间采回已受霜霉病菌侵染的病叶,先用自来水冲洗干净,再经蒸馏水冲洗后置于20℃黑暗条件下保湿(相对湿度为95%)24 h,待新孢子囊长出后,用毛刷刷下孢子囊,无菌水配制成1 ml 8×104孢子囊霜霉病菌孢子悬浮液。接种前用载玻片萌芽法测定孢子囊的活性,萌发率高于85%为有效接种液。
挑选金星无核一年生幼嫩枝条喷施1 ml 8×104孢子囊葡萄霜霉病菌孢子悬液至淋湿状态,然后套袋并放入湿棉球保湿,清水处理作对照。分别于接种后 0 h、4 h、12 h、24 h、48 h、72 h 采集经葡萄霜霉病菌侵染的叶片,液氮速冻后,置于-70℃冰箱中保存备用。

表1 引物序列、扩增片段大小及用途Table 1 Sequence of primers,size of amplified product and their applications
1.3 总RNA的提取及cDNA第一链合成
葡萄不同组织及霜霉病菌侵染后不同时期葡萄叶片总RNA的提取均参考北京华越洋生物科技有限公司生产的植物RNA提取试剂盒说明书进行。以总RNA为模板,利用引物P01反转录合成cDNA第一条链,引物P02延伸加帽子,空气加热条件下42℃保温1 h,75℃保温10 min,冰上冷却2 min后,-70℃保存备用。
1.4 葡萄VvIPK2基因全长cDNA克隆
根据GenBank中已登录的葡萄VvIPK2基因部分cDNA序列,参照王西成等[26]电子克隆方法克隆葡萄VvIPK2基因的全长cDNA序列。以cDNA为模板,利用引物 P03/P04进行 PCR扩增,获得VvIPK2基因的完整ORF序列。反应体系(25μl)为引物 P03/P04(10 μmol/L)各 1 μl,Ex-Taq酶 (5 U/μl)0.25 μl,10 × PCR buffer(Mg2+plus)2.5 μl,dNTPMixture(10 mmol/L)2μl,上一步合成的cDNA 2μl,ddH2O补足至25μl。反应参数:94℃预变性5 min;94℃变性40 s,67℃退火40 s,72℃延伸1 min,共35个循环;72℃延伸10 min,4℃保存。扩增产物进行琼脂糖凝胶电泳检测,目的片段用DNA凝胶回收试剂盒进行回收,最后将目标片段连接到pMD-19T simple载体上进行T/A克隆,DNA测序由上海美吉生物医药科技有限公司(http://www.majorbio.com)完成。
以cDNA为模板,分别利用引物 P05/P06和P07/P08进行PCR扩增获得VvIPK2基因的5'和3'非编码区(UTR)序列。反应体系为25μl:Ex-Taq酶 (5 U/μl)0.25 μl,10 × PCR buffer(Mg2+plus)2.5 μl,dNTP mixture(10 mmol/L)2.0 μl,cDNA 2.0μl,引物 P03/P04或 P05/P06(10μmol/L)各1.0μl,ddH2O补足至25μl。反应参数:94℃预变性5 min;94℃变性30 s,62℃退火40 s,72℃延伸50 s,共35个循环;72℃延伸10 min,4℃保存。目的片段的检测、回收与测序均同上。
1.5 葡萄VvIPK2基因序列分析
利用DNAMAN 5.22软件对 ORF、5'末端和3'末端3个序列进行拼接分析;核苷酸和氨基酸序列分别利用NCBI的BLASTn和BLASTp(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行相似性分析;用DNAMAN 5.22软件分析葡萄VvIPK2氨基酸序列与其他植物氨基酸序列的关系。
1.6 葡萄VvIPK2基因表达分析
分别提取金星无核葡萄不同组织及接种霜霉病菌后不同时期的叶片总RNA,经DNaseⅠ酶(RNase free)消化后分别取2μg,并以P01和P02引物进行反转录合成cDNA。利用Primer 3 Input(http://frodo.wi.mit.edu/primer3/)进行相关引物的设计,研究该基因在金星无核葡萄中的时空表达情况。以葡萄看家基因UBI(GenBank accession number:XM_002266714)作为内标基因进行qRT-PCR分析,目的基因相关引物序列见表1。qRT-PCR参照已有报道[26-27],利用 Bio-Rad My-IQ2荧光定量 PCR 仪,对目的基因的时空表达特性进行实时荧光定量分析。反应体系按照SYBR Green I(TOYOBO)的说明书进行,反应条件为:95℃预变性10 s;95℃变性10 s,退火20 s,72℃延伸30 s,40个循环,同一样品共设置3次重复,实验数据采用 LinRegPCR[28]和 Excel软件进行分析。
2 结果与分析
2.1 葡萄VvIPK2 cDNA全长的获得及序列分析
首先以GenBank中已登录的部分葡萄VvIPK2基因的cDNA序列(JQ429083)为种子序列在葡萄EST数据库中进行BLAST检索,将检出的与种子序列同源性较高或有部分重叠的EST序列拼接组装为重叠群(Contig),再以此Contig为种子序列重复上述BLAST检索过程,反复进行EST重叠群序列的拼接和比对,尽可能获得葡萄VvIPK2基因的全长cDNA序列。
根据已获得的葡萄VvIPK2基因cDNA全长拼接序列设计特异引物,进而以葡萄不同组织样品的混合cDNA为模板进行PCR扩增,获得VvIPK2基因的完整ORF序列(图1A)。同样根据电子克隆的序列设计特异引物 P05/P06,并利用特异PCR扩增,经克隆测序获得该基因的5'末端(图1B)。在所获得的ORF内设计上游引物P07与下游引物P08扩增获得VvIPK2基因的3'末端,包含3'UTR区和Poly A结构(图1C)。

图1 VvIPK2基因ORF(A)、5'末端(B)和3'末端(C)的扩增结果Fig.1 Am p lification of ORF(A),5'end sequence(B)and 3'end sequence(C)of VvIPK2 gene
测序完成后对所获得的VvIPK2基因的5'末端、ORF以及3'末端序列进行全长cDNA序列的拼接。拼接结果显示该基因的全长cDNA序列为1 853 bp,其中包括918 bp的开放阅读框(ORF),615 bp的5'非编码区,290 bp的3'非编码区,以及30 bp的poly+(A)(图2)。该基因已提交至NCBI,在Gen-Bank数据库中的登录号为:KF752483。该基因ORF区编码一个含305个氨基酸的蛋白质,BioXM 2.6预测VvIPK2所编码蛋白质的分子量为3.421×104,理论等电点(PI)为5.38。
2.2 葡萄VvIPK2基因推导的氨基酸序列同源性分析及系统进化树构建
为进一步分析VvIPK2的进化地位,本研究从NCBI公共数据库中下载了拟南芥、盐芥、大豆和菜豆共4个物种的IPK2氨基酸序列,用DNAMAN5.22软件进行序列比对和系统进化树的构建。结果表明,5条蛋白质序列含264~304个氨基酸残基,序列之间差异较大,说明该基因在进化上并不十分保守,而不同物种间氨基酸序列的差异会导致其在功能上有所不同(图3)。
系统进化树分析结果表明,葡萄VvIPK2氨基酸序列与其他物种之间遗传距离均较远,在全部比较的4个物种中,与拟南芥同源性最高,达65.23%;与盐芥同源性次之,为63.56%;而与大豆和菜豆的同源性则分别为54.84%和52.18%(图4)。

图2 VvIPK2基因的核苷酸序列及其推导的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of VvIPK2
2.3 葡萄VvIPK2基因在不同组织及不同处理下的表达
为了解VvIPK2基因在葡萄不同组织,以及葡萄叶片在接种霜霉病菌后不同时期的表达情况,本研究以UBI作为内参基因,利用qRT-PCR技术对该基因的时空表达特征进行了分析。结果发现,该基因在葡萄根、茎、叶、花中均有表达,但表达水平存在一定差异。其中,在叶片中的相对表达水平最高,根中的相对表达水平最低(图5)。
而在接种霜霉病菌后的72 h内,VvIPK2基因的相对表达水平均高于对照(处理0 h),且呈现出先升高后降低的表达趋势。尤其在处理后12 h时,该基因的相对表达水平得到显著提高,约为对照样品表达量的22.5倍,之后开始逐渐下降,并于处理72 h后降至接近正常水平(图6)。该结果表明,霜霉病菌可有效诱导葡萄叶片中VvIPK2基因的上调表达。
3 讨论

图3 VvIPK2基因与其他植物IPK2基因推导氨基酸序列的多重比较Fig.3 Alignment of the amino acid sequence of VvIPK2 and IPK2 genes of other plants

图4 葡萄VvIPK2基因编码的氨基酸序列与其他物种的系统进化树Fig.4 Phylogenetic tree of grapevine and other plants based on the amino acid sequence encoded by VvIPK2

图5 VvIPK2基因在葡萄不同组织中的表达水平Fig.5 Expression of VvIPK2 gene in different tissues of grapevine
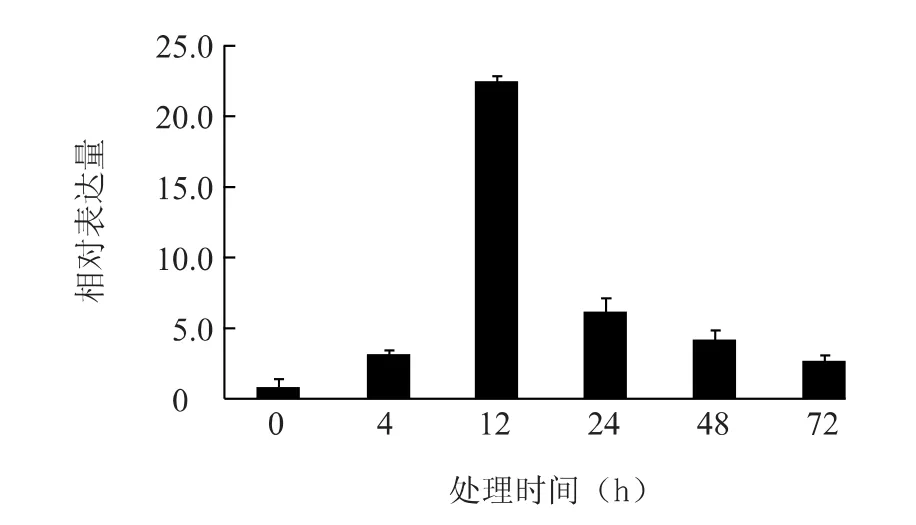
图6 霜霉病菌侵染后VvIPK2基因在叶片的表达水平Fig.6 Expression of VvIPK2 gene in grapevine infected by Plasmopara vitieola
葡萄霜霉病遍及世界各个葡萄产区,是葡萄生产上重要的真菌性病害之一[17,29]。霜霉病菌主要危害葡萄叶片,在发病初期可通过侵染叶片形成不规则黄褐色斑块,严重时会导致叶片干枯脱落,大幅降低植株的光合效率;而当进入发病后期时,还可进一步侵染葡萄嫩稍、叶柄、幼果等部位,直接导致减产30% ~50%,重者甚至减产 80%以上[15,30]。鉴于葡萄霜霉病给世界葡萄产业发展所带来的严重影响,积极开展葡萄抗病新品种选育工作就显得尤为重要。Keen等[31]认为植物的抗病性是植物为了抵抗病原物的侵染、扩展和危害而在形态结构和生理生化,以及时间和空间上的综合表现,其实质是抗病相关基因表达的结果。而葡萄作为世界性重要果树,积极研究其中蕴含的丰富基因,特别是抗病基因具有重要的科学意义和应用价值。
在葡萄抗霜霉病基因研究方面,Luo等[32]首先通过RAPD标记技术发现了与葡萄抗霜霉病主效基因紧密连锁的RAPD标记OPO06-1500,并证明该抗病标记在中国野生种株系中均存在。Fischer等[18]通过SSR技术定位了一个抗霜霉病的微效基因VvMD27。Kortekamp等[33]则通过差异显示技术对接种葡萄霜霉菌12 h的抗病河岸葡萄(Vitis riparia)Gloire de Montpellier和感病欧洲葡萄Riesling进行了研究,发现并分离到一个定位于10号连锁群的VRP-1抗病基因。Di等[34]通过对欧洲葡萄染色体连锁图谱进行分析,发现了分布在7个连锁群上的82个抗病基因相似序列(RGA)标记,其中部分标记可定位在染色体的控制抗病表型的区域。而王沛雅等[35]则以中国原产抗霜霉病葡萄野生种华东葡萄(Vitis pseudoreticulata)白河-35-1为材料,利用SMARTTM技术成功构建了由葡萄霜霉菌(Plasmopara viticola)诱导的葡萄叶片cDNA文库,进一步对文库中所得已知功能的ESTs进行蛋白功能预测分析,结果发现了部分编码抗病防御蛋白相关的基因。
鉴于多磷酸肌醇激酶基因在植物逆境胁迫过程中所发挥的重要作用[23-25,36],本研究在已有的葡萄多磷酸肌醇激酶基因片段的基础上,进一步利用电子克隆结合RACE技术成功地从金星无核葡萄中分离到一个葡萄VvIPK2基因的全长cDNA序列。序列分析结果表明,该基因与多种植物已知氨基酸序列的同源性为52.18% ~65.23%,说明该基因在进化上具有并不十分保守的特点。尽管该基因在葡萄各个组织中均有表达,但其在叶片和茎中的表达水平要稍高于根和花,这与霜霉病菌主要危害葡萄叶片,严重时还会侵染嫩梢的特性之间可能存在某种程度的关联。病菌接种试验结果表明,葡萄叶片在受霜霉病菌侵染后的72 h内,VvIPK2基因的表达水平始终高于对照叶片(处理0 h),且在接种后12 h时该基因的相对表达水平达到最高值,为对照的22.5倍,远高于高超等[25]所获得的高于正常水平12倍的研究结果,说明VvIPK2基因积极参与了葡萄应答霜霉病的过程。
总之,本研究通过分离葡萄多磷酸肌醇激酶基因VvIPK2的全长cDNA序列,并对其序列特征和时空表达特点进行了初步研究,发现该基因可能在葡萄应答霜霉病菌侵染过程中发挥着重要的作用,这为进一步通过基因工程手段验证其功能,进而从分子水平上揭示葡萄对于霜霉病的抗性机理提供了重要的理论参考。
[1] 贺普超.葡萄学[M].北京:中国农业出版社,1999:298-300.
[2] 王庆莲,吴伟民,赵密珍,等.秋延后栽培对葡萄生长与果实品质的影响[J].江苏农业学报,2013,29(6):1438-1444.
[3] 李鹏程,郭绍杰,李 铭,等.新型复混调节剂对葡萄生长及果实性状的影响[J].江苏农业科学,2013,41(12):166-167.
[4] 王西成,钱亚明,赵密珍,等.江苏地区设施葡萄常用品种需冷量研究[J].江苏农业科学,2013,41(10):120-122.
[5] 郭绍杰,吴新宏,李 铭,等.水肥耦合对新疆克瑞森无核葡萄产量的影响[J].江苏农业科学,2013,41(10):125-126.
[6] JANG M,CAI L,GEORGE O,et al.Cancer Chemopreventive activity of resveratrol,a nutural,product derived from grapes[J].Science,1997,275:218-220.
[7] WAFFO-TEGUO P,KRISA S,RICHARD T,et al.Bioactive molecules andmedicinal plants:Grapevine stilbenes and their biological effects[M].Heidelberg:Springer,2008:25-54.
[8] TROUVELOT S,VARNIER A L,ALLEGRE M,et al.A-1,3-glucan sulfate induces resistance in grapevine againstPlasmopara viticolathrough priming of defense responses,including HR-like cell death[J].Molecular Plant-Microbe Interactions,2008,21(2):232-243.
[9] 宋润刚,李小红,路文鹏,等.东北山葡萄霜霉病防治技术研究[J].中外葡萄与葡萄酒,2001(3):15-20.
[10] HVARLEVA T,BAKALOVA A,RUSANOV K,et al.Toward marker assisted selection for fungal disease resistance in grapevine[J].Biotechnology & Biotechnological Equipment,2009,23:1431-1435.
[11] DRY IB,FEECHAN A,ANDERSON C,et al.Molecular strategies to enhance the genetic resistance of grapevines to powdery mildew [J].Australian Journal of Grape and Wine Research,2010,16:94-105.
[12] FERREIRA R B,MONTEIROSS,PICARRA-PEREIRAM A,et al.Engineering grapevine for increased resistance to fungal pathogens without compromising wine stability[J].Trends in Biotechnology,2004,22:168-173.
[13] AZIZ A,TROTEL-AZIZ P,DHUICQ L,et al.Chitosan oligomers and copper sulfate induce grapevine defense reactions and resistance to graymold and downy mildew[J].Phytopathology,2006,96(11):1188-1194.
[14] ALLEGR M,DAIRE X,HELOIR M C,et al.Stomatal deregulation inPlasmopara viticolainfected grapevine leaves [J].New Phytologist,2007,173(4):832-84.
[15] 吕秀兰,苟 琳,龚荣高,等.葡萄品种对霜霉病抗性鉴定的生化指标研究[J].植物病理学报,2004,34(6):512-517.
[16]房玉林,宋士任,张艳芳,等.不同品种葡萄抗霜霉病特性与叶片POD、PPO活性关系的研究[J].西北植物学报,2007,27(2):392-395.
[17] 刘天明,李 华,张政文.鲜食葡萄品种对霜霉病的抗性及抗病机理研究[J].植物保护学报,2001,28(2):118-122.
[18] FISCHER BM,SALAKHUTDINOV I,AKKURTM,et al.Quantitative trait locus analysis of fungal disease resistance factors on a molecularmap of grapevine [J].Theory Application Genetics,2004,108(3):505-515.
[19] WELTER L J,GOKTURK-BAYDAR N,AKKURTM,et al.Genetic mapping and localization of quantitative trait loci affecting fungal disease resistance and leafmorphology in grapevine(Vitis viniferaL.)[J].Molecular Breeding,2007,20:359-374.
[20] 崔洪宇,孙玉河.植物抗病的Ca2+信号转导研究进展[J].天津农业科学,2007,13(1):48-51.
[21] ZHAO S Z,QI X Q.Signaling in plant disease resistance and symbiosis[J].Journal of Integrative Plant Biology,2008,50(7):799-807.
[22] LECOURIEUX D,RANJEVA R,PUGIN A.Calcium in plant defence signalling pathways[J].New Phytologist,2006,171(2):249-269.
[23] YANG L,TANG R J,ZHU JQ,et al.Enhancement of stress tolerance in transgenic tobacco plants constitutively expressing Atlpk2,an inositol polyphosphate 6-/3-kinase fromArabidopsis thaliana[J].Plant Molecular Biology,2008,66(4):329-343.
[24] ZHU JQ,ZHANG JT,TANGR J,et al.Molecular characterization ofThIPK2,an inositol polyphosphate kinase gene homolog fromThellungiella halophila,and its heterologous expression to improve abiotic stress tolerance inBrassica napus[J].Physiologia Plantarum,2009,136(4):407-425.
[25] 高 超,侯丽霞,郭秀萍,等.葡萄应答霜霉病过程中多磷酸肌醇激酶基因与过氧化氢的作用机制[J].植物保护学报,2011,38(5):443-448.
[26] 王西成,吴伟民,房经贵,等.葡萄赤霉素受体基因VvGID1A的分离、亚细胞定位及表达分析[J].园艺学报,2013,40(5):839-848.
[27] 王西成,任国慧,房经贵,等.葡萄赤霉素合成相关基因克隆、亚细胞定位和表达分析[J].中国农业科学,2012,45(11):2224-2231.
[28] RAMAKERSC,RUIJTERA JM,LEKANE DEPREZA R H,et al.Assumption-free analysis of quantitative real-time polymerase chain reaction(PCR)data [J].Neuroscience Letters,2003,339:62-66.
[29] 刘会宁,许德秀.塑料大棚欧亚种葡萄对霜霉病和白粉病的抗性研究[J].中外葡萄与葡萄酒,2004(3):22-24.
[30] 王国珍,樊仲庆,麻冬梅,等.贺兰山酿酒葡萄霜霉病流行规律及测报技术[J].植物保护学报,2004,30(4):54-55.
[31] KEEN N T.The molecular bio1ogy of disease resistance[J].PlantMolecular Biology,1992,19:109-122.
[32] LUO SL,HEPC,ZHOU P,et al.Identification ofmolecular genetic markers tightly linked to downy mildew resistant genes in grape[J].Acta Genetica Sinica,2001,28(1):76-82.
[33] KORTEKAMP A,WELTER L,VOGT S,et al.Identification,isolation and characterization of a CC-NBS-LRR candidate disease resistance gene family in grapevine [J].Molecular Breeding,2008,22(3):421-432.
[34] DIGASPERO G,CIPRIANIG,ADAM-BLONDON A F T,et al.Linkagemaps of grapevine displaying the chromosomal locationsof 420 microsatellite markers and 82 markers forR-gene candidates[J].Theory Application Genetics,2007,114(7):1249-1263.
[35] 王沛雅,王跃进,张建文,等.华东葡萄白河-35-1株系抗霜霉病基因cDNA文库构建及EST分析[J].农业生物技术学报,2009,17(2):294-300.
[36] BLUME B,NURNBERGER T,NASSN,et al.Receptor-mediated increase in cytoplasmic free calcium required for activation of pathogen defense in parsley [J].Plant Cell,2000,12(8):1425-1440.
